第八章配位化合物
- 格式:doc
- 大小:1.41 MB
- 文档页数:14






无机化学:第八章配位化合物第八章配位化合物一、配合物的基本概念1、配位化合物的定义及其组成定义:把由一定数目的阴离子或中性分子与阳离子或原子以配位键形成的复杂分子或离子称配合单元。
含有配合单元(配位键)的化合物即配合物。
配合物可看成是一类由简单化合物反应生成的复杂化合物。
配合单元相对稳定,存在于晶体及溶液中,在溶液中不能完全离解为简单组成的部分。
配位键——由配体单方面提供电子对给中心原子(离子)而形成的共价键。
中心离子(或中心原子)——又称“配合物形成体”。
特征:带有空轨道。
组成中心离子的元素种类:◆能充当中心离子的元素几乎遍及元素周期表的各个区域,但常见的是金属离子,尤其是一些过渡金属离子,如[Co(NH3)6]3+、[Fe(CN)6]4—、[HgI4]2—。
◆高氧化态非金属元素原子:如B、Si、P等形成[ BF4]—、[SiF6]2—、PF6—。
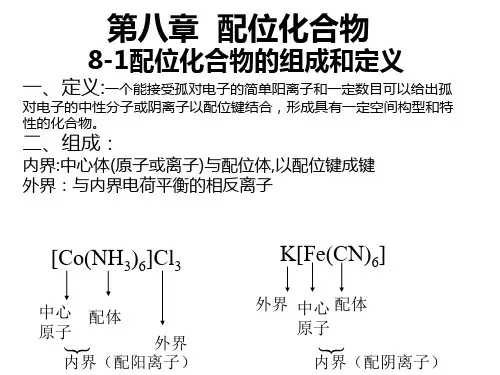
◆金属元素电中性原子:如[ Ni(CO)4]、[ Fe(CO)5]、[Cr(CO)6]配合物的组成:配合物由内界和外界组成。
内界为配合物的特征部分(即配位个体),是一个在溶液中相当稳定的整体,在配合物的化学式中以方括号表明。
方括号以外的离子构成配合物的外界。
内外界之间以离子键结合,故在水溶液中易解离出外界离子,而内界即配合单元很难发生离解。
如[Cu (NH3)4] SO4↓↓↓中心原子,配位体,外界在配合物中同中心原子/离子配位的分子如NH3、H2O或阴离子如Cl—、CN—、SCN—称为配位体,简称配体。
配体属于Lewis碱,都含有孤对电子,是电子对的给予体。
中配体无机化学配位化学CO 一氧化碳羰基OH—氢氧根离子羟基NO2—亚硝酸根硝基ONO—亚硝酸根亚硝酸根SCN—硫氰酸根硫氰酸根NCS—硫氰酸根异硫氰酸根Cl—氯离子氯配位体中与中心离子(或原子)直接成键的离子称为配位原子。
配位体所提供的孤对电子即是配位原子所具有的孤对电子。
常见的配位原子有:F、Cl、Br、配位体分类——单齿配体和多齿配体单齿配体:一个配位体只提供1个孤对电子与1个中心离子结合形成1个配位键。



曲靖医学高等专科学校
教案
2011至2012学年秋季学期
系部药学系
教研室(实验室)药学教研室
课程名称医用化学
授课班级护理7、8 助产1、2
授课教师孙晶
职称讲师
使用教材《医用化学》主编于敬海
教案编写日期2011年10月
曲靖医学高等专科学校教务制
教案(首页)
为了解释上述情况,化学家曾提出瑞士著名化学家,苏黎世大学教授。
在科学上崇拜德国,
却表现了几何学的空间概念和丰富的想象力在化学方面的创造性的应用。
普鲁士蓝对治疗经口急慢性铊中毒有一定疗效。
在医疗上铊可置换上的钾后形成不溶性物质
月,清华大学92级化学系物理化学和仪器分析专业
被人投了铊毒,病情严重。
1995年4月底,
治所的陈震阳教授化验确诊后,在协和医院,医用普鲁士蓝被用来救
溶液,Cu(OH)2?
溶液,BaSO4?
,存在于新微粒中;
Cu2+、Zn2+、Ag+、H2O、NH
哪些可以作为中心原子?哪些可以作为配位体?
3、配位数
中心原子形成的配位键的数目叫它的配位数。
螯合物
一、螯合物和螯合剂
螯合物:多齿配体与单个中心离子(或原子)所形成的环状的配合物
螯合效应:由于螯合物的形成而使配合物具有稳定性大大加的作用。
螯合环一般为五元环和六元环。
两个配原子之间一般相隔2~3个其它原子。
形成的螯环的数目越多,
增大。
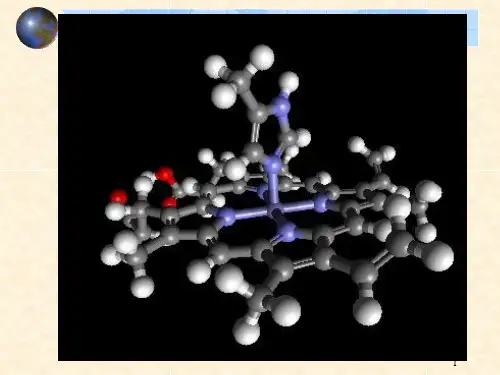
EDTA-Co(III)螯合物的立体结构图
能治疗铊中毒的蓝药水:二、螯合物的应用
人体必须的微量元素Fe、Zn、、I、Co、Se、Mn、Mo等都以配合物形式存在于体内,其中金属离子为中心原子,生物大分子(蛋白质、核酸等)为配体。
有些微量元素是酶的关键成分,大约1/3的酶是。