【环境化学】第2.3章 大气环境化学——3.6 光化学烟雾污染
- 格式:ppt
- 大小:747.00 KB
- 文档页数:65

名词解释1、环境污染——由于人为因素使环境的构成或状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件,就叫环境污染。
2、环境化学——是在化学科学的传统理论和方法基础上发展起来的,以化学物质在环境中出现而引起的环境问题为研究对象,以解决环境问题为目标的一门新兴学科。
3、污染物的迁移——指污染物在环境中所发生的空间位移及其所有引起的富集、分散和消失的过程。
4、化学污染物——是指由人类活动产生的天然环境化学组分共存和相互作用又可能产生不良生态效应或健康效应的化学物质。
5、环境污染化学——主要研究化学污染物在生态环境体系中的来源、转化、归宿及生态效应的学科。
又分为大气、水体和土壤三个部分。
6、光化学烟雾——碳氢化合物和氮氧化物等一次污染物在强烈太阳光作用下发生化学反应而生成一些氧化性很强的二次污染物(如臭氧、PAN,硝酸等),这些反应物和产物的混合物所形成的烟雾,称光化学烟雾。
7、温室效应——大气具有易使太阳短波辐射到达地面而拦截地表向外放出长波辐射的作用,而使地球表面温度升高的现象。
8、积聚膜——DP在 0.05~2 um范围内,主要来源于爱根核膜的凝聚,燃烧过程所产生蒸汽冷凝、凝聚,以及由大气化学反应所产生的各种气体分子转化成的二次气溶胶等。
积聚膜的粒子不易被干、湿沉降去除,主要的去除途径是扩散,这两种膜合称为细粒子。
9、爱根核膜——粒径小于0 .05um,主要来源于燃烧过程所产生的一次气溶胶粒子和气体分子通过化学反应均相成核转换的二次气溶胶粒子,所以又称成核型。
10、酸雨——由于酸性物质的湿沉降而形成的。
11、粗粒子膜——DP大于2um,主要来源于机械过程所造成的扬尘,海盐溅沫、火山灰和风砂等一次气溶胶粒子,主要靠干沉降和雨水冲刷去除。
12、敏化光解——水体中存在的天然物质被阳光激发,又将其激发态的能量转移给化合物而导致的分解反应。
13、生物富集——是指生物通过非吞食方式,从周围环境蓄积某种元素或难降解物质,使其在机体内浓度超过周围环境中浓度的现象。

大气环境化学思考题与习题参考答案一、思考题1、大气环境化学主要研究什么?其研究意义是什么?答:大气环境化学主要研究大气环境中化学污染物的分布、转化、迁移和归宿的规律。
其研究意义在于揭示大气环境污染物变化的原因和过程,为预防和治理大气环境污染提供科学依据。
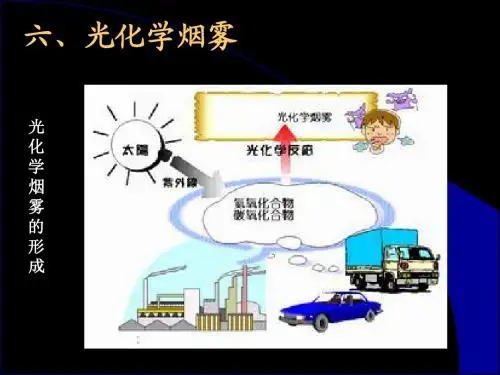
2、什么是光化学烟雾?其形成机制是什么?答:光化学烟雾是指汽车尾气中的氮氧化物和挥发性有机物在紫外线照射下,经过一系列光化学反应生成的蓝色烟雾。
其形成机制是氮氧化物和挥发性有机物在紫外线照射下,经过一系列光化学反应生成了二次污染物,如臭氧、过氧乙酰硝酸酯、酮类等。
3、大气中的哪些化学物质会对人体健康产生负面影响?其作用机制是什么?答:大气中的许多化学物质会对人体健康产生负面影响,如二氧化硫、氮氧化物、一氧化碳、臭氧、挥发性有机物等。
它们的作用机制主要包括刺激呼吸道、引起呼吸道炎症、损伤神经系统、致癌等。
4、什么是大气颗粒物?它对人体健康有哪些影响?答:大气颗粒物是指大气中的固体或液体颗粒状物质,按其粒径大小可分为可吸入颗粒物和总悬浮颗粒物。
可吸入颗粒物可深入人体呼吸道,对人体健康产生严重影响,如引起呼吸系统疾病、心血管疾病等。
总悬浮颗粒物则主要影响人体皮肤和眼睛。
5、大气中的哪些化学物质会对环境产生负面影响?其作用机制是什么?答:大气中的许多化学物质会对环境产生负面影响,如二氧化硫、氮氧化物、挥发性有机物等。
它们的作用机制主要包括酸雨、臭氧层破坏、温室效应等。
二、习题参考答案1、下列哪个选项不属于大气环境化学的研究范围?A.大气污染物的排放与分布B.大气污染物的转化与迁移C.大气污染物的生理效应D.大气污染物的治理技术答案:D.大气污染物的治理技术。
大气环境化学主要研究大气环境中化学污染物的分布、转化、迁移和归宿的规律,以及它们对环境和人类健康的影响。
治理技术属于环境保护工程领域的研究范畴,不属于大气环境化学的研究范围。
2、光化学烟雾的主要成分不包括以下哪个?A.氮氧化物B.挥发性有机物C.二氧化硫D.臭氧答案:C.二氧化硫。


学反应而产生二次污染物,这种由一次污染物和二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾特征:是烟雾呈蓝色,具有强氧化性,能使橡胶开裂,刺激人的眼睛,伤害植物的叶子,并使大气能见度降低。
2.光化学烟雾的控制对策:1.控制反应活性高的有机物的排放 2.控制臭氧的浓度3.专属吸附:吸附过程中,除了化学键的作用外,尚有加强的憎水键和范德华力或氢键在起作用。
4.硫酸烟雾型污染:形成原因:主要是由于燃煤而排放出来的SO2,颗粒物以及由SO2氧化所形成的硫酸盐颗粒物所造成的大气污染现象。
形成条件:多发生在冬季、气温较低、湿度较高和阳光较弱的气象条件下5.酸性降水:指通过降水如雨,雾,冰雹等将大气中的酸性物质迁移到地面的过程6.降水的化学组成:1.大气中固定气体成分O2,N2,CO2,H2,以及稀有气体。
2.无机物,3.有机物 4.光化学反应物 5.不容物7.降水中的离子成分:SO42-,NO3-,Cl-,铵根离子,钙离子,氢离子。
8.影响酸雨形成的因素:1.酸性污染物的排放及其转化条件 2.大气中的氨气 3.颗粒物酸度及其缓冲能力9.诱发沉积物中重金属释放的因素:1.盐浓度升高 2.氧化还原条件的变化 3.降低pH 4.增加水中配合剂的含量10.吸附等温线:在固定的温度条件下,当吸附达到平衡时,颗粒物表面上的吸附量与溶液中溶质平衡浓度之间的关系11.决定电位:若某个体系的含量比其他体系高得多,则此时该体系电位几乎等于混合复杂体系的pE12.电子活度:电极上电子有效浓度为电子活度, 记作E , 其负对数记作pE13.凝聚---- 由电解质促成的聚集絮凝---- 由聚合物促成的聚集14.清洁区:表明未被污染,氧及时得到补充。
分解区:细菌对排入的有机物进行分解,其消耗的溶解氧量超过通过大气补充的氧量,因此,水体溶解氧下降,此时细菌个数增加。
腐败区:溶解氧消耗殆尽,水体尽心缺氧分解,当有机物被分解完后,腐败去即告结束,溶解氧又恢复上升恢复区:有机物降解接近完成,溶解氧上升并接近饱和清洁区:水体环境改善,又恢复至原始状态15.分配作用:即在水溶液中,土壤有机质对有机物的溶解作用,而且在溶质的整个溶解范围内,吸附等温线都是线性的,与表面吸附位无关,只与有机物的溶解度有关,因而放出的吸附热量小16.吸附作用:即在非极性有机溶剂中,土壤矿物质对有机物的表面吸附作用或干土壤矿物质对有机物的表面吸附作用。


第⼆章⼤⽓环境化学(3)第⼆章⼤⽓环境化学(3)第三节⼤⽓中污染物的转化⼆、光化学反应基础1、光化学反应⼀个原⼦、分⼦、⾃由基或离⼦吸收⼀个光⼦所引发的反应,称为光化学反应。
光化学反应的起始反应(初级过程)是:A + hν→A* (2-1)式中A*为A的激发态,激发态物种A*进⼀步发⽣下列各种过程。
光解(离)过程:A* → B1 + B2+…(2-2)直接反应:A* + B → C1+C2+… (2-3)辐射跃迁:A* → A + hν(荧光、磷光) (2-4)⽆辐射跃迁(碰撞失活):A* + M → A+M (2-5)其中(2-2)、(2-3)为光化学过程,(2-4)、(2-5)为光物理过程。
对于⼤⽓环境化学来说,光化学过程最重要的是受激分⼦会在激发态通过反应⽽产⽣新的物种。
初级光化学过程包括光解离过程、分⼦内重排等。
分⼦吸收光后可解离产⽣原⼦、⾃由基等,它们可通过次级过程进⾏热反应;光解产⽣的⾃由基及原⼦往往是⼤⽓中·OH、HO2·和RO·等的重要来源;对流层和平流层⼤⽓中的主要化学反应都与这些⾃由基或原⼦的反应有关。
次级过程是指初级过程中反应物、⽣成物之间进⼀步发⽣的反应。
例如,H2和Cl2混合物光解,发⽣链式反应:Cl2 + hν→2Cl·Cl· + H2→HCl + H·H· + Cl2→HCl + Cl·2Cl·→Cl22、光化学定律1)格鲁塞斯(Grotthus)与德雷伯(Drapper)提出了光化学第⼀定律:只有被分⼦吸收的光,才能有效地引起分⼦的化学变化。
2)爱因斯坦(Einstein)光化学第⼆定律:在光化学反应的初级过程中,被活化的分⼦数(或原⼦数)等于吸收光的量⼦数,或者说分⼦对光的吸收是单光⼦过程,即光化学反应的初级过程是由分⼦吸收光⼦开始的。
E=hν=hC/λE = hνN0 = N0hC/λ式中:λ为光量⼦的波长;h为普朗克常数,6.626×10-34J·s/光量⼦;C为光速,2.9979×1010 cm/s;N0为阿伏加德罗常数,6.022×1023/mol;代⼊上式得:E= 119.62 ×106/λ若λ=300 nm, E=398.7 kJ/mol ;λ=700 nm, E=170.9 kJ/mol 。

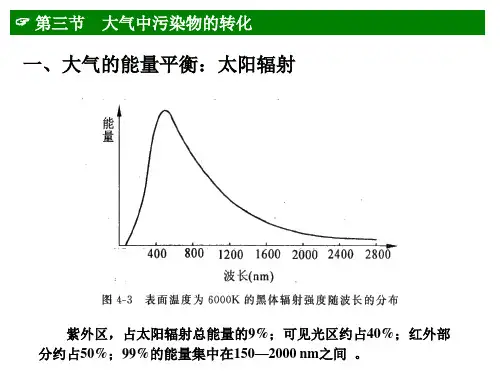
大气中污染物的迁移2大气的组成及其主要污染物1大气中污染物的转化3几种代表性的大气污染环境问题4第二章大气环境化学大气污染物按化学组成分类:•含氮化合物(NOx)•含碳化合物(CO, CO, 碳氢化合物HC)2•含硫化合物(SO, H2S, SO3, CS2等)2•含卤素化合物(卤代烃,氯化物,氟化物等)•颗粒物•放射性物质等大气中硫氧化物(SO X )包括SO 2、SO 3、H 2SO 4、SO 42-,其中SO 2为一次污染物,其余均是由SO 2氧化转化形成二次污染物。
SO 2是最早为人类注意的大气污染物之一,世界历史上发生的八大公害事件中,有一半与之有关:1930年12月比利时马斯河谷烟雾事件,一周内造成60多人死亡(逆温);1948年10月美国多诺拉烟雾事件,40%的人患病,20人丧生;1952年12月伦敦烟雾事件,5天逆温,约4000人死亡;1961年日本四日市哮喘事件,患者达817人,死亡数十人。
七、硫氧化物的转化及硫酸烟雾型污染七、硫氧化物的转化及硫酸烟雾型污染对人类健康(主要是刺激呼吸道)、生态环境等均有直接危害SO2在大气中的氧化问题受到人们的作用,而其氧化产物则危害更大,SO2重视。
500ppm 的SO会导致人死亡;损伤叶片,作物减产;腐蚀建筑材料21、SO2的来源和消除•来源:天然源(火山喷发)人为源(矿物燃料燃烧、含硫矿石的冶炼、硫酸生产过程等)人为排放的SO2中有60%来自煤的燃烧,30%来自油的燃烧和炼制。
•消除:形成硫酸或硫酸根,其中SO2→ SO3转化是关键一步;通过干沉降、湿沉降去除。
2、SO2的浓度特征•本底值存在明显的地区变化和高度变化;•其浓度变化与污染源和当地的气象条件(风向、风速、大气稳定度、低层逆温等)有关;3、SO2的转化氧化途径的多样性以及氧化途径受反应条件(如反应由于大气中SO2的化学反应变得物组成、光照、温度和催化剂等)影响较大,使大气SO2十分复杂,其反应途径一般有四种:(1)光化学氧化;(2)被自由基氧化;(3)液相氧化(4)颗粒物表面上的反应。

环境化学名词解释光化学烟雾:空气中氮氧化物和碳氢化合物等一次污染物在阳光照射下发生光化学反应产生二次污染物,这两类污染物的混合物形成的烟雾污染现象称之为光化学烟雾二次颗粒物:大气中某些污染组分之间或这些组分与大气成分之间发生反应而产生的颗粒物称为二次污染物温室效应:大气中CO2吸收了地面辐射出来的红外光,把能量截留于大气之中,从而使大气温度升高,这种现象称作温室效应酸雨:酸雨是指由于空气中的SO2和氮氧化物等酸性污染物通过各类途径引起的PH<5.6的酸性降水。
盐基饱和度:在土壤交换性阳离子中盐基离子所占的百分数阳离子交换量:每千克干土中所含全部阳离子总量。
活性酸度:土壤的活性酸度是土壤中氢离子浓度的直接反应质体流动:由水或是土壤两者共同作用所致的质体的转移土壤的缓冲性能:土壤的缓冲性能是指土壤具有缓和其酸碱度发生激烈变化的能力,它可以保持土壤反应的相对稳定,为植物生长和土壤生物活性创造比较稳定的生活环境总碱度:一个强酸标准溶液滴定,用甲基橙为指示剂,当溶液由黄色变为橙红色停止滴定,此时所得结果称为总碱度,也称为甲基橙碱度。
生物放大:指某些在自然界不能降解或者难降解的的化学物质,在环境中通过食物链和营养剂的叠加在生物体内逐渐富集,浓度越来越大的现象生物富集:处于同一营养剂的生物种群或生物体,从环境中吸收某些元素或难分解的化合物,使其在生物体内的浓度超过环境中的浓度的现象富营养化:生物所需的氮磷等营养物质大量的进入缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,鱼类及其他生物大量死亡的现象称为富营养化原生矿物:各种岩石受到程度不同的物理风化而未经化学风化的碎屑物次生矿物:由原生矿物经过化学风化后形成的新矿物生长代谢:某些有机污染物在微生物代谢时作为食物源提供能量和提供细胞所需的碳并被降解。
生物修复:通过具有降解功能的细菌和真菌等微生物的作用,去除环境中污染物。
被动扩散:脂溶性物质从高浓度侧向低浓度侧转移的过程。
《环境化学(第二版)》戴树桂主编-复习要点大气环境化学:一、大气中污染物的迁移:大气温(密)度层结:静大气的温度和密度在垂直方向上的分布。
大气划分为:对流层,平流层,中间层,热层,逸散层。
对流层:平均厚度12千米;气温随高度的增加而降低,热源来自地面的长波辐射;对流运动显著;每升高100米,气温降低0.6℃;含有全部大气质量3/4的大气和几乎所有的水汽;多种天气现象;污染物的迁移转化;平流层:高度在17-55千米之间;气温随高度的增加而增加,热源来自太阳的紫外辐射;气体状态非常稳定;无天气现象;大气透明度高,适合飞行;中间层:从平流层顶到85千米的高度;气温随高度的增加而降低;热源来自平流层;垂直运动相当剧烈;热层:从平流层顶到800千米之间;温度随高度的增加而迅速上升;空气极稀薄,在太阳紫外线和宇宙射线的辐射下,空气处于高度电离状态,有称电离层;逸散层:超过800千米以上的高空;气体分子受地球引力极小,因而大气质点会不断向星际空间逃逸;大气垂直递减率:随高度的增加气温的降低率,Γ=-dT/dz 。
干绝热垂直递减率:干空气块或未饱和的湿空气块在上升时温度降低值与上升高度的比,用Γd表示。
大气稳定度:气层的稳定程度,即某一高度上的气块在垂直方向上相对稳定的程度;若Γ<Γd ,表明大气是稳定的,Γ>Γd,大气是不稳定的;Γ=Γd,大气处于平衡状态。
影响大气污染物迁移的因素:5风和大气湍流的影响:大气的水平运动成为风,风可使污染物向下风向扩散,从而得到稀释;大气的无规则运动称为大气湍流,湍流可使污染物向各个方向扩散,其中空气的铅直对流运动使得污染物升到高空而扩散。
二、大气中污染物的转化:光化学反应:分子、原子、自由基或离子吸收光子而发生的化学反应,分为初级过程和次级过程。
初级过程:化学物种吸收光量子hv形成激发态物种,基本步骤为:A+h v →A*,随后,激发态A*可能发生如下反应(①、②为光物理过程,③、④为光化学过程):①辐射跃迁:A*→A+h v,②碰撞失活过程:A*+M →A+M,③光离解:A*→B1+B2+……④与其他成分反应:A*+C →D1+D2+……次级过程:在初级过程中反应物、生成物之间进一步发生的反应;大都是热反应。
一、名词解释1、光化学烟雾:2、温室效应:3、水体富营养化:4、敏华光解:5、共代谢:6、土壤污染:7、生物降解:8、优先污染物:答案:1.光化学烟雾:由一次污染物和二次污染物的混合物所形成的烟雾污染现象,称为光化学烟雾。
{含有氮氧化物和碳氢化合物等一次污染物的大气,在阳光照射下发生光化学反应而产生二次污染物(O3、醛类、PAN、HNO3等)} 来自第二章2.温室效应:大气中的CO2等温室气体允许太阳光短波辐射到达地面,但同时吸收了地面辐射出来的红外光,把能量截留在大气之中,从而使大气温度升高的现象。
来自第二章3.水体富营养化:是指氮、磷等营养物质大量进入湖泊、河口、海湾等缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,鱼类及其他生物大量死亡的现象。
来自第三章4.敏华光解:敏化光解是指一种光吸收分子可能将它的过剩能量转移到另一种分子(有机污染物),从而导致该分子(有机污染物)发生分解。
来自第三章5.共代谢:某些有机污染物不能作为微生物的唯一碳源与能源,必须有另外的化合物存在提供微生物碳源或能源时,该有机物才能被降解,这种现象称为共代谢。
来自第四章6.土壤污染:当污染物通过各种途径进入土壤的数量超过了土壤的自净能力,并破坏了土壤的功能,引起土壤质量恶化的现象,称为土壤污染。
来自第四章7.生物降解:是指有机物质在生物作用下,主要通过生物氧化以及其他生物转化,变成更小更简单的分子的过程。
来自第五章8.优先污染物:由于化学污染物种类繁多,世界各国都筛选一些毒性强、难降解、残留时间长、在环境中分布广的污染物优先进行控制,称为优先污染物。
来自第一章二、选择题1、在水体中颗粒物对重金属的吸附量随PH升高而()A.增大 B.减少 C.不变 D.无法判断解析:当pH升高向碱性条件变化时,水体中的碳酸根离子会大量增加,水体中的碳酸根会络合颗粒物表面的重金属,水体中溶解态重金属含量将会升高。
故选择A2、土壤有机质来源不包括()A树脂B腐殖酸C腐黑物D矿物质解析:D 矿物质属于无机物3、大气颗粒物的粒度有艾根核模、积聚模和粗粒子模。