第二章 大气环境化学(3)
- 格式:doc
- 大小:63.50 KB
- 文档页数:6




第二章大气环境化学1、大气层的结构 Layers of the Atmosphere(英文)A、对流层troposphere对流层是大气的最底层,其厚度在赤道附近为16—18km;在中纬度地区为10—12km,两极附近为8—9km。
最显著特点是气温随海拔高度的增加而降低,大约每上升100m,温度降低0.6度。
另一个特点是密度大,大气总质量的3/4以上集中在对流层。
B、平流层stratosphere从对流层顶到海拔高度约为50km的大气层。
特点:①空气没有对流运动,平流运动占显著优势。
②空气比对流层稀薄得多,水汽、尘埃的含量甚微,很少出现天气现象③在高15—60km内,有约20km的一层臭氧层The Ozone Layer。
O2→O•+O•、O•+O2→O3、O3→O•+O2、O3+O•→2O2是臭氧光解的过程。
平流层温度随海拔高度的增加而增加。
C、中间层mesosphere从平流层顶到80km高度的大气层。
空气较稀薄,由于臭氧层消失,温度随海拔高度的增加而迅速降低。
D、热层(电离层)thermosphere从80km到约500km的大气层。
大气温度随海拔高度的增加而迅速增加。
2.大气中的主要污染物含硫化合物;含氮化合物;含碳化合物;含卤素化合物2、辐射逆温层Radiation inversion对流层大气的重要热源是来自地面的长波辐射,故离地面越近气温越高;离地面越远气温越低。
随高度升高气温的降低率称为大气垂直递减率:Γ=-dT/dz T—热力学温度K, z—高度当Γ=0 时,称为等温气层;当Γ<0 时,称为逆温气层。
这时气层稳定性强,对大气的垂直运动的发展起着阻碍作用。
根据逆温形成的过程不同,可分为两种:近地面层的逆温:辐射逆温、平流逆温、融雪逆温、地形逆温;自由大气的逆温:乱流逆温、下沉逆温、锋面逆温气块在大气中的稳定度与大气垂直递减率(Γ)和干绝热垂直递减率(Γd)两者有关。
若Γ<Γd,表明大气是稳定的;若Γ>Γd,大气是不稳定;若Γ=Γd,大气处于平衡状态。





环境化学详细答案————————————————————————————————作者:————————————————————————————————日期:《大气环境化学》第二章重点习题及参考答案1.大气的主要层次是如何划分的?每个层次具有哪些特点?(1)主要层次划分:根据温度随海拔高度的变化情况将大气分为四层。
(2)各层次特点:①对流层:0~18km;气温随高度升高而降低;有强烈的空气垂直对流;空气密度大(占大气总质量的3/4和几乎全部的水汽和固体杂质);天气现象复杂多变。
②平流层:18~50km;平流层下部30~35km以下气温变化不大(同温层),30~35km以上随高度升高温度增大(逆温层);有一20km厚的臭氧层,可吸收太阳的紫外辐射,并且臭氧分解是放热过程,可导致平流层的温度升高;空气稀薄,水气、尘埃的含量极少、透明度好,很少出现天气现象,飞机在平流层低部飞行既平稳又安全;空气的垂直对流运动很小,只随地球自转产生平流运动,污染物进入平流层可遍布全球。
③中间层: 50~80km;空气较稀薄;臭氧层消失;温度随海拔高度的增加而迅速降低;大气的垂直对流强烈。
④热层:80~500km;在太阳紫外线照射下空气处于高度电离状态(电离层),能反射无线电波,人类可利用它进行远距离无线电通讯;大气温度随高度增加而升高;空气更加稀薄,大气质量仅占大气总质量的0.5%。
热层以上的大气层称为逃逸层。
这层空气在太阳紫外线和宇宙射线的作用与大气温度不同,大气的压力总是随着海拔高度的增加而减小。
2. 逆温现象对大气中污染物的迁移有什么影响?一般情况下,大气温度随着高度增加而下降,每上升100m,温度降低0.6℃左右。
即是说在数千米以下,总是低层大气温度高、密度小,高层大气温度低、密度大,显得“头重脚轻”。
这种大气层结容易发生上下翻滚即“对流运动”,可将近地面层的污染物向高空乃至远方疏散,从而使城市上空污染程度减轻。

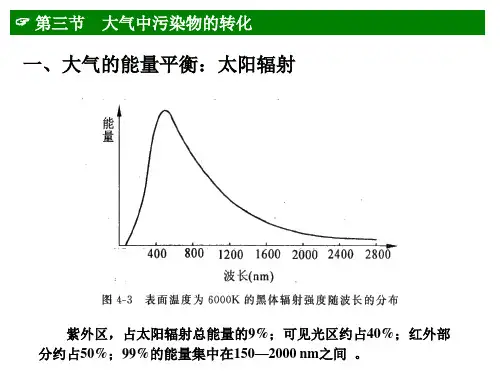
第二章大气环境化学(3)第三节大气中污染物的转化二、光化学反应基础1、光化学反应一个原子、分子、自由基或离子吸收一个光子所引发的反应,称为光化学反应。
光化学反应的起始反应(初级过程)是:A + hν →A* (2-1)式中A*为A的激发态,激发态物种A*进一步发生下列各种过程。
光解(离)过程:A* → B1 + B2+…(2-2)直接反应:A* + B → C1+C2+… (2-3)辐射跃迁:A* → A + hν(荧光、磷光) (2-4)无辐射跃迁(碰撞失活):A* + M → A+M (2-5)其中(2-2)、(2-3)为光化学过程,(2-4)、(2-5)为光物理过程。
对于大气环境化学来说,光化学过程最重要的是受激分子会在激发态通过反应而产生新的物种。
初级光化学过程包括光解离过程、分子内重排等。
分子吸收光后可解离产生原子、自由基等,它们可通过次级过程进行热反应;光解产生的自由基及原子往往是大气中·OH、HO2·和RO·等的重要来源;对流层和平流层大气中的主要化学反应都与这些自由基或原子的反应有关。
次级过程是指初级过程中反应物、生成物之间进一步发生的反应。
例如,H2和Cl2混合物光解,发生链式反应:Cl2 + hν→2Cl·Cl· + H2→HCl + H·H· + Cl2→HCl + Cl·2Cl·→Cl22、光化学定律1)格鲁塞斯(Grotthus)与德雷伯(Drapper)提出了光化学第一定律:只有被分子吸收的光,才能有效地引起分子的化学变化。
2)爱因斯坦(Einstein)光化学第二定律:在光化学反应的初级过程中,被活化的分子数(或原子数)等于吸收光的量子数,或者说分子对光的吸收是单光子过程,即光化学反应的初级过程是由分子吸收光子开始的。
E=hν=hC/λE = hνN0 = N0hC/λ式中:λ为光量子的波长;h为普朗克常数,6.626×10-34J·s/光量子;C为光速,2.9979×1010 cm/s;N0为阿伏加德罗常数,6.022×1023/mol;代入上式得:E= 119.62 ×106/λ若λ=300 nm, E=398.7 kJ/mol ;λ=700 nm, E=170.9 kJ/mol 。
一般化学键的键能大于167.4 kJ/mol ,因此波长大于700 nm 的光量子就不能引起光化学反应。
3、量子产率由于被化学物种吸收了的光量子不一定全部能引起反应,所以引入光量子产额的概念来表示光化学反应的效率。
光物理过程的相对效率也可用量子产额来表示。
当分子吸收光时,其第i 个光化学或光物理过程的初级量子产额φi 可 由下式给出:单位时间)体积吸收的光子数目(单位单位时间)子数目(单位体积过程所产生的激发态分⋅⋅=Φi i对于光化学过程,一般有两种量子产额;初级量子产额(φ)和总量子产额(Φ)。
初级量子产额仅表示初级过程的相对效率,总量子产额则表示包括初级过程和次级过程在内的总的效率。
如果一个物质在光吸收过程中有部分进行光物理过程,又有部分产生光化学过程,那么, 所有初级过程量子产额之和必定等于1。
即Σφi =1.0。
单个初级过程的初级量子产额不会超过1,只能小于1。
当化学过程的φ<<1时,则说明物理过程可能是很重要的。
但光化学反应的总量子产额可能大于1,甚至远大于1。
该链式反应总量子产额可达106。
4、大气中重要吸光物质的光解离由于高层大气中的N 2、O 2特别是平流层中的O 3对于λ<290 nm 的光近乎完全吸收,故低层大气中的污染物主要吸收300~700 nm(相当于398~167 kJ/mol)的光线;下面就主要污染物质的光吸收和初始光解反应特性作一介绍。
(1)氧分子和氮气分子的光解O 2键能:O-O 键,E 0=493.8KJ/mol ,对应能够使其断裂的光子波长为243nm 。
可见,氧原子在243nm 处开始吸光,于147nm 处达到最大。
一般认为波长小于240nm 以下的紫外光能够引起氧分子的光解:O 2+hv(<240nm)→O 2*→O+O(2)O 3的光解臭氧的键能为101.2 KJ/mol ,相应的解离波长为1180nm ,反应式为:O* + O 2 + M → O 3 + MO 3光解后产生的原子氧和分子氧,是否都为激发态取决于激发能。
O 3 + h ν(λ≤320 nm) →O 2 (1△g) + O (1D)O 2 (1△g)和O(1D)都是激发态。
O 3 + h ν(λ≥320 nm) →O 2 (1△g 或1Σg +) + O(3P)反应成了自旋禁戒跃迁。
O 3 + h ν(λ=440~850 nm) →O 2(x3Σg -) + O (3P)O 2 (x 3Σg -)和O(3P)都是基态。
O 3光解在λ=300 nm 时,φ=1;λ<300 nm 时,φ值略小于1;λ>300 nm 时,φ逐渐下降。
由O 3产生的O(1D)一般有两个去除途径,即与水蒸气反应生成·OH,或被空气去活。
(3) NO2的光解二氧化氮是城市大气中最重要的光吸收分子。
在低层大气中,它可吸收可见和紫外光。
λ(NO2)≤420nm的光,发生光解:NO2 + hν(λ≤420 nm) →NO+OO + O2→O3波长300 nm<λ≤380 nm时,其量子产额φ≈1;λ>380 nm时,φ迅速下降;λ=405 nm时,φ=0.36;当λ>420 nm时,φ=0,即NO2不再发生光离解。
其原因在于N-O的键能是305.4 kJ/mol,这相当于400 nm左右波长光子提供的能量;波长大于400 nm的光子,其能量已不足以使键断裂。
(4)硝酸和亚硝酸的光解HO-NO2键能为199.4kJ/mol,对120-335nm的辐射均有不同程度的吸收。
HNO3 (HONO2) + hν→NO2 +·OH上述反应对300 nm以上的光吸收弱,所以它们在大气污染化学中并不重要。
HO-NO键能为201.1kJ/mol,H-ONO的键给为324.0kJ/mol,对200-400nm的光有吸收。
HNO2 (HONO) + hν→NO +·OHRONO + hν→NO + RO·吸收300~400 nm光时,上述反应发生光解,它们是仅次于NO2光解的最重要的光解初始反应。
(5)SO2的光解SO2分解成SO和O的离解能为565 kJ/mol,这相当于波长为218 nm光子的能量,所以在低层大气中SO2不光解;但SO2在240~330 nm区域有强吸收:SO2 + hν→SO2 (1A2,1B1)SO2 (1A2,1B1)是两种单重激发态。
而在340~400 nm处有一弱吸收:SO2 + hν→SO2 (3B1)SO2(3B1)为三重态。
因此,对流层中SO2的转化去除不是靠光解反应。
然而,所形成激发态分子的化学反应活性有所提高。
(6)醛的光解(1) HCHO是对流层大气中的重要光吸收物质,它能吸收290~370 nm波长范围内的光,并进行光解:HCHO + hν→ HCO·+ H·λ<370 nmHCHO + hν→CO +H2λ<320 nm其中途径a尤其重要,生成的HCO·和H·自由基很快与O2反应生成HO2·,是大气HO2·的主要来源,因而也是•OH的来源。
当290 n m<λ<320 nm时,Φ为0.71~0.78。
(2) 乙醛可能的光解过程如下:CH3CHO + hν→CH4 + CO →·CH3 + HC·O →CH3C·O + H·(7)卤代烃的光解卤代烃中,卤代甲烷包括:四卤代甲烷、三卤代甲烷、二卤代甲烷、一卤代甲烷以及氟氯烃类(氟里昂)光解过程为:一卤代甲烷:CH3X+hv→CH3+X(表示F、Cl、Br、I)二、三、四卤代甲烷:断裂顺序I→Br→Cl→H→F,如CC l2Br2+hv→CC l2Br+BrCC l2Br2+hv(高能紫外线)→CClBr+Br+Cl氟里昂:CFC-11: CFCl3+hv→CFCl2+ClCFC-12: CF2Cl2+hv→CF2Cl+Cl上述过程中光解出的自由基F、Cl、Br、I成为臭氧层破坏的重要物质:Cl+O3→ClO+O2ClO+O→Cl+O2总反应:O3+O→2O2(即反应过程中Cl等自由基并不减少,这导致反应的不断进行,使臭氧层损耗)三、大气中重要的自由基及其来源自由基反应是大气化学反应过程中的核心反应。
光化学烟雾的形成,酸雨前体物的氧化,臭氧层的破坏等都与此有关;许多有机污染物在对流层中的破碎、降解也与此有关。
1961年Leighto首次提出在污染空气中有自由基产生,到60年代末,在光化学烟雾形成机理的实验中才确认自由基的存在。
近10多年来对自由基的来源和反应特征有了较多的研究,开拓了大气化学研究的一个新领域。
已经发现大气中存在各种自由基,如·OH、HO2·、NO3·、R·、RO2·、RO·、RCO·、RCO2·、RC(O)O2·、RC(O)O·等,其中·OH、HO2·、RO·、RO2·是大气中重要的自由基,而·OH自由基是迄今为止发现的氧化能力最强的化学物种,能使几乎所有的有机物氧化,它与有机物反应的速率常数比O3大几个数量级。
1、氢氧自由基(hydroxyl radical,·OH)·OH是大气中最重要的自由基,其全球平均浓度约为每cm3含7×105个。
近十几年来的研究表明,·OH自由基能与大气中各种微量气体反应,并几乎控制了这些气体的氧化和去除过程。
如·OH与SO2、NO2的均相氧化生成HOSO2和HONO2是造成环境酸化的重要原因之一;·OH与烷烃、醛类以及烯烃、芳烃和卤代烃的反应速率常数要比与O3的反应大几个数量级。
由此可见,·OH在大气化学反应过程中是十分活泼的氧化剂。
·OH自由基的来源主要有以下几个方面: 1)O3的光分解·OH自由基的初始天然来源是O3的光分解。
当O3吸收小于320 nm光子时,发生以下过程,得到的激发态原子氧O(1D)与H2O分子碰撞生成·OH:O3 + hνO(1D) + O2O(1D) + H2O →2·OH2)HNO2光分解HONO + hν ·OH + NO而HONO的可能来源有:NO2 +H2O、·OH + NO、NO + NO2 + H2O,也有可能来自汽车尾气的直接排放。