02-1环境化学第二章__大气环境化学
- 格式:pptx
- 大小:2.75 MB
- 文档页数:59




第二章大气环境化学1、大气层的结构 Layers of the Atmosphere(英文)A、对流层troposphere对流层是大气的最底层,其厚度在赤道附近为16—18km;在中纬度地区为10—12km,两极附近为8—9km。
最显著特点是气温随海拔高度的增加而降低,大约每上升100m,温度降低0.6度。
另一个特点是密度大,大气总质量的3/4以上集中在对流层。
B、平流层stratosphere从对流层顶到海拔高度约为50km的大气层。
特点:①空气没有对流运动,平流运动占显著优势。
②空气比对流层稀薄得多,水汽、尘埃的含量甚微,很少出现天气现象③在高15—60km内,有约20km的一层臭氧层The Ozone Layer。
O2→O•+O•、O•+O2→O3、O3→O•+O2、O3+O•→2O2是臭氧光解的过程。
平流层温度随海拔高度的增加而增加。
C、中间层mesosphere从平流层顶到80km高度的大气层。
空气较稀薄,由于臭氧层消失,温度随海拔高度的增加而迅速降低。
D、热层(电离层)thermosphere从80km到约500km的大气层。
大气温度随海拔高度的增加而迅速增加。
2.大气中的主要污染物含硫化合物;含氮化合物;含碳化合物;含卤素化合物2、辐射逆温层Radiation inversion对流层大气的重要热源是来自地面的长波辐射,故离地面越近气温越高;离地面越远气温越低。
随高度升高气温的降低率称为大气垂直递减率:Γ=-dT/dz T—热力学温度K, z—高度当Γ=0 时,称为等温气层;当Γ<0 时,称为逆温气层。
这时气层稳定性强,对大气的垂直运动的发展起着阻碍作用。
根据逆温形成的过程不同,可分为两种:近地面层的逆温:辐射逆温、平流逆温、融雪逆温、地形逆温;自由大气的逆温:乱流逆温、下沉逆温、锋面逆温气块在大气中的稳定度与大气垂直递减率(Γ)和干绝热垂直递减率(Γd)两者有关。
若Γ<Γd,表明大气是稳定的;若Γ>Γd,大气是不稳定;若Γ=Γd,大气处于平衡状态。

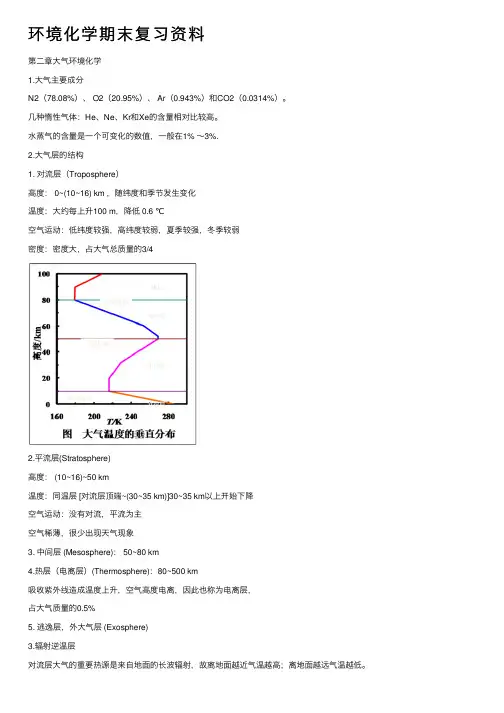
环境化学期末复习资料第⼆章⼤⽓环境化学1.⼤⽓主要成分N2(78.08%)、 O2(20.95%)、 Ar(0.943%)和CO2(0.0314%)。
⼏种惰性⽓体:He、Ne、Kr和Xe的含量相对⽐较⾼。
⽔蒸⽓的含量是⼀个可变化的数值,⼀般在1% ~3%.2.⼤⽓层的结构1. 对流层(Troposphere)⾼度: 0~(10~16) km ,随纬度和季节发⽣变化温度:⼤约每上升100 m,降低 0.6 ℃空⽓运动:低纬度较强,⾼纬度较弱,夏季较强,冬季较弱密度:密度⼤,占⼤⽓总质量的3/42.平流层(Stratosphere)⾼度: (10~16)~50 km温度:同温层 [对流层顶端~(30~35 km)]30~35 km以上开始下降空⽓运动:没有对流,平流为主空⽓稀薄,很少出现天⽓现象3. 中间层 (Mesosphere): 50~80 km4.热层(电离层)(Thermosphere):80~500 km吸收紫外线造成温度上升,空⽓⾼度电离,因此也称为电离层,占⼤⽓质量的0.5%5. 逃逸层,外⼤⽓层 (Exosphere)3.辐射逆温层对流层⼤⽓的重要热源是来⾃地⾯的长波辐射,故离地⾯越近⽓温越⾼;离地⾯越远⽓温越低。
随⾼度升⾼⽓温的降低率称为⼤⽓垂直递减率:Γ=-dT/dz式中:T——热⼒学温度,K;z——⾼度。
在对流层中,dT/dz<0,Γ = 0.6 K · (100m)-1,即每升⾼100 m ⽓温降低0.6 ℃。
⼀定条件下出现反常现象当Γ=0 时,称为等温层;当Γ<0 时,称为逆温层。
这时⽓层稳定性强,对⼤⽓的垂直运动的发展起着阻碍作⽤。
辐射逆温产⽣特点●是地⾯因强烈辐射⽽冷却降温所形成的。
●这种逆温层多发⽣在距地⾯ 100~150 m ⾼度内。
●最有利于辐射逆温发展的条件是平静⽽晴朗的夜晚。
●有云和有风都能减弱逆温。
●风速超过 2~3 m · s-1,逆温就不易形成4.主要⾃由基及其来源HO ?和HO2 ?来源1) HO ?来源清洁⼤⽓:O3 的光解是清洁⼤⽓中HO ?的重要来源O3 + h→ O ? + O2O ? + H2O → 2HO ?污染⼤⽓,如存在HNO2,H2O2 (HNO2 的光解是⼤⽓中HO ?的重要来源)HNO2 + h→ HO ? + NOH2O2 + h→ 2HO ?2)HO2 ?来源①主要来⾃醛类的光解,尤其是甲醛的光解H2CO + h→ H ? + HCO ?H ? + O2 + M → HO2 ? + MHCO ? + O2 → HO2 ? + CO②只要有 H ?和 HCO ?存在,均可与 O2 反应⽣成 HO2 ?③亚硝酸酯和 H2O2 光解CH3ONO + hv → CH3O ? + NOCH3O ? +O2 → HO2 ? + H2COH2O2 + hv → 2HO ?HO ? + H2O2 → H2O + HO2 ?④若有CO存在,则:HO ? + CO → CO2 + H ?H ? + O2 → HO2 ?R ?,RO ?,RO2 ?来源1) R ?烷基⾃由基来源:⼤⽓中存在最多的烷基是甲基,它的主要来源是⼄醛和丙酮的光解。




环境化学习题第二章大气环境化学1. 何谓大气温度层结2. 逆温现象对大气中污染物的迁移有什么影响3. 何谓大气垂直递减率和干绝热垂直递减率如何用其判断大气稳定度4. 影响大气中污染物迁移的主要因素是什么5. 大气中有那些重要的吸光物质其吸光特征是什么6. 太阳的发射光谱和地面测得的太阳光谱有何不同为什么7. 大气中有哪些重要自由基其来源如何8. 大气中有哪些重要含氮化合物说明它们的天然和人为来源及对环境的污染。
9. 叙述大气中的NO转化为NO2的各种途径。
10. 大气中有哪些重要的碳氢化合物它们可发生哪些重要的光化学反应11. 碳氢化合物参与的光化学反应对各种自由基的形成有什么贡献12.说明光化学烟雾现象,解释污染物与产物的日变化曲线,并说明光化学烟雾产物的性质与特征。
13. 说明烃类在光化学烟雾形成过程中的重要作用。
14. 何谓有机物的反应活性如何将有机物按反应活性分类15. 简述大气中SO2氧化的几种途径。
16. 论述SO2液相氧化的重要性,并对各种催化氧化过程进行比较。
17. 说明酸雨形成的原因。
18. 确定酸雨pH界限的依据是什么19. 论述影响酸雨形成的因素。
20. 什么是大气颗粒物的三模态如何识别各种粒子模21. 说明大气颗粒物的化学组成以及污染物对大气颗粒物组成的影响。
22. 大气颗粒物中多环芳烃的种类,存在状态以及危害性如何23. 何谓温室效应和温室气体24. 说明臭氧层破坏的原因和机理。
第三章水环境化学1. 请推导出封闭和开放体系碳酸平衡中[H2CO3*]、[HCO3-]、[CO32-]的表达式,并讨论这两个体系之间的区别。
2. 请导出总酸度、CO2酸度、无机酸度、总碱度、酚酞碱度和苛性碱度的表达式作为总炭酸量和分布系数(α)的函数。
3. 向某一含有碳酸的水体加入重碳酸盐,问:①总酸度、②总碱度、③无机酸度、④酚酞碱度、⑤CO2酸度,是增加还、减少还是不变。
4. 在一个pH为,碱度为mmol/L的水体重,若加入碳酸钠是其碱化,问需要加多少mmol/L 的碳酸钠才能使水体pH值上升至。

习题第一章绪论2、根据环境化学的任务、内容和特点以及发展动向,你认为怎样才能学好环境化学这门课?环境化学是一门研究有害化学物质在环境介质中的存在、化学特征、行为和效应及其控制的化学原理和方法的科学。
环境化学以化学物质在环境中出现而引起环境问题为研究对象,以解决环境问题为目标的一门新型科学。
其内容主要涉及:有害物质在环境介质中存在的浓度水平和形态,潜在有害物质的来源,他们在个别环境介质中和不同介质间的环境化学行为;有害物质对环境和生态系统以及人体健康产生效用的机制和风险性;有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
环境化学的特点是要从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。
目前,国界上较为重视元素(尤其是碳、氮、硫和磷)的生物地球化学循环及其相互偶合的研究;重视化学品安全评价、臭氧层破坏、气候变暖等全球变化问题。
当前我国优先考虑的环境问题中与环境化学密切相关的是:以有机物污染为主的水质污染、以大气颗粒物和二氧化硫为主的城市空气污染;工业有毒有害废物和城市垃圾对水题和土壤的污染。
3、环境污染物有哪些类别?主要的化学污染物有哪些?按环境要素可分为:大气污染物、水体污染物和工业污染物。
按污染物的形态可分为:气态污染物、液态污染物和固体污染物;按污染物的性质可分为:化学污染物、物理污染物和生物污染物。
主要化学污染物有:1.元素:如铅、镉、准金属等。
2.无机物:氧化物、一氧化碳、卤化氢、卤素化合物等3•有机化合物及烃类:烷烃、不饱和脂肪烃、芳香烃、等;4. 金属有机和准金属有机化合物:如,四乙基铅、二苯基铬、二甲基胂酸等;5. 含氧有机化合物:如环氧乙烷、醚、醛、有机酸、酐、酚等;6. 含氮有机化合物:胺、睛、硝基苯、三硝基甲苯、亚硝胺等;7. 有机卤化物:四氯化碳、多氯联苯、氯代二噁瑛;8. 有机硫化物:硫醇、二甲砜、硫酸二甲酯等;9. 有机磷化合物:磷酸酯化合物、有机磷农药、有机磷军用毒气等。