第四节氨 硝酸 硫酸
- 格式:doc
- 大小:275.00 KB
- 文档页数:11

第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
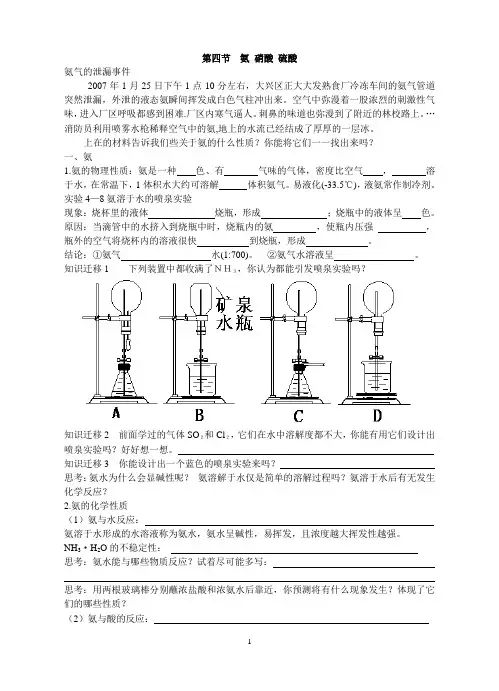
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。









第四章第四节氨硝酸硫酸一、氨1、氮的固定:概念:的方法叫氮的固定。
2、氛的物理性质:色气味气体,密度空气,溶于水,常温下,1体积水大约可溶解体积氨气。
氨的水溶液叫做。
氨液化(液态的氨称为)液化时热。
3、氛的化学性质(1)与水反应:氨溶于水后大部分与水反应,化学方程式为:氛水不稳定性:O 氨水有性,故氨气可以使酚猷溶液变色或使湿润的红色石蕊试纸变色。
(可用于氨气的检验。
)(2)与酸反应生成铉盐,请完成下列方程式:NH3+1IC1=(课本P98 “图4-28〃操作可用于氛气的检验)NH3+H2S0J=(可用于吸收氨气)NH3+C02÷H20=(生成破铉)(3)NH3的还原性。
NFh中N是一3价,处于最低价态,具有还原性,可被氧化剂(如0/氧化,写出氨被。
2氧化的化学方程式:C4、铉盐的性质:(1)农业上常见的化肥,如、、等都是铉盐。
铉盐都溶于水。
(2)铉盐的不稳定性:铉盐受热易分解例如:NH出CO : , 4 _________________________________________________________NHiC 1 些二_______________________________________(3)铉盐与碱的反应:铉盐与碱的反应放出氨气NH. lN03+Na0H= _________________________________(NH., ) 2S0, i + NaoH二____________________二、氨的实验室制法1、__________________________________________ 反应原理2、装置:〃+”加热装置;发生装置与制相似。
3、收集法;收集的试管口塞上棉团,作用是4、干燥:O不可以用、做干燥剂。
5、检验:(1)用湿润的试纸放在试管口可以看到试纸变;(2) ____________________________________________________6、尾气吸收:导管口放一团用一或浸湿的棉花球),棉花作用:温馨提示:在实验室有时也用①加热浓氨水的方法得到氨气:②把浓氨水滴入固体氢氧化钠中制得氨气:7、实验室能不能用加热氯化铉反应制备氨气?为什么?(3) NHU的检验:如何证明某物质中含有NH「(铉盐)?%1.浓硫酸(一)物理性质:色状液体,挥发,密度比水O(二)浓硫酸的特性1.脱水性:用玻璃棒蘸取浓硫酸滴到滤纸上,现象,体现浓硫酸的性。
第四章非金属及其化合物第四节氨硝酸硫酸第一课时教学目标:1.探究氨和铵盐的性质、用途;2.学会氨的实验室制法。
教学重点:氨和铵盐的化学性质教学难点:实验室制氨的化学反应原理教学仪器:烧杯、烧瓶、铁架台、滴管、导管、玻璃棒、试管、酒精灯、酚酞试液、棉花、试管夹、NH3、HCl、NH4Cl、Ca(OH)2教学过程:[新闻导课]杭州市一制冷车间发生液氨泄漏: 2004年4月20日上午10时,杭州市一制冷车间发生氨气泄漏事件,整个厂区是白茫茫的一片,方圆数百米,空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难。
厂区内寒气逼人。
市消防中心接到报案后立即制定方案,出动上百名消防队员,十余量消防车…。
简要介绍合成氨发展史[问题]1、为什么在液氨泄漏时工厂里会寒气逼人?2、如何吸收弥漫在空气中的大量氨气?3、被围困在污染区的群众怎样做才能保证不吸入氨气?[板书] 一、氨1、NH3的物理性质:[展示]一瓶氨气:无色,有刺激性气味,密度<空气,易液化,可作致冷剂。
[实验4-8] 成功关键:烧瓶干燥、密封。
现象:形成红色喷泉。
结论:氨极易溶于水,水溶液显碱性。
[ 讲解]:1体积的水约溶解700体积的氨气,氨的水溶液叫做氨水。
[板书] 在通常状况下,氨是无色气体,有刺激性气味,比空气轻。
氨易液化,极易溶于水。
[过渡]氨的水溶液是碱性的,但其中的水是中性的,氨分子也没有氢氧根离子。
氨水为什么会显碱性呢?[板书]2、氨的化学性质:(1)NH3与水的反应:[分析] NH3+H2O NH3·H2O NH4++OH-NH3+H2O NH4++OH-其中一水合氨很不稳定,受热会分解。
NH3·H2O NH3↑+H2O[板书] NH3+H2O NH3·H2O NH4++OH-[思考]:分析NH3溶于水存在的过程,讨论氨水中的成分:分子、离子。
[板书](2)NH3与酸的反应:[ 演示实验]氨与氯化氢反应[观察]现象:大量白烟生成。
[思考]:生产Cl2的化工厂常用浓氨水来检查生产设备和管道是否漏气,如有白烟生成,则说明已发生漏气,这是为什么?[板书]化学方程式: NH3+HCl=NH4ClNH3也可与其它酸反应,例:NH3+HNO3=NH4NO3、 2NH3+H2SO4=(NH4)2SO4 [讲解] NH3在一定条件下可于O2、NO、NO2等发生氧化还原反应。
[板书](3)NH3与O2的反应: 4NH3+5O2 4NO+6H2O[演示实验]实验室制取氨气:[板书]3、NH3的实验室制法:[讲解]原理:在实验室里常用铵盐和碱加热的方法来制取NH3。
仪器:固+固加热(同制氧气);收集:排空气法。
[板书]2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 仪器:固+固加热(同制氧气);收集:排空气法。
[提问]:1 能否用浓硫酸干燥NH3?2 能否使用NH4HCO3、NH4NO3?为什么?3 使用碱石灰代替消石灰有什么优点?[过渡]氨与酸反应形成氨盐,我们下面分析铵盐的性质[板书]4、铵盐[讲述]铵盐是铵根离子(NH4+)和酸根离子组成的化合物。
铵盐都是晶体,能溶于水。
[板书]主要化学性质:(1)铵盐受热易分解:[实验]加热NH4Cl观察现象,是否升华?[板书]化学方程式: NH4Cl NH3↑+HCl↑、 NH3+HCl= NH4ClNH4HCO3 NH3↑+H2O+CO2 ↑[讲解]铵盐能与碱反应放出氨气,例:(NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2O[板书](2)铵盐与碱的反应:(NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2O [强调]这个性质是一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
[注意事项]:实验条件:浓溶液或固体,加热。
较稀溶液中铵根离子的检验方法:先浓缩,后检验。
[板书]5.NH3的用途:[讲述]可用于氮肥工业及其他化工产业上(如:制纯碱),制冷剂。
[思考交流]自然界中氮的循环:[讨论]:向饱和的NaCl溶液中通入足量的NH3后,再通入足量的CO2,发现有NaHCO3晶体析出,为什么?[小结]:总结本节课的内容。
[作业]附板书计划:一、氨1、氨的物理性质:在通常状况下,氨是无色气体,有刺激性气味,比空气轻。
氨易液化,极易溶于水。
2、氨的化学性质:(1)NH3与水的反应: NH3+H2O NH3·H2O NH4++OH-(2)NH3与酸的反应:NH3+HCl=NH4Cl NH3+HNO3=NH4NO3、2NH3+H2SO4=(NH4)2SO4(3)NH3与O2的反应: 4NH3+5O2 4NO+6H2O(工业上制硝酸)3、NH3的实验室制法:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 仪器:固+固加热(同制氧气);收集:排空气法。
4、氨盐(1)铵盐受热易分解:NH4Cl NH3↑+HCl↑、 NH3+HCl= NH4ClNH4HCO3 NH3↑+H2O+CO2 ↑(2)铵盐与碱的反应:(NH4)2SO4+2NaOH Na2SO4+2NH3↑+2H2O5、氨的用途第二课时教学目标:1.巩固稀硫酸的性质;探究浓硫酸的特性及强氧化性;2.培养学生的实验观察、分析思维能力。
3.对学生进行“现象与本质”“量变与质变”等辩证唯物主义观点的教育4.通过实验研究,激发学生的学习兴趣,培养学生严谨求实、勇于创新的科学品质教学重点、难点:浓硫酸的强氧化性。
教学方法:启发式。
教学辅助手段:投影。
教学过程[新闻导课]今年1月29日、2月23日,清华大学机电系四年级学生刘海洋先后两次用火碱、浓硫酸将北京动物园的五只熊烧伤,其中一头黑熊双目失明。
这一故意残害动物的事件经媒体披露后,引起了公众的强烈愤慨!同时,“高材生为何会犯如此低级错误?一个‘好学生’为什么没有必然成为一名好公民”的疑问也引发了社会各界广泛的讨论与深入的思考。
[沉思]刘海洋为何用浓硫酸残害黑熊?浓硫酸又具有哪些重要性质?[复习投影] 描述下列的实验(见附图)现象,并说明稀H2SO4的性质。
[练习]有关反应的离子方程式:Zn+H2SO4--- Zn+2H+ = Zn2++H2↑NaOH+H2SO4----- OH-+H+ = H2OFe2O3+H2SO4---- Fe2O3+6H+ = 2Fe3++3H2OBaCl2+H2SO4--- Ba2++ SO42— = BaSO4↓[设问]实验室制氢气时选用稀硫酸或盐酸,而不用浓硫酸和硝酸,为什么?[板书] 第四节硫酸、硝酸和氨二、硫酸和硝酸的氧化性[引言] 浓硫酸和稀硫酸在性质上有什么区别呢?[提问]实验室制取氯化氢,为什么用浓硫酸与固体食盐共热?利用浓硫酸什么性质?[学生回答]难挥发性。
[板书](一)硫酸的氧化性1.浓硫酸的特性(1)难挥发性—制挥发性酸[提问]在实验室里常用浓硫酸干燥气体,利用浓硫酸的什么性质?[板书] (2)吸水性[思考] 因为浓硫酸难挥发,所以将一瓶浓硫酸敞口放置在空气中,其浓度、质量都不发生变化,这样说对吗?[演示实验] 蔗糖炭化:将一定量的蔗糖放入小烧杯中,加入浓硫酸。
[学生观察] 现象:①蔗糖由白→黑;②生成的黑色物质呈面包状;③闻一闻有刺激性气味。
[教师启发]解释现象:①浓H2SO4与蔗糖(C12H22O11)作用,按水分子的组成脱去蔗糖分子中的H、O,生成C和H2O。
[板书] (3)脱水性现象本质:[分析] 蔗糖炭化现象:②③黑色物质疏松多孔(学生答有气体),气体是怎么形成的,生成的是什么气体?[讲解] 浓硫酸使蔗糖脱水炭化后,又吸水放热,使其继续被浓H2SO4氧化。
[板书] 2、强氧化性[实验4-9] 铜与浓硫酸反应,并检验生成的气体?[观察现象] ①固:红→黑②液:无→棕黑→蓝色③气:无色有刺激性气味,使酸性KMnO4溶液退色;使品红溶液退色。
△[板书](1)Cu+2H26+S O4(浓)====Cu(SO4)2+4+S O2↑+2H2O[引导分析] (1)铜片变黑,黑色物质是什么?怎么生成的?(2)怎样鉴别生成的气体?教师要启发不能用澄清石灰水鉴别。
[思考] 回答在上述反应中:(1)氧化剂、还原剂、氧化产物、还原产物各是什么物质?(2)反应物的物质的量之比?还原剂与氧化剂物质的量之比?(3)浓硫酸在反应中的作用?[讲解] 在金属活动顺序表中,Cu是H之后较不活泼的金属元素,稀硫酸不能与Cu反应。
实验证明,浓硫酸能把金属活动顺序表中H之后的金属(除Pt,Au)氧化成金属硫酸盐,浓硫酸本身被还原生成SO2。
[练习] 写出浓硫酸与汞反应、与银反应的化学方程式。
[教师启发] Cu,Hg,Ag是H之后的较不活泼的金属,那么H之前的金属是否就更容易被浓H2SO4氧化呢?[板书]氧化大多数金属:生成物中金属显高价,同时生成二氧化硫。
[讲述] 常温Al,Fe钝化。
学生阅读课文有关内容。
教师启发钝化在实际中的应用:铝铁容器盛装浓硫酸。
[分析]蔗糖炭化中的刺激性气味?[板书](2)氧化某些非金属如C,S,P等(浓硫酸的还原产物一般为二氧化硫)。
C+2H2SO4(浓)CO2↑+2SO2↑+2H2O2H2SO4(浓)+S====3SO2↑+2H2O[教师] 浓硫酸具有强氧化性,能氧化某些非金属,又能氧化大多数金属,那么能否氧化具有还原性的化合物呢?如实验室为什么不用浓H2SO4制取及干燥H2S?[板书] (3)氧化某些还原性化合物2NaI+H2SO4(浓)===Na2SO4+I2+SO2↑+2H2OH2S+H2SO4(浓)==S↓+SO2+2H2O[问题] 实验证明:浓H2SO4的特性,稀硫酸都没有;稀H2SO4的性质,浓H2SO4不完全具有。
为什么浓、稀H2SO4性质有这么大差别呢?让我们一起分析。
[师生共同分析]上述反应中浓H2SO4的氧化性由其分子中什么原子引起?稀+6H2SO4 也具有氧化性,两者相比有何差别?可举例说明。
浓H2SO4的氧化性由其分子中S(最高价)引起。
稀硫酸也有氧化性,如Zn+2H+====Zn2++H2↑,由H+表现,而Cu+H2SO4(稀)不反应。
可见,H+的氧化性比S 的氧化性弱且还原产物不同。
[小结]略[作业]第三课时教学目标:1、探究硝酸的物理性质和化学性质(酸性、强氧化性、不稳定性)。
2、通过学生实验手段,培养学生的实验能力、观察能力、分析能力。
3、在浓硝酸和稀硝酸的对比学习中,渗透“量变和质变”的辨证规律。
4、通过介绍化学家的故事,使学生树立热爱科学,尊重科学的品质,激发学生学习的兴趣。
教学重点:硝酸的不稳定性和强氧化性教学难点:硝酸的强氧化性教学过程:[故事导入] 玻尔巧藏诺贝尔金奖章丹麦有位叫玻尔的科学家,37岁时他获得了1922年的诺贝尔奖。