第二章第三节第3课时 氧化剂和还原剂
- 格式:ppt
- 大小:1.29 MB
- 文档页数:22







化学鲁科版1第2章第3节氧化剂和还原剂第3课时教案教学目标1.课标要求(1)把握铁及其化合物的氧化性或还原性。
(2)通过实验探究,使学生学会用“用已知物质的性质验证未知物性质”的科学方法。
(3)通过性质实验探究,进一步巩固氧化还原反应的知识。
2.三维目标(1)知识与技能①把握铁及其化合物的氧化性或还原性。
②通过探究实验进一步深化明白得氧化还原反应的相关知识。
(2)过程与方法通过“铁及其化合物的氧化性和还原性”实验探究活动,使学生学会用氧化还原反应原理推测和验证未知物性质的科学方法。
(3)情感态度与价值观①体会氧化还原反应的普遍存在,并能举例说明生活、生产中常见的氧化还原反应。
②通过了解铁与人体健康的内容,应用化学知识使生活更健康。
③通过“铁及其化合物的氧化性和还原性”实验探究活动,培养学生严谨认确实科学态度和精神。
教学分析1.教材分析探究铁及其化合物的氧化性和还原性这一主题设置在氧化还原反应知识之后,是氧化还原反应知识的延伸和应用。
而铁及其化合物的相关性质是高中时期比较重要的元素知识,该主题的进行使学生在分析铁及其化合物的氧化性和还原性、把握铁及其化合物的相互转化关系的同时,能够进一步巩固氧化还原反应的知识。
2.学情分析金属铁及其化合物是学生专门熟悉的物质,他们在日常生活中、在往常的实验课程中常常接触到含铁元素的物质。
通过对前面氧化还原反应知识的学习,学生差不多明白了铁具有还原性,而且能够依照化合物所含元素价态的高低简单判定该化合物的氧化还原性质。
如此,教师比较容易找到适当的教学切入口,同时关于铁及其化合物的氧化还原性质的探究,学生们也差不多具有了一定的理论基础。
教学重点、难点1.重点①把握铁及其化合物的相互转化关系,进一步巩固氧化还原反应的知识。
②实验探究方案的设计。
③用氧化还原反应原理推测和验证物质性质的科学方法。
2.难点①铁及其化合物的相互转化关系。
②用氧化还原反应原理推测和验证物质性质的科学方法。
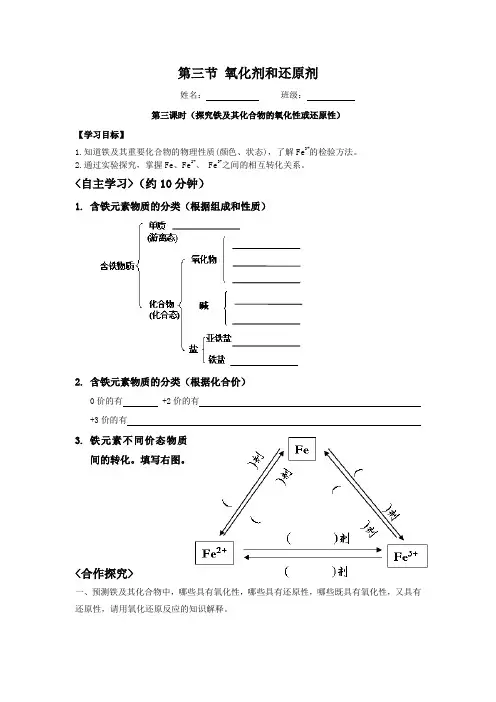
第三节氧化剂和还原剂姓名:班级:第三课时(探究铁及其化合物的氧化性或还原性)【学习目标】1.知道铁及其重要化合物的物理性质(颜色、状态),了解Fe3+的检验方法。
2.通过实验探究,掌握Fe、Fe2+、 Fe3+之间的相互转化关系。
<自主学习>(约10分钟)1.含铁元素物质的分类(根据组成和性质)2.含铁元素物质的分类(根据化合价)0价的有 +2价的有+3价的有3.铁元素不同价态物质间的转化。
填写右图。
<合作探究>一、预测铁及其化合物中,哪些具有氧化性,哪些具有还原性,哪些既具有氧化性,又具有还原性,请用氧化还原反应的知识解释。
二、以金属铁、氯化亚铁、氯化铁为例进行探究。
【实验前准备】1、金属铁、氯化亚铁、氯化铁三种样品的颜色特征是什么?2、FeCl3如何检验?FeCl2能否与KSCN溶液反应,有何现象?3、如何证明物质具有氧化性或还原性?【活动•探究】1. 提出预测与假设(金属铁、氯化亚铁、氯化铁的氧化性与还原性金属铁—性、氯化亚铁—、氯化铁—性。
2. 设计实验方案实验试剂:铁粉、稀硫酸、FeCl3溶液、FeCl2溶液、氯水、稀硝酸、KSCN溶液、锌片、铜片。
请用上述试剂,设计实验方案:探究Fe、FeCl2、FeCl3的氧化性或还原性。
写出相应离子反应方程式:【迁移应用】① 人们利用FeCl 3溶液腐蚀铜箔制造印刷线路板。
请说出其中的道理,分析所发生的化学反应。
② 在FeSO 4溶液里加铁钉或铁粉来防止溶液里的Fe 2+被氧化。
请说出其中的道理,分析所发生的化学反应。
③ 除杂:(1)FeCl 3(FeCl 2)(2)FeCl 2(FeCl 3) 【小结】强氧化剂:;弱氧化剂:;强还原剂:;弱还原剂:;<达标测评>1. 下列物质与铁反应后的生成物,能与KSCN 溶液作用生成红色溶液的是( ) A. 盐酸 B. 氯气 C. CuSO 4溶液 D. 稀硫酸2. 所含铁元素既有氧化性又有还原性的物质是( )强强A. FeB. FeCl2C. FeCl3D. Fe2O33. 要除去FeCl2溶液中少量的氯化铁,可行的办法是( )A. 滴入KSCN溶液B. 通入氯气C. 加入铜粉D. 加入铁粉4. 下列关于铁的叙述正确的是()A. 铁能被磁铁吸引,但纯铁易锈蚀B. 在人体的血红蛋白中含有铁元素C. 铁能在空气中剧烈燃烧D. 不能通过化合反应制得FeCl2和Fe(OH)3。



《氧化还原反应与氧化剂、还原剂》说课稿各位评委老师大家好,今天我说课的内容是鲁科版必修1第二章第三节《氧化剂和还原剂》中的氧化还原反应与氧化剂、还原剂部分,该说课包括五个方面:一、教材分析1、为什么教?——氧化还原反应在教材中的地位和作用氧化还原反应贯穿于中学化学教材的始终,是中学化学教学的重点和难点之一。
本节教材安排在这里是承前启后,合乎情理,符合学生情况,符合由表及里的学习规律。
复习了初中的基本反应类型以及氧化反应还原反应并以此为铺垫展开对氧化还原反应的较深层次的学习,是今后联系元素化合物知识、原电池、电解池、电极反应式知识的重要纽带,通过本节课学习还可以帮助学生更好的树立“透过现象看本质”和“对立统一”的辨证唯物主义观点,对学生形成科学的世界观有着举足轻重的作用和意义。
2、教什么?——教学目标根据《考试大纲》、《课程标准》及学生实际情况,我制定了以下教学目标:知识目标:1、使学生了解化学反应有多种分类方法,各方法划分依据不同使用范围不同.2、使学生学会用化合价升降的观点及电子转移的观点来理解氧化还原反应.3、帮助学生了解氧化剂、还原剂,氧化产物与还原产物,理清5对概念的关系(氧化剂和和还原剂、氧化产物和还原产物、氧化反应和还原反应、被氧化和被还原、氧化性和还原性)及它们与化合价、电子得失的对应关系。
能力目标: 1、思维能力培养:由表及里培养思维的深刻性;由此及彼培养思维的逻辑性。
2、表达能力培养:通过小组讨论、代表汇报的形式锻炼学生的表达能力。
情感目标:通过氧化还原反应概念的演变,培养学生用发展的眼光、科学的态度、勇于探索的品质学习化学;通过创设问题情景,激发学生的学习兴趣和求知欲望。
3、重点、难点重点:用化合价升降和电子转移的观点理解氧化还原反应;难点:用化合价升降和电子转移的观点分析氧化还原反应;学生掌握氧化还原反应相关的概念及其中的对立统一的关系。
二、怎么教?——教法分析古希腊生物家普罗塔弋说过这样一句话:“头脑不是一个要被填满的容器,而是一把需被点燃的火把。
第二章第三节氧化剂和还原剂公开课教案
一、教学思路
本课时通过分析许多化学反应中元素化合价的变化,引导学生发现化学反应的又一种新的分类角度,从化合价的角度把化学反应分为氧化还原反应和非氧化还原反应。
接着,从宏观的角度,从实验中分析锌与硫酸在闭合回路中形成电流,再从微观的角度,从理论上分析氯化钠和氯化氢的形成,通过这两个探究活动,发现氧化还原反应的实质是电子的转移,通过动画帮助学生更形象的理解氧化还原反应的本质。
再通过数学的统计观点分析氧化还原反应与四大基本反应类型的关系。