不可逆过程和环境的熵变计算举例
- 格式:doc
- 大小:175.00 KB
- 文档页数:9





不可逆过程和环境的熵变计算举例以下是两个不可逆过程和环境的熵变计算的例子:1.一个热源和一个工作物体之间的热交换考虑一个热源和一个工作物体之间的热交换过程。
这里,热源的温度高于工作物体的温度,导致热量从热源流向了工作物体。
这个过程是不可逆的,因为温度差引起了热量的不可逆流动。
假设热源的温度为T1,工作物体的温度为T2,并且假设热交换过程中没有其他形式的能量转换。
根据热力学第二定律,系统与环境的熵变可以表示为:ΔS_system = -Q/T2ΔS_environment = Q/T1其中,ΔS_system表示系统的熵变,ΔS_environment表示环境的熵变,Q表示热量的传递。
由于热量的传递是从热源向工作物体的,所以Q为负值。
假设热源传递了Q单位的热量给工作物体,那么可以写出:ΔS_system = -(-Q)/T2 = Q/T2ΔS_environment = -Q/T1这两个表达式显示了系统和环境的熵在过程中是增加的。
由于系统和环境一起构成了一个孤立系统,总的熵变必须是正的。
2.气体在可膨胀容器中的膨胀考虑一个可膨胀容器中的气体膨胀过程。
在此过程中,气体从一个高压区域扩展到一个低压区域,使气体做功。
这个过程是不可逆的,因为气体在膨胀过程中无法完全进行无损失的功。
假设气体的初态和末态分别为状态1和状态2,初态的压力为P1,体积为V1,末态的压力为P2,体积为V2、再假设在膨胀过程中没有其他形式的能量转换。
根据热力学第二定律,系统与环境的熵变可以表示为:ΔS_system = nR * ln(V2/V1)ΔS_environment = -nR * ln(V2/V1)其中,n为气体的物质的量,R为气体常数。
这两个表达式分别表示了系统和环境的熵增加量。
由于这是一个膨胀过程,气体的体积增加,所以V2/V1大于1,从而使得ln(V2/V1)为正数。
由此可见,系统和环境的熵都增加了。
实际上,这个过程是不可逆的,但是熵的分布合适地遵循熵增加的原则。
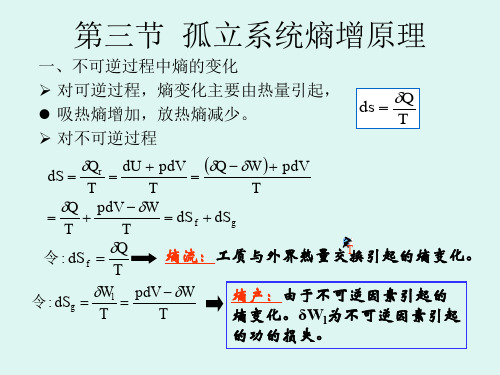
对于不行逆过程熵变的计算规律的商讨在多年的热力学统计物理的教课中,发现相关不行逆过程的熵变的计算一直是学生感觉比较难以接受的知识点,自己经过学习发现不行逆过程熵变的计算有必定的规律性,就把其进行了概括,希望能被初学者借鉴。
对于孤立系统熵变的一般计算方法:按定义,只有沿着可逆过程的热温熵总和才等于系统的熵变。
当过程为不行逆时,则依据熵为一状态函数,系统熵变只取决于始态与终态而与过程所取门路没关;可想法绕道,找出一条或一组一直态与之相同的可逆过程,由它们的熵变间接地计算出来。
孤立系统的选择方法,假如非关闭系统,能够将环境和物体共同当作关闭系统。
不一样的详细过程有不一样的规律,大概分为:
1、绝热孤立系统内物体间的热传达过程的熵变⑴温度为0o C的1kg水与温度为100o C 的恒温热源接触后,水温达到100o C。
试分别求水和热源的熵变以及整个系统的总熵变。
欲使整个系统的熵保持不变,应怎样使水温从0o C升至100o C已
知水的比热容为
4.18J g1K1.
【答:S
水
=K1,S
热源
=JK1,S
总
=184J K1.】
解:题中的热传导过程是不行逆过程,要计算水和热源的熵变,则必须假想一个初态和终态分别与题中所设过程相同的可逆过程来
进行计算。
要计算水从0o C 吸热升温至100o
C 时的熵变,我们假想一个可逆 的等压过程:
373
mC 水dT
mC 水ln
373 1
S 水=
273
T
273
对于热源的放热过程,能够假想一个可逆的等温过程:
Q 放
(373273) 1
S 热源 T 373
S 总=S 水
S 热源=184J
K 1
在0o
C 和100o
C 之间取相互温度差为无量小的无穷多个热源,令水挨次与这些温度递加的无穷多个热源接触,由0o
C 吸热升温至100o
C ,这是一个可逆过程,能够证明
S 热源=S 水,故 S 总= S 水S 热源=0
2〕试计算热量Q 自一高温热源T 2直接传达至另一低温热源T1所惹起的熵变。
〔解〕从题意能够看出这是一不行逆热传达过程,应假想另一组一直态相同的可逆过程代替它,才能由它们的热温商计算系统的熵变。
为此,能够假想另一变温过程由无数元过程所构成,在每一元过程中系统分别与一温度相差极微的热源接触,热量是经由这一系列温度间隔极微的热源〔(T 2-dT),(T 2-2dT),(T 2
-
3dT),,(T1+2dT),(T1+dT),〕传达到环境去。
这样的热传达过程
当dT 愈小时,则愈靠近于可逆,则
可见若二热源直接接触并于外界隔绝(绝热),则在此二热源间的热
传导过程为一自觉过程。
2、孤立的绝热物体自己的热传达过程的熵变均匀杆的温度一端为T1,另一端为T2.试计算达到均匀温度
1
2(T1T2)
后的熵增。
解:当热力学系统从一均衡态经历了一个不行逆过程抵达另一均衡态
时,其熵的改变可引入一个适合的可逆过程而进行计算,这是由于熵是态函数。
而本问题中,杆是从一非均衡态经历了热传导的不行逆过程,而抵达一个均衡态。
所以,假想下述可逆过程:把杆看作是无数无穷薄的小段构成,每一个小段的初温各不相同,但都将拥有相同的终温。
我们再假想全部的小段相互绝热,并保持相同的压力,而后使每小段连续地跟一系列热源接触,这些热源地温度由各段的初温度至共同的终温度。
这样就定出无数个可逆的等压过程,用来使该杆由初始的非均衡态变化到均衡态的终态。
我们考虑长为L的均匀杆,位于x处的体积元的质量为
dmAdx
此中ρ及A分别为杆的密度及截面积,该段的热容量为
C p dmC
p
Adx
最先的温度散布是线性散布的,而使x处的初温为
T(x)T T1T2
x
i1
L
若无热量损失,而且为了方便起见,假定各小段的热传导率、密度和热容量都保持不变,则终温
T 1
T
2
T
f
该体积元的熵增为2
C
p
T fdT
C
p
Adxln
T
f
C
p
Adxln
T
f
V
p
Adxln(
T
1T1T2x
) Adx
T
i T1T2T f LT f
T i
T
T
1x
L沿整个杆积分,得熵的总变化等于
L
T
1T1T L
x)dx
S C
p Aln(
T
f LT f
利用积分公式1
ln(a bx)dx(a bx)ln(a bx)1 b经积分并化简后,获得
SmC(1lnT
T
2lnT
T
1lnT)mC(ln T1T211T2lnT21). TT TT
TlnT
p f21P2TT
121212
3、绝热系统内功热转变过程的熵变10A的电流经过一个25Ω的电阻器,历时1s.(i)若电阻器保持为
室温27o C,试求电阻器的熵增。
(ii)若电阻器被一绝热壳包
装起来,其初温为27o C ,电阻器的质量为10g ,比热容c p 为1,
问电阻器的熵增为什么 解:(1)若电阻器保持必定温度,则它的状态不变,而熵是状态的函
数,故知电阻器熵增为零,即S0
.我们也能够这样考虑,电功转变为热,传人电阻器,同时此热量又由电阻器流入恒温器(比方是实验
室)。
所以,传入电阻器的净热量为零,故有S0
.在这过程中,有电功转变成热,是不行逆过程。
由于熵是态函数,我们假想一个是电阻器等压加热的过程来计算熵增。
电阻器终态的温度为Tf ,有Q=mCp(Tf-Ti),及
Q 22
251600(cal)
T f
600
10
300600(K)
得
TfmC p dT
T f
600
1.386(cal/K)
S
mC p ln
T i
T
T i
300
4、不行逆过程和环境的熵变计算
如计算隔绝系统的熵变,则需波及环境,按原则,环境亦一定在
可逆条件下吸热或放热,常假想环境由一系列温度不一样的热源构成, 或称理想化环境,当系统放热时,则环境吸热;而系统吸热时则环境 放热,故有以下关系:
〔例1〕试计算以下状况
下,、2
摩尔理想气
体由
2X压力降低至
压力时的(a)系统熵
变;(b)环境熵
变;
(c)隔绝系统
熵变
--(1)可逆等
温膨胀;(2)恒温恒外压膨
胀,
p
e=
;(3)自由膨胀。
〔解〕:(1)
(2)
(3)三例比较,系统一直态相同,ΔS系统为一恒值·K-1)。
在可逆状况下,系统将热转变成功的效率达到最大;而当不行逆程度(不
均衡状况)愈大时,热量的利用率愈低,转变成做功的能量愈
少(也称有效能)。
能量持续以热的形式留于隔绝系统中的愈
多,相应地隔绝系统的熵值增添得愈多。
(应当注意:本例属等温过程,在变温过程中熵值的变化应依据决定!)
〔例2〕试计算在
压力下,2
摩尔液态
氨由
转
变成
的氨
气时系统的熵变。
氨的正常沸点压力下的沸点)为,在正常沸点下的摩尔汽化热VapHm=·mol1;液态随和态氨的摩尔均匀热容分别为
Cp,m(NH3,l)=mol·-1·K-1和Cp,m(NH3,g)=+。
〔解〕此过程为不行逆,计算系统熵变时一定由一组一直态相同的可逆过程代替之:而系统熵变:。