不可逆过程和环境的熵变计算举例
- 格式:docx
- 大小:36.98 KB
- 文档页数:2



熵产生原理与不可逆过程热力学简介一、熵产生原理(Principle of Entropy-Production )熵增加原理是热力学第二定律的熵表述。
而这个原理用于判断任一给定过程能否发生,仅限于此过程发生在孤立体系内。
而对于给定的封闭体系中,要判断任一给定的过程是否能够发生,除了要计算出体系内部的熵变,同时还要求出环境的熵变,然后求总体的熵变。
这个过程就相当于把环境当成一个巨大的热源,然后与封闭体系结合在一起当成孤立体系研究。
但是一般来说,绝对的孤立体系是不可能实现的。
就以地球而言,任何时刻,宇宙射线或高能粒子不断地射到地球上。
另外,敞开体系也不能忽视,就以生物体为例,需要不停地与环境进行物质交换,这样才能保证它们的生存。
1945年比利时人I. Prigogine 将热力学第二定律中的熵增加原理进行了推广,使之能够应用于任何体系(封闭的、敞开的和孤立的)。
任何一个热力学体系在平衡态时,描述系统混乱度的状态函数S 有唯一确定值,而这个状态函数可以写成两部分的和,分别称为外熵变和内熵变。
外熵变是由体系与环境通过界面进行热交换和物质交换时进入或流出体系的熵流所引起的。
熵流(entropy flux )的概念把熵当作一种流体,就像是历史上曾经把热当作流体一样。
内熵变则是由于体系内部发生的不可逆过程(例如,热传导、扩散、化学反应等)所引起的熵产生(entropy-production )。
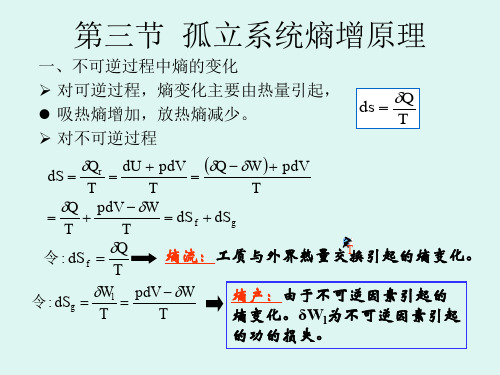
由上述的概念,可以得到在任意体系中发生的一个微小过程,有:S d S d dS i e sys +==S d T Qi +δ (1-1),式中S d e 代表外熵变,S d i 代表内熵变。
这样子就将熵增加原理推广到了熵产生原理。
而判断体系中反应的进行,与熵增加原理一致,即0≥S d i (> 不可逆过程;= 可逆过程) (1-2)而文字的表述就是:“体系的熵产生永不为负值,在可逆过程中为0,在不可逆过程中大于0”。


关于不可逆过程爛变的计算规律的探讨在多年的热力学统计物理的教学中,发现有关不可逆过程的嫡变的计算始终是学生感觉比较难以接受的知识点,本人通过学习发现不可逆过程爛变的计算有一定的规律性,就把其进行了归纳,希望能被初学者借鉴。
对于孤立系统爛变的一般计算方法:按定义,只有沿着可逆过程的热温嫡总和才等于体系的嫡变。
当过程为不可逆时,则根据嫡为一状态函数,体系爛变只取决于始态与终态而与过程所取途径无关;可设法绕道,找出一条或一组始终态与之相同的可逆过程,由它们的嫡变间接地推算出来。
孤立系统的选择方法,如果非封闭系统,可以将环境和物体共同看成封闭系统。
不同的具体过程有不同的规律,大致分为:1、绝热孤立系统物体间的热传递过程的爛变(1)温度为o°c的lkg水与温度为100°C的恒温热源接触后,水温达到100°C。
试分别求水和热源的爛变以及整个系统的总嫡变。
欲使整个系统的嫡保持不变,应如何使水温从0°C升至100°C?己知水的比热容为4.18八gfi.【答:AS水= 1304.6八K",丛热源=—1120.6八肝,AS总= 1847 • K".】解:题中的热传导过程是不可逆过程,要计算水和热源的嫡变,则必须设想一个初态和终态分别与题中所设过程相同的可逆过程来进行计算。
要计算水从0°c 吸热升温至100°C 时的爛变,我们设想一个可逆的等压过程:r3i3mC^dT 373 . AS 水=f —-— = /HC l(,ln —= l000 x 4.18 x 0.312 = 1304 6J • K~[ 爪 J273 T 小 273 对于热源的放热过程,可以设想一个可逆的等温过程:丛总“水+ AS 热源=184八K"在0°C 和100°C 之间取彼此温度差为无穷小的无限多个热源,令 水依次与这些温度递增的无限多个热源接触,由o°c 吸热升温至 100°C,这是一个可逆过程,可以证明△S 热源=- AS 水,故”总=AS 水+ A5热源=0(2)试计算热量Q 自一高温热源T 2直接传递至另一低温热源T 、所引起的嫡变。
不可逆过程和环境的熵变计算举例
以下是两个不可逆过程和环境的熵变计算的例子:
1.一个热源和一个工作物体之间的热交换
考虑一个热源和一个工作物体之间的热交换过程。
这里,热源的温度高于工作物体的温度,导致热量从热源流向了工作物体。
这个过程是不可逆的,因为温度差引起了热量的不可逆流动。
假设热源的温度为T1,工作物体的温度为T2,并且假设热交换过程中没有其他形式的能量转换。
根据热力学第二定律,系统与环境的熵变可以表示为:
ΔS_system = -Q/T2
ΔS_environment = Q/T1
其中,ΔS_system表示系统的熵变,ΔS_environment表示环境的熵变,Q表示热量的传递。
由于热量的传递是从热源向工作物体的,所以Q为负值。
假设热源传递了Q单位的热量给工作物体,那么可以写出:
ΔS_system = -(-Q)/T2 = Q/T2
ΔS_environment = -Q/T1
这两个表达式显示了系统和环境的熵在过程中是增加的。
由于系统和环境一起构成了一个孤立系统,总的熵变必须是正的。
2.气体在可膨胀容器中的膨胀
考虑一个可膨胀容器中的气体膨胀过程。
在此过程中,气体从一个高
压区域扩展到一个低压区域,使气体做功。
这个过程是不可逆的,因为气
体在膨胀过程中无法完全进行无损失的功。
假设气体的初态和末态分别为状态1和状态2,初态的压力为P1,体
积为V1,末态的压力为P2,体积为V2、再假设在膨胀过程中没有其他形
式的能量转换。
根据热力学第二定律,系统与环境的熵变可以表示为:ΔS_system = nR * ln(V2/V1)
ΔS_environment = -nR * ln(V2/V1)
其中,n为气体的物质的量,R为气体常数。
这两个表达式分别表示了系统和环境的熵增加量。
由于这是一个膨胀
过程,气体的体积增加,所以V2/V1大于1,从而使得ln(V2/V1)为正数。
由此可见,系统和环境的熵都增加了。
实际上,这个过程是不可逆的,但
是熵的分布合适地遵循熵增加的原则。
这两个例子展示了不可逆过程和环境的熵变计算的一种方法。
通过对
不可逆过程的熵变计算,可以更好地理解热力学中的熵概念和热力学第二
定律的含义。