(优选)配位化学中科院立体化学
- 格式:ppt
- 大小:838.50 KB
- 文档页数:44

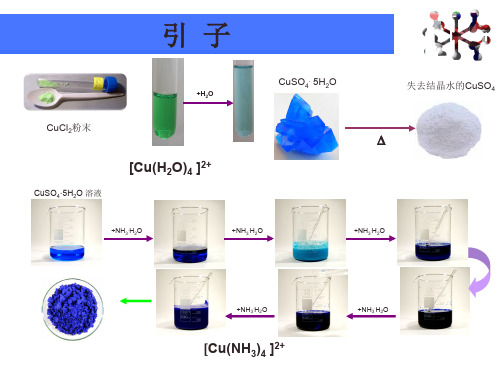


配位化学与配合物的立体构型配位化学是化学领域中的一个重要分支,研究金属离子和配体之间的相互作用。
配合物是由一个中心金属离子和周围配位基团构成的化合物。
在配位化学中,配位基团的排列方式对配合物的物理和化学性质起着关键的影响。
配位化学与配合物的立体构型密切相关,本文将探讨配位化学与配合物的立体构型的研究内容和意义。
一、立体构型的定义及分类在配位化学中,立体构型指的是配合物中利用空间排列方式描述配体和金属离子之间的关系。
立体构型可以通过分子结构的确定、光谱学以及理论计算等方法进行研究和解析。
配合物的立体构型分类主要有以下几种:1. 线性构型:配位基团沿直线排列。
这种构型通常出现在两个配位基团与金属离子之间的配位数为2时,如[Ag(NH3)2]+。
2. 方阵构型:配位基团沿正方形排列。
这种构型通常出现在四个配位基团与金属离子之间的配位数为4时,如[Ni(CN)4]2-。
3. 正八面体构型:配位基团沿正八面体排列。
这种构型通常出现在六个配位基团与金属离子之间的配位数为6时,如[Co(NH3)6]3+。
4. 正四面体构型:配位基团沿正四面体排列。
这种构型通常出现在四个配位基团与金属离子之间的配位数为4时,如[PtCl4]2-。
5. 正十二面体构型:配位基团沿正十二面体排列。
这种构型通常出现在八个配位基团与金属离子之间的配位数为8时,如[UO2(C2O4)4]4-。
二、配位化学与配合物的立体构型研究方法在配位化学中,研究配合物的立体构型的方法主要包括实验方法和理论计算方法。
1. 实验方法:实验方法是通过使用各种各样的实验手段来确定配合物的立体构型。
其中最常见的方法包括X射线晶体衍射、核磁共振、红外光谱等。
通过这些实验手段,可以确定配合物的原子间距离、键角等参数,从而推断立体构型。
2. 理论计算方法:理论计算方法是通过数学建模和计算机模拟来推测和预测配合物的立体构型。
其中最常用的方法包括量子化学计算和分子力场计算。


配位化学配合物立体构型练习题配位键数和配合物的八面体构型配位化学是研究过渡金属离子与配体之间形成化学键的一门学科。
配合物是由中心金属离子和与其形成化学键的配体组成的。
在配位化学中,研究配合物的立体构型常常是一个重要的课题。
配位键数是指一个配合物中中心金属离子与配体之间形成的化学键的数量。
在常见的配合物中,常见的配位键数有2、4、6和8等。
不同配位键数下,配合物的立体构型也不尽相同。
首先,我们来看看配位键数为2的配合物。
在这种情况下,配合物的立体构型通常是线性的。
典型的例子是二氯银配合物(AgCl2)。
在这个配合物中,银离子与两个氯离子形成两个配位键,配合物的形状为直线。
接下来,是配位键数为4的配合物,它们的立体构型通常是平面四方形。
典型的例子是四氯合钯(II)配合物(PdCl4)。
在这个配合物中,钯离子与四个氯离子形成四个配位键,配合物的形状为平面四方形。
进一步,当配位键数增加到6时,配合物的立体构型通常是八面体。
最典型的例子是六氯合铜(II)配合物(CuCl6)。
在这个配合物中,铜离子与六个氯离子形成六个配位键,配合物的形状为八面体。
最后,当配位键数增加到8时,配合物的立体构型也是八面体,但是与六配位的八面体不同,通常存在一些失衡的情况。
这种立体构型被称为扭曲八面体。
常见的例子是八氯化铜配合物(CuCl8)。
在这个配合物中,铜离子与八个氯离子形成八个配位键,但由于排斥力的影响,配合物的形状是扭曲的八面体。
除了上述的常见配位键数和立体构型外,还存在一些特殊的配位键数和配合物的立体构型。
例如,三配位键数下的配合物通常是线性的,五配位键数下的配合物可以有三角双锥、方双锥和正八面体等不同的构型。
总结来说,配位化学中配合物的立体构型与配位键数密切相关。
常见的配位键数有2、4、6和8等,分别对应线性、平面四方形、八面体和扭曲八面体等立体构型。
对于配位化学的学习来说,掌握不同配位键数下配合物的立体构型是十分重要的。