碳氢氧专题复习--浙教版
- 格式:ppt
- 大小:373.00 KB
- 文档页数:13
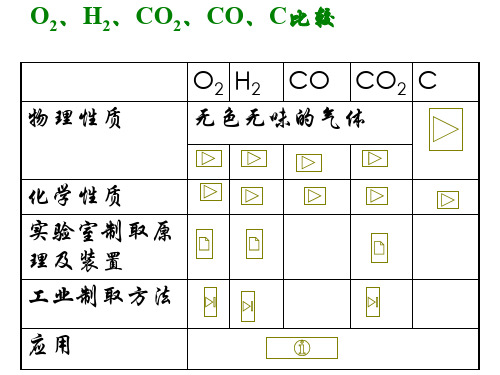

化学复习点一、空气、氧气1、空气:(1)能否用碳、硫代替红磷?不能原因:产物是气体,不能产生压强差(2)空气的污染及防治:对空气造成污染的主要是有害气体(CO、SO2、氮的氧化物)和烟尘等。
目前计入空气污染指数的项目为CO、SO2、NO2、O3和可吸入颗粒物等。
(3)空气污染的危害、保护:○1危害:严重损害人体健康,影响作物生长,破坏生态平衡.全球气候变暖,臭氧层破坏和酸雨等○2保护:加强大气质量监测,改善环境状况,使用清洁能源,工厂的废气经处理过后才能排放,积极植树、造林、种草等(4)目前环境污染问题:臭氧层破坏(氟里昂、氮的氧化物等)温室效应(CO2、CH4等)酸雨(NO2、SO2等)白色污染(塑料垃圾等)2、氧气(1)氧气的化学性质:特有的性质:支持燃烧,供给呼吸(2)氧气与下列物质反应现象(氧气和下列物质的燃烧):(3)氧气的制备:工业制氧气——分离液态空气法(原理:氮气和氧气的沸点不同物理变化)实验室制氧气原理:○1○2○3(4)气体制取与收集装置的选择发生装置:固固加热型、固液不加热型收集装置:根据物质的密度、溶解性(5)制取氧气的操作步骤和注意点(以高锰酸钾制取氧气并用排水法收集为例)a、步骤:查—装—定—点—收—移—熄b、注意点①试管口略向下倾斜:防止冷凝水倒流引起试管破裂②药品平铺在试管的底部:均匀受热③铁夹夹在离管口约1/3处④导管应稍露出橡皮塞:便于气体排出⑤试管口应放一团棉花:防止高锰酸钾粉末进入导管⑥排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是试管中的空气)⑦实验结束时,先移导管再熄灭酒精灯:防止水倒吸引起试管破裂⑧用排空气法收集气体时,导管伸到集气瓶底部(6)氧气的验满:用带火星的木条放在检验:用带火星的木条伸入3、催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。
(一变两不变)催化剂在化学反应中所起的作用叫催化作用。

MnO 2 课 题氧、氢、碳和铁复习 课 型 复习 日 期200 年 月 日上下午第 节 教 具 投影片 教学目标1、掌握氧气的化学性质,氧气的实验室制法;了解氧气的物性和用途。
2、了解分解反应、化合反应和氧化反应;了解燃烧的条件和缓慢氧化。
3、了解氢气的化学性质和物理性质,了解还原反应和置换反应的概念。
4、掌握二氧化碳的化学性质,了解碳单质的性质及二氧化碳的制法。
5、了解铁的性质,了解生铁和钢,懂得合金的含义。
重 点 难 点氧气、氢气、二氧化碳的性质和实验室制法;铁的性质和铁合金教学过程:一 、氧气、氢气和二氧化碳的区别和联系1、 物理性质:氧气:无色、无味,不易溶于水,通常情况下密度比空气大氢气:无色、无味,难溶于水,密度最小二氧化碳:无色、无味,微溶于水,密度为1.98克/升。
固体二氧化碳通常叫干冰2、 化学性质:氧气:较为活泼能和多种物质发生化学反应。
氢气:可燃性和还原性。
二氧化碳:一般较为稳定。
既不能燃烧,也不能支持燃烧。
3、 实验室制法:氧气:(1)2KClO 3====2KCl+3O 2↑(2)2KmnO 4==K 2MnO 4+MnO 2+O 2↑氢气:Zn+H 2SO 4=ZnSO 4+H 2↑二氧化碳:CaCO 3+2HCl=CaCl 2+CO 2↑ +H 2O4、 收集:氧气:排水法和向上排气法氢气:排水法和向下排气法二氧化碳:向上排气法一、碳和铁1、碳:碳单质有金刚石、石墨、木炭、焦碳、活性碳和碳黑。
2、碳的化学性质有可燃性和还原性。
3、铁:纯净的铁具有银白色的金属光泽,质软,密度为7.8克/毫升,熔点为1553℃摄氏度,有良好的延展性,传导性和铁磁性。
铁的化学性质很活泼1、在加热时和氧气等非金属反应2、在高温下铁和水反应3、铁和酸反应4、铁和盐反应4、铁的两种合金:生铁和钢板书设计课后小结氧、氢、碳和铁复习一、氧气、氢气和二氧化碳的比较1、化学性质2、物理性质3、实验室制取4、收集二、碳和铁1、碳2、铁。
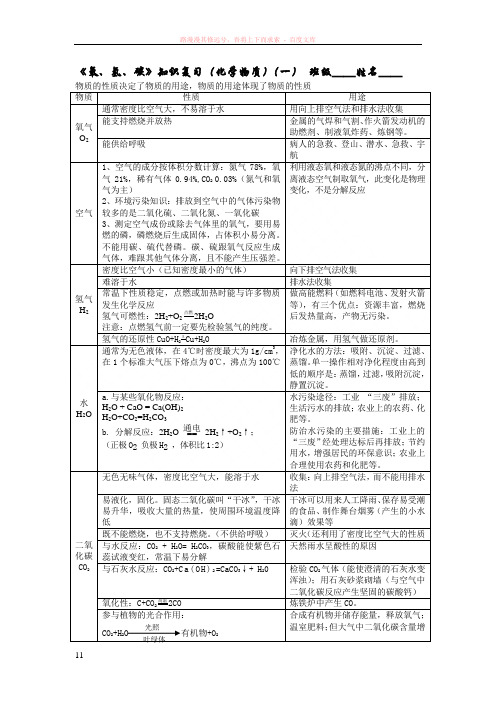
《氧、氢、碳》知识复习(化学物质)(一)班级__姓名__物质性质用途氧气O2通常密度比空气大,不易溶于水用向上排空气法和排水法收集能支持燃烧并放热金属的气焊和气割、作火箭发动机的助燃剂、制液氧炸药、炼钢等。
能供给呼吸病人的急救、登山、潜水、急救、宇航空气1、空气的成分按体积分数计算:氮气78%,氧气21%,稀有气体0.94%,CO2 0.03%(氮气和氧气为主)2、环境污染知识:排放到空气中的气体污染物较多的是二氧化硫、二氧化氮、一氧化碳3、测定空气成份或除去气体里的氧气,要用易燃的磷,磷燃烧后生成固体,占体积小易分离。
不能用碳、硫代替磷。
碳、硫跟氧气反应生成气体,难跟其他气体分离,且不能产生压强差。
利用液态氧和液态氮的沸点不同,分离液态空气制取氧气,此变化是物理变化,不是分解反应氢气H2密度比空气小(已知密度最小的气体)向下排空气法收集难溶于水排水法收集常温下性质稳定,点燃或加热时能与许多物质发生化学反应氢气可燃性:2H2+O2点燃2H2O注意:点燃氢气前一定要先检验氢气的纯度。
做高能燃料(如燃料电池、发射火箭等),有三个优点:资源丰富,燃烧后发热量高,产物无污染。
氢气的还原性CuO+H2ΔCu+H2O 冶炼金属,用氢气做还原剂。
水H2O 通常为无色液体,在4℃时密度最大为1g/cm3,在1个标准大气压下熔点为0℃,沸点为100℃净化水的方法:吸附、沉淀、过滤、蒸馏。
单一操作相对净化程度由高到低的顺序是:蒸馏,过滤,吸附沉淀,静置沉淀。
a.与某些氧化物反应:H2O + CaO = Ca(OH)2H2O+CO2=H2CO3b. 分解反应:2H2O 通电==2H2↑+O2↑;(正极O2 负极H2 ,体积比1:2)水污染途径:工业“三废”排放;生活污水的排放;农业上的农药、化肥等。
防治水污染的主要措施:工业上的“三废”经处理达标后再排放;节约用水,增强居民的环保意识;农业上合理使用农药和化肥等。
二氧化碳CO2无色无味气体,密度比空气大,能溶于水收集:向上排空气法,而不能用排水法易液化,固化。

第7节自然界中的氧循环和碳循环1.自然界中的氧循环消耗氧气的主要途径是等;产生氧气的途径是。
大气中的氧气的含量会随着生物的呼吸、微生物的氧化分解和物质的燃烧等运动而减少,但又会随植物的光合作用而增加,周而复始地进行循环,这就是自然界的氧循环。
自然界中的氧是在不断循环变化的。
2.自然界中的碳循环自然界中的碳可以以单质和化合物的形态出现,碳在自然界中也是可以循环的。
碳的循环主要通过CO2来进行的。
它可以分为三种形式。
(1)是植物经作用将大气中的二氧化碳和水化合生成有机物,在一作用中又以二氧化碳返回大气中被植物再度利用;(2)是植物被动物采食后,有机物被动物吸收,在体内氧化成二氧化硪,并通过释放回大气中又可植物利用。
(3)是动植物残体被分解,以及等燃烧时,生成二氧化碳,它返回大气中后重新进人生态系统和碳循环。
3.温室效应大气中等温室气体具有吸热和隔热的功能,使太阳辐射到地球上的热量无法向外层空间发散,其结果是地球表面变热起来,从而产生。
在温室气体中二氧化碳占55%,其他还包括水蒸气、臭氧、氧化亚氮、甲烷、氯氟烃等。
适度的“温室效应”能保证地球上的气温恒定,适于动植物生存,促进植物的光合作用。
“温室效应”加剧在一定程度上导致全球性气候变暖,产生一系列的危害。
①;②;③;④。
(1)温室效应产生的原因。
①矿物燃料(如煤、石油、天然气)的大量使用;②乱砍滥伐造成森林面积减少。
(2)减缓温室效应的措施。
①减少化石燃料的使用;②开发新能源;③植树造林,严禁乱砍滥伐。
题型一自然界中的氧循环1.氧气在自然界中存在非常广泛,并不断循环转化。
请回答以下问题:(1)铁生锈、动植物的呼吸(填“是”或“不是”)缓慢氧化。
(2)下图是自然界中氧的部分循环示意图。
从①~⑥中选择序号填空,消耗氧气的有,产生氧气的有。
(3)将沸点不同的气体分离开来,常采用液化分离法。
如,控制温度在-183℃时,可将空气中氮气(N2)与氧气(O2)分离。