元素周期律 知识点总结
- 格式:docx
- 大小:101.75 KB
- 文档页数:4

”核外电子(Z 个)1.微粒间数目关系最外层电子数决定元素的化学性质质子数(Z )=核电荷数=原子数序原子序数:按质子数由小大到的顺序给元素排序,所得序号为元素的原子序数。
质量数(A )=质子数(Z )+中子数4.电子总数为最外层电子数 2倍:4Be 。
4.1~20号元素组成的微粒的结构特点元素周期律决定原子种类,中子N (不带电荷), ________________________f 原子核- 质量数(A=N+ZI 质子Z (带正电荷)丿T 核电荷数 ____________豪同位素(核素)—近似相对原子质量事元素 T 元素符号原子结构 : (A x ) 「最外层电子数决定主族元素的■■ f 电子数(Z 个):丿1 ---〔化学性质及最高正价和族序数-■体积小,运动速率高(近光速),无固定轨道核外电子J 运动特征 JL 电子云(比喻)——> 小黑点的意义、小黑点密度的意义。
排布规律 T 电子层数兰J 周期序数及原子半径 ■表示方法 T 原子(离子)的电子式、原子结构示意图决定原子呈电中性原子(AZ X)_______ 2质子(Z 个)]——决定元素种类 原子核卜中子 (A-Z )个决定同位素种类中性原子:质子数=核外电子数 离子:质子数 =核外电子数+ 所带电荷数 离子:质子数=核外电子数一所带电荷数2. 原子表达式及其含义Xd ±表示X 原子的质量数;Z 表示元素X 的质子数;d 表示微粒中X 原子的个数;c ±表示微粒所带的电荷数;±)表示微粒中X 元素的化合价。
3.原子结构的特殊性 (1~18号元素)1. 原子核中没有中子的原子:2 •最外层电子数与次外层电子数的倍数关系。
①最外层电子数与次外层电子数相等:4Be 、i8Ar ;②最外层电子数是次外层电子数 2倍:6C ;③最外层电子数是次外层电子数3倍:80;④最外层电子数是次外层电子数10Ne ;⑤最外层电子数是次外层电子数 1/2倍:3Li 、14Si 。

元素周期律知识点总结1.元素周期律的发现历史元素周期律最早由俄国化学家门捷列夫于1869年提出,并且将已知的63个元素按照一定的规律排列。
门捷列夫将元素的性质与其原子量进行比较,发现存在周期性变化的规律。
后来,门捷列夫的周期表不断进行修正和完善,最终发展成为现代元素周期表。
2.元素周期表的结构元素周期表是按照元素原子序数的大小进行排列的,原子序数是指元素原子核中质子的数量,也是元素周期表中元素的标识。
周期表由横行的周期和竖列的族组成。
横行的周期称为周期,竖列的族称为主族。
元素周期表根据元素的电子结构、原子半径、电负性等性质进行划分。
3.元素周期律的主要规律-周期性规律:位于同一周期中的元素,原子量存在递增的趋势,并且许多性质会随着周期数的增加而周期性变化。
例如,金属元素的电子亲和能随周期数的增加而降低。
-垂直规律:位于同一族中的元素,原子量相似,并且许多性质也会有相似之处。
例如,碱金属元素(第一族)都具有相似的反应性和活泼的性质。
-斜线规律:元素周期表中的主要对角线称为斜线规律。
按照斜线方向进行排列的元素,在一些性质上有着相似之处,并且具有一定的趋势。
例如,元素周期表中的碱土金属(第二族)和卤素(第七族)的电子亲和能都随着原子量的增加而增加。
4.元素周期律的应用-预测新元素:元素周期律的周期性规律可以用来预测尚未发现的元素的性质。
例如,门捷列夫在提出元素周期表后,成功预测了后来发现的元素镓、铊和锪。
-元素的共价价态:元素周期表中同一族元素的共价价态具有相似性,例如,氧族元素的共价价态为-2-元素的化合价:元素周期表中主族元素的化合价与其所在的族数有关,例如,第一族的元素的化合价为+1-化学反应的活性和性质:元素周期表中的元素按照周期和族的排列,可以看出元素的活性和性质的变化趋势。
例如,金属元素活动性随周期数的增加而增加。
-过渡元素的性质:元素周期表中的过渡元素具有丰富的氧化态和复合态,具有多种形态的存在。

元素周期律知识点总结一、元素周期律的发现历程元素周期律是指化学元素按照一定规律排列的周期表。
在19世纪末,俄国化学家门捷列夫发现了元素周期律的规律,他将元素按照原子量的大小排列,发现了一些规律性的现象,比如元素的性质会随着原子量的增大而周期性地变化。
这一发现为后来的元素周期表的建立奠定了基础。
二、元素周期律的基本规律1. 原子序数元素周期律是根据元素的原子序数所排列的。
原子序数是指元素原子核中质子的数量,也是元素在周期表中的位置。
原子序数的增大决定了元素的性质的变化。
2. 周期性元素周期律的核心规律是周期性。
即元素的性质会随着原子序数的增大而周期性地变化。
这一规律可以用周期表中元素的位置来很好地解释。
3. 周期性表现元素周期律的周期性表现在以下方面:(1)元素的化学性质:比如金属元素和非金属元素的相互转变,电子亲和力、电负性等性质的周期变化。
(2)物理性质:原子半径、离子半径、电离能等。
(3)氧化物的性质:比如元素氧化物与水的反应性随着周期的增加而发生变化。
(4)化合价:元素的化合价随周期性地增加而变化。
三、周期表的结构元素周期表是由俄国化学家门捷列夫在1869年发现的,现在该表是由7行18列组成。
其中,横着排列的称为周期,纵向排列的称为族。
周期表的左侧是金属元素,右侧是非金属元素,中间是过渡元素。
周期表中有主族元素、副主族元素、过渡元素和稀有元素等。
四、周期表中的规律1. 周期性规律周期表中最基本的规律就是原子量的周期性变化。
比如,原子序数为3、11、19、37、55等元素的性质非常相似,因为它们在同一个周期内。
这些元素的外层电子数相同,因此具有相似的化学性质。
这一规律逐渐得到了发展,形成了更加完备的元素周期律。
2. 周期表的周期性规律周期表中的元素周期性地排列,列代表着元素的性质与它们的电子排布有关。
比如,同一族元素的外层电子数相同,因此它们的化学性质会有相似之处。
周期表中元素的周期性变化也与元素的原子结构有关,因为原子的结构决定了元素的性质。
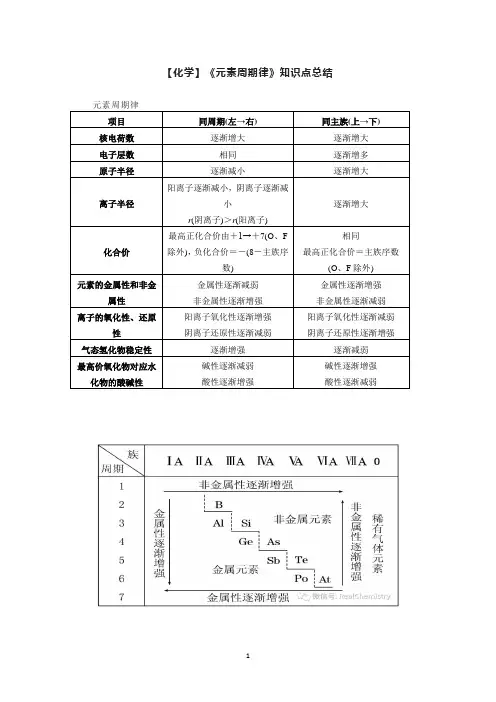
【化学】《元素周期律》知识点总结元素周期律项目同周期(左→右)同主族(上→下)核电荷数逐渐增大逐渐增大电子层数相同逐渐增多原子半径逐渐减小逐渐增大离子半径阳离子逐渐减小,阴离子逐渐减小r(阴离子)>r(阳离子)逐渐增大化合价最高正化合价由+1→+7(O、F除外),负化合价=-(8-主族序数)相同最高正化合价=主族序数(O、F除外)元素的金属性和非金属性金属性逐渐减弱非金属性逐渐增强金属性逐渐增强非金属性逐渐减弱离子的氧化性、还原性阳离子氧化性逐渐增强阴离子还原性逐渐减弱阳离子氧化性逐渐减弱阴离子还原性逐渐增强气态氢化物稳定性逐渐增强逐渐减弱最高价氧化物对应水化物的酸碱性碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱重难突破一、元素金属性、非金属性比较1.元素金属性强弱的判断(1)比较元素的金属性强弱,其实质是看元素原子失去电子的难易程度,越容易失去电子,金属性越强。
(2)金属单质和水或非氧化性酸反应置换出氢越容易,金属性越强;最高价氧化物对应水化物的碱性越强,金属性越强。
2.元素非金属性强弱的判断(1)比较元素的非金属性强弱,其实质是看元素原子得到电子的难易程度,越容易得到电子,非金属性越强。
(2)单质越容易与氢气化合,生成的氢化物越稳定,非金属性越强;最高价氧化物对应水化物的酸性越强,说明其非金属性越强。
典例2X、Y为同周期元素,如果X的原子半径大于Y,则下列判断不正确的是()A.若X、Y均为金属元素,则X的金属性强于YB.若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子强C.若X、Y均为非金属元素,则Y的非金属性比X强D.若X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X【答案】B典例1已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是()A.气态氢化物的稳定性:HX>H2Y>ZH3B.非金属活泼性:Y<X<ZC.原子半径:X>Y>ZD.原子最外层电子数:X<Y<Z【答案】A二、微粒半径大小的比较1. 同周期元素的微粒同周期元素的原子(稀有气体除外),从左到右原子半径或最高价阳离子的半径随核电荷数增大而逐渐减小。

一、原子结构1、原子是由和组成的,质子电,中子,电子;核内质子数等于核外电子数,因此原子电2、质量数(A)= 质子数(Z)+ 中子数(N)(质量数在数值上等于其相对原子质量)原子中:原子序数= = =阳离子中:质子数=核电荷数=离子核外电子数+ 离子电荷数阴离子中:质子数=核电荷数=离子核外电子数- 离子电荷数3、电子层划分电子层数: 1 2 3 4 5 6 7符号:;离核距离,能量;离核距离,能量4、核外电子排布规律(一低四不超)(1)核外电子总是尽量先排布在能量低的电子层,然后由里向外从能量的电子层逐步向能量的电子层摆布(即排满K层再排L层,排满L层再排M层)。
(2)各电子层再多容纳的电子数是个(n表示电子层)(3)最外层电子数不超过个(K层是最外层时,最多不超过2 个);次外层电子数不超过个;倒数第三层不超过个。
(4)画出18号、33号、82号、114号的原子结构示意图,并描述其在周期表中的位置:5、概念(1)元素:具有相同的同一类原子的总称,核电荷数决定元素种类。
(2)核素:具有一定和一定的一种原子。
(3)同位素:相同而不同一元素的不同之间的互称。
例:氕()、氘()、氚()(4)同素异形体:同种组成结构不同的不同单质之间的互称。
例:与,与,与等6、粒子半径大小的比较(1)同周期元素的原子或最高价阳离子的半径随着核电荷数的增大而(除稀有气体外)。
例:Na Mg Al Si; Na+Mg2+Al3+(2)同主族元素的原子或离子随核电荷数增大而。
例:Li Na K, Li+Na+K+(3)电子层结构相同(核外电子排布相同)的离子半径(包括阴阳离子)随核电荷数的增加而。
(上一周期元素形成的阴离子与下一周期元素形成的阳离子有此规律)(4)同种元素原子形成的粒子半径大小为:阳离子<中性原子<阴离子;价态越高的粒子半径越小。
例:Fe3+Fe2+Fe; H+H H-(5)电子数和核电荷数都不同的,一般可通过一种参照物进行比较。

高中化学元素周期律知识点总结-CAL-FENGHAI.-(YICAI)-Company One1第一节课时1元素周期表的结构一、元素周期表的发展历程二、现行元素周期表的编排与结构1.原子序数(1)含义:按照元素在元素周期表中的顺序给元素编号,得到原子序数。
(2)原子序数与原子结构的关系原子序数=核电荷数=质子数=核外电子数。
2.元素周期表的编排原则(1)原子核外电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行,称为周期。
(2)原子核外最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵行,称为族。
3.元素周期表的结构(1)周期(横行)①个数:元素周期表中有7个周期。
②特点:每一周期中元素的电子层数相同。
③分类(3短4长)短周期:包括第一、二、三周期(3短)。
长周期:包括第四、五、六、七周期(4长)。
(2)族(纵行)①个数:元素周期表中有18个纵行,但只有16个族。
②特点:元素周期表中主族元素的族序数等于其最外层电子数。
③分类④常见族的特别名称 第ⅠA 族(除H):碱金属元素;第ⅦA 族:卤族元素;0族:稀有气体元素;ⅣA 族:碳族元素;ⅥA 族:氧族元素。
课时2 元素的性质与原子结构一、碱金属元素——锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr) 1.原子结构(1)相似性:最外层电子数都是__1__。
(2)递变性:Li ―→Cs ,核电荷数增加,电子层数增多,原子半径增大。
2.碱金属单质的物理性质3.碱金属元素单质化学性质的相似性和递变性 (1)相似性(用R 表示碱金属元素)单质R —⎩⎪⎨⎪⎧与非金属单质反应:如Cl 2+2R===2RCl 与水反应:如2R +2H 2O===2ROH +H 2↑与酸溶液反应:如2R +2H +===2R ++H 2↑化合物:最高价氧化物对应水化物的化学式为ROH ,且均呈碱性。
(2)递变性具体表现如下(按从Li→Cs 的顺序)①与O 2的反应越来越剧烈,产物越来越复杂,如Li 与O 2反应只能生成Li 2O ,Na 与O 2反应还可以生成Na 2O 2,而K 与O 2反应能够生成KO 2等。

必修2第二章第二节元素周期律17个知识点归纳1、对原子的4点认识(1)原子是构成物质的三种微粒(分子、原子、离子)之一。
(2)原子是化学变化中的最小微粒。
化学变化就是分子拆开成原子,原子重新组合成分子的过程。
(3)原子是由居于原子中心的带正电的原子核和绕核运动的带负电的核外电子构成。
原子核由质子和中子构成,原子的质量几乎全部集中在原子核上,质量数=质子数+中子数。
(4)原子呈电中性,质子数=核电荷数=原子序数=核外电子数。
离子是带电荷的原子,离子所带电荷=离子的质子数—离子的核外电子数。
2、前20号元素原子结构示意图的4种基本模型用Z表示原子序数,将前20号元素的原子结构示意图归纳成四种基本模型如下:3、同周期主族元素性质的递变规律6条(1)核外电子排布:随着核电荷数增大,内层电子数不变,最外层电子数逐渐增多(除第一周期外,每一周期主族元素的最外层电子数都是从1个增加到7个)。
(2)原子半径:随着核电荷数增大,原子半径逐渐减小。
(3)最高正化合价:随着核电荷数增大,最高正化合价从+1 → +7(氧、氟例外)。
(4)非金属元素的最低负价:随着核电荷数增大,从IVA→VIIA,化合价升高,-4 → -1。
(5)金属性、非金属性:随着核电荷数增大,金属性越来越弱、非金属性越来越强。
(6)元素最高价氧化物对应的水化物的酸碱性:随着核电荷数增大,元素最高价氧化物对应的水化物的碱性越来越弱、酸性越来越强。
4、元素周期律:元素的性质随着原子序数的递增而呈现周期性变化的规律。
5、有关元素周期表的10点认识:(1)元素周期表有多少横行就有多少周期,但是不是有多少列就有多少族。
(2)周期是电子层数相同的元素集合,族是性质相似的元素集合。
(3)族是性质相似的元素集合,所以氦元素排在了0族,而不是IIA。
(4)族是性质相似的元素集合,所以氢元素既可以排在IA也可以排在VIIA(NaH)。
(5)元素种类最少的周期是第一周期,元素种类最多的周期是第六周期(依据现在的元素周期表)。

元素周期律知识点总结1.元素周期律的历史:元素周期表最早由俄罗斯化学家门捷列夫发现,他将已知的元素按照重量递增的顺序进行排列,并注意到一些元素会在一定的重复间隔后再次出现,从而提出了元素周期性的概念。
后来,英国化学家门德里耶夫将元素按照电子结构进行排列,更加完善了元素周期表。
2.元素周期表的结构:元素周期表由横行称为周期,纵列称为族。
周期表中的元素按照原子序数递增排列,每个周期分为两个部分:s区和p区。
s区第一个元素是碱金属,最后一个元素是碱土金属,p区的最后一位元素是卤素。
3.原子序数和原子量:原子序数是元素周期表中每个元素的唯一标识,表示原子核中的质子数量。
原子序数从左到右递增,每增加一个元素,质子数量增加一、原子量是元素中质子和中子的总和,它的单位是原子质量单位(amu)。
4.周期表中的元素周期性:元素周期表的最重要特征之一是元素周期性,即元素性质随着原子序数的增加而周期性变化。
例如,原子半径和离子半径在一个周期内是递减的,而在一个族内则是递增的。
5.元素的分类:元素可以按照性质和位置进行分类。
按性质分类,元素可以分为金属、非金属和半金属。
按位置分类,元素可以分为主族元素、过渡金属和稀土金属。
6.周期表的块:周期表分为s区、p区、d区和f区。
s区包含1A和2A族元素,它们容易失去或共享一个或两个电子成为正离子。
p区包含3A到8A族元素,它们容易获得电子成为负离子。
d区包含过渡金属元素,它们填充在外层d轨道上的电子。
f区包含稀土金属元素,它们填充在内层f轨道上的电子。
7.周期表的周期性规律:周期表中的元素具有许多周期性规律。
其中一些重要的规律包括:-电离能:元素失去一个电子所需的能量。
电离能在周期内是递增的,而在一个族内是递减的。
-电负性:元素吸引和结合电子的能力。
电负性在周期内递增,而在一个族内递减。
-原子半径:元素原子的大小。
原子半径在周期内是递减的,在一个族内是递增的。
-金属性和非金属性:金属元素在左侧,非金属元素在右侧。

元素周期表元素周期律知识点总结元素周期表元素周期律知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行——周期;③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族2、如何精确表示元素在周期表中的位置:周期序数=电子层数;主族序数=最外层电子数口诀:三短三长一不全;七主七副零八族熟记:三个短周期,第一和第七主族和零族的元素符号和名称3、元素金属性和非金属性判断依据:①元素金属性强弱的判断依据:单质跟水或酸起反应置换出氢的难易;元素最高价氧化物的.水化物——氢氧化物的碱性强弱;置换反应。
②元素非金属性强弱的判断依据:单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;最高价氧化物对应的水化物的酸性强弱;置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数==质子数+中子数:a==z+n②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。
(同一元素的各种同位素物理性质不同,化学性质相同)二、元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价)负化合价数=8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律:同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
同周期:左→右,核电荷数——→逐渐增多,最外层电子数——→逐渐增多原子半径——→逐渐减小,得电子能力——→逐渐增强,失电子能力——→逐渐减弱氧化性——→逐渐增强,还原性——→逐渐减弱,气态氢化物稳定性——→逐渐增强最高价氧化物对应水化物酸性——→逐渐增强,碱性——→逐渐减弱化学键含有离子键的化合物就是离子化合物;只含有共价键的化合物才是共价化合物。

周期律知识点总结一、周期律的基本概念周期律是描述元素周期表中元素性质规律的概念,它最早由门捷列夫在1869年提出,并在之后得到了孟德莱耶夫、莫丹塔夫、门捷列夫等科学家的深入研究和发展。
周期律的基本概念包括元素周期表的构造原则和元素周期性规律。
1. 元素周期表的构造原则元素周期表是按元素的原子序数大小依次排列的一种表格,最早由门捷列夫提出。
元素周期表的构造遵循以下原则:(1) 按原子序数大小排列。
原子序数是元素的重要标识,它代表了元素原子核中质子的数量,也是元素在同一周期内的位置标识。
元素周期表中元素的排列顺序与它们的原子序数大小呈正比,原子序数从左到右逐渐增加。
(2) 周期表的主要构造原则是周期律规则。
元素周期表的构造中,周期律规则是构造的基础原则。
周期律规则包括:周期性规律、元素周期法则、主族元素和次族元素等。
2. 元素周期性规律元素周期性规律是指元素周期表中相邻元素化学性质的变化规律。
周期性规律主要有原子半径周期性规律、电子亲和能周期性规律、离子化能周期性规律和原子量周期性规律。
(1) 原子半径周期性规律。
原子半径是指原子的外层电子云的平均距离,原子半径的大小与原子核电荷数和外层电子数有关。
元素周期表中原子半径随着原子序数的增加而呈现规律性的变化,整体呈现出周期性变化。
(2) 电子亲和能周期性规律。
电子亲和能是指原子或原子离子吸收外层电子形成负离子的能力,电子亲和能的大小与原子核吸引外层电子的能力有关。
元素周期表中电子亲和能也随着原子序数的增加呈现规律性的变化,整体呈现出周期性变化。
(3) 离子化能周期性规律。
离子化能是指原子或原子离子失去一个或多个外层电子形成正离子的能力,离子化能的大小与原子核吸引外层电子的能力有关。
元素周期表中离子化能随着原子序数的增加呈现规律性的变化,整体呈现出周期性变化。
(4) 原子量周期性规律。
原子量是指元素的相对原子质量,原子量的大小与原子核的质子和中子数量有关,元素周期表中原子量也呈现出周期性变化规律。

元素周期律知识点总结1. 引言元素周期律是化学中的一个基本规律,由俄罗斯化学家门捷列夫首次提出,它描述了元素的性质如何随原子序数的增加而周期性变化。
本文将总结元素周期律的基本概念、发展历程、周期表的结构以及它在化学中的应用。
2. 元素周期律的基本概念元素周期律指出,元素的性质随着原子序数的增加呈现出周期性的重复。
这意味着具有相同电子排布的元素会展现出相似的化学性质,而这些性质在周期表中的特定位置会重复出现。
3. 元素周期律的发展历程- 1869年,门捷列夫发表了他的周期律,并创建了第一个周期表。
- 随后,随着新元素的发现和原子结构理论的发展,周期表不断被完善和扩展。
- 现代周期表基于量子力学原理,解释了元素周期律的物理基础。
4. 周期表的结构周期表是按照原子序数排列所有已知元素的表格,其结构如下:- 周期:水平排列的元素行,表示电子能级的主量子数。
- 族:垂直排列的元素列,表示电子排布中的价电子数目。
- 区块:周期表根据电子排布的亚层被分为s、p、d、f区。
- 原子序数:表中每个元素的编号,等于该元素原子核中的质子数目。
5. 元素周期律的应用- 预测元素的化学性质,如金属性、非金属性和电负性。
- 指导新元素的发现和研究。
- 解释和预测化学反应的类型和速率。
- 帮助理解和设计新材料。
6. 周期表中的特定趋势- 原子半径:同一周期内,从左到右原子半径减小;同一族内,从上到下原子半径增大。
- 电负性:同一周期内,从左到右电负性增加;同一族内,从上到下电负性减少。
- 离子化能:同一周期内,从左到右第一离子化能增加;同一族内,从上到下第一离子化能减少。
7. 结论元素周期律是化学中的核心概念之一,它不仅帮助化学家理解和分类元素,还指导着化学研究和工业应用。
随着科学技术的进步,对周期律的理解和应用将不断深化,推动化学科学的发展。
8. 参考文献- Mendeleev, D. I. (1869). The Dependence between the Properties of the Atomic Weights of the Elements. Journal of Experimental and Theoretical Chemistry, 1(4), 60-77.-WebElements. (n.d.). Retrieved from /请注意,本文为知识点总结,未包含实际文档格式,如需创建具体的文档,如教学PPT、讲义或报告,请根据实际需要调整内容和格式。
元素周期表知识点总结元素周期表知识点总结导语:化学元素周期表是根据原子序数从小至大排序的化学元素列表。
下面是小编收集整理的元素周期表知识点总结,希望对你有帮助!1、原子结构(1).所有元素的原子核都由质子和中子构成。
正例:612C、613C、614C三原子质子数相同都是6,中子数不同,分别为6、7、8。
反例1:只有氕(11H)原子中没有中子,中子数为0。
(2).所有原子的中子数都大于质子数。
正例1:613C、614C、13H等大多数原子的中子数大于质子数。
正例2:绝大多数元素的相对原子质量(近似等于质子数与中子数之和)都大于质子数的2倍。
反例1:氕(11H)没有中子,中子数小于质子数。
反例2:氘(11H)、氦(24He)、硼(510B)、碳(612C)、氮(714N)、氧(816O)、氖(1020Ne)、镁(1224Mg)、硅(1428Si)、硫(1632S)、钙(2040Ca)中子数等于质子数,中子数不大于质子数。
(3).具有相同质子数的微粒一定属于同一种元素。
正例:同一元素的不同微粒质子数相同:H+、H-、H等。
反例1:不同的中性分子可以质子数相同,如:Ne、HF、H2O、NH3、CH4。
反例2:不同的阳离子可以质子数相同,如:Na+、H3O+、NH4+。
反例3:不同的阴离子可以质子数相同,如:NH4+、OH-和F-、Cl和HS。
2、电子云(4).氢原子电子云图中,一个小黑点就表示有一个电子。
含义纠错:小黑点只表示电子在核外该处空间出现的机会。
3、元素周期律(5).元素周期律是指元素的性质随着相对原子质量的递增而呈周期性变化的规律。
概念纠错:元素周期律是指元素的性质随着原子序数的递增而呈周期性变化的规律。
(6).难失电子的元素一定得电子能力强。
反例1:稀有气体元素很少与其它元素反应,即便和氟气反应也生成共价化合物,不会失电子,得电子能力也不强。
反例2:IVA的非金属元素,既不容易失电子,也不容易得电子,主要形成共价化合物,也不会得失电子。
《元素周期律》知识清单一、元素周期表的结构元素周期表是化学中非常重要的工具,它呈现了元素的周期性规律。
1、周期周期是横行,目前有7 个周期。
第一周期只有2 种元素,即氢(H)和氦(He),属于短周期。
第二、三周期各有8 种元素,也是短周期。
第四、五、六周期各有 18 种元素,属于长周期。
第七周期又叫不完全周期,目前已发现的元素也较多。
周期数等于电子层数,随着周期数的增加,元素的原子核外电子层数逐渐增多。
2、族族是纵列,分为主族、副族、第Ⅷ族和 0 族。
主族用 A 表示,有 7个主族,分别是ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA。
副族用 B表示,有 7 个副族,分别是ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB。
第Ⅷ族包括 3 个纵列。
0 族即稀有气体元素所在的族。
主族元素的族序数等于最外层电子数。
3、分区根据元素的价电子排布特点,可将元素周期表分为 s 区、p 区、d 区、ds 区和 f 区。
s 区包括第ⅠA、ⅡA 族,价电子排布为 ns1-2。
p 区包括ⅢA 至ⅦA 族以及 0 族,价电子排布为 ns2np1-6。
d 区包括ⅢB 至ⅦB 族以及第Ⅷ族,价电子排布为(n 1)d1-10ns1-2。
ds 区包括ⅠB、ⅡB 族,价电子排布为(n 1)d10ns1-2。
f 区是镧系和锕系元素。
二、元素周期律的内容1、原子半径同周期从左到右,原子半径逐渐减小(稀有气体除外)。
因为同周期元素电子层数相同,核电荷数逐渐增大,对核外电子的吸引力逐渐增强,原子半径减小。
同主族从上到下,原子半径逐渐增大。
这是由于电子层数逐渐增多,原子半径增大。
2、化合价主族元素的最高正化合价等于族序数(O、F 除外),最低负化合价等于族序数 8。
3、金属性和非金属性同一周期,从左到右,金属性逐渐减弱,非金属性逐渐增强。
同一主族,从上到下,金属性逐渐增强,非金属性逐渐减弱。
金属性强弱可以通过单质与水或酸反应置换出氢的难易程度、最高价氧化物对应水化物的碱性强弱等来判断。
第一章 物质结构 元素周期律基础知识回顾一、原子结构质子(Z 个)原子核注意:中子(N 个) 质量数(A)=质子数(Z)+中子数(N)原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z 个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2、原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里; ②各电子层最多容纳的电子数是2n 2; ③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低) 二 三 四 五 六 七 对应表示符号: K L M N O P Q 3、元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说) 二、元素周期表 1、编排原则:①按原子序数递增的顺序从左到右排列 ②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数) ③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数 2、结构特点:核外电子层数 元素种类第一周期 1 2种元素短周期 第二周期 2 8种元素周期 第三周期 3 8种元素元 (7个横行) 第四周期 4 18种元素 素 (7个周期) 第五周期 5 18种元素 周 长周期 第六周期 6 32种元素期 第七周期 7 未填满(已有26种元素) 表 主族:ⅠA ~ⅦA 共7个主族族 副族:ⅢB ~ⅦB 、ⅠB ~ⅡB ,共7个副族 (18个纵行) 第Ⅷ族:三个纵行,位于ⅦB 和ⅠB 之间 (16个族) 零族:稀有气体 三、元素周期律1、元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素周期律知识点总结
一、元素周期律
1、定义:元素周期律(Periodic Law)是指按元素原子序数从小到大
排序,当元素所具有的质子数和中子数有一定的定律性变化时,元素
的化学性质也有相应的定律性变化的现象。
2、元素周期表:体现元素周期律的就是元素周期表,所有元素依据质
子数从小到大排列,形成由7条表排成形状似番茄坐放的元素周期表。
表中的每一行称为一个“周期”,每一列称为一个“族(Group)”。
3、物理化学性质的变化规律:
(1)质子数增加——元素的原子半径随着质子数增加而减小,元素的
熔点和沸点也随着质子数的增加而减小;
(2)族的变化——族之间的元素逐步由金属性变为非金属性;
(3)周期的变化——随着原子序数增加,周期中金属和非金属类型及
性质便开始改变。
4、戴拿贝定律:戴拿贝定律(Dobbine's Law)指出,元素周期表中前
8种元素的化学性质比较特殊,质子数介于1~8的元素的化学性质也专
有几分,它们的化学性质呈”8乘“型组织,每一组成份化学性质相似。
简言之,其中前8种元素的化学性质会有重复性,例如第一,八组
(1—8)都是氢族(无色、气态、可溶性);第二,九组(9—16)都是碱金属族(金属态、有色、可溶性);第三,十七组(17—24)都是非金属族(非金属态、不可溶性),以此类推。
5、定律的意义:元素周期律反映了原子内结构的一般规律性变化,使人们能够预测未知元素的性质,比较容易地判断出元素之间的特征及关联性,为元素的分类提供了重要的理论依据。
元素周期律知识点总结元素周期律学问点总结 1一.元素周期表的结构周期序数=核外电子层数主族序数=最外层电子数原子序数=核电荷数=质子数=核外电子数二.元素的性质和原子结构(一)碱金属元素:2.碱金属化学性质的递变性:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数渐渐增多,原子核对最外层电子的引力渐渐减弱,原子失去电子的力量增加,即金属性渐渐增加。
所以从Li到Cs的金属性渐渐增加。
结论:1)原子结构的递变性导致化学性质的递变性。
2)金属性强弱的推断依据:与水或酸反应越简单,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
3.碱金属物理性质的相像性和递变性:1)相像性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
2)递变性(从锂到铯):①密度渐渐增大(反常) ②熔点、沸点渐渐降低3)碱金属原子结构的相像性和递变性,导致物理性质同样存在相像性和递变性(二)卤族元素:2.卤素单质物理性质的递变性:从F2到I21)卤素单质的颜色渐渐加深;2)密度渐渐增大;3)单质的熔、沸点上升3.卤素单质与氢气的反应: X2 + H2 = 2 HX卤素单质与H2 的猛烈程度:依次减弱;生成的氢化物的稳定性:依次减弱4. 非金属性的强弱的推断依:1. 从最高价氧化物的水化物的酸性强弱,或与H2反应的难易程度以及氢化物的稳定性来推断。
2. 同主族从上到下,金属性和非金属性的递变:同主族从上到下,随着核电核数的增加,电子层数渐渐增多,原子核对最外层电子的引力渐渐减弱,原子得电子的力量减弱,失电子的力量增加,即非金属性渐渐减弱,金属性渐渐增加。
3. 原子结构和元素性质的关系:原子结构打算元素性质,元素性质反应原子结构。
同主族原子结构的相像性和递变性打算了同主族元素性质的相像性和递变性。
三.核素(一)原子的构成:(1)原子的质量主要集中在原子核上。
(2)质子和中子的相对质量都近似为1,电子的质量可忽视。
元素周期表与周期律知识总结知识结构图:一·周期表结构二·“位,构,性”的相互推导元素周期律三·原子结构四·碱金属五·卤素一.周期表结构1.元素周期表注意:A元素周期表的上界②金属与非金属的边界线B元素周期表中几个量的关系:(1)原子序数=核电荷数=质子数=核外电子数(2)周期序数=核外电子层数(3)主族序数=最外层电子数=元素的最高正价数(F无正价,O一般也无正价)(4)非金属元素:|最高正价数|+|负价数|=8C主族元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3)主族元素的最高正价和+最低负价的绝对值=82. 推断元素位置的规律判断元素在周期表中位置应牢记的规律:(1)元素周期数等于核外电子层数;(2)主族元素的序数等于最外层电子数;(3)确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。
最后的差数就是族序数,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数。
3推算元素的原子序数的简便方法同一主族相邻两元素原子序数差值(上周期的元素种类数)同一周期相邻两主族元素的原子序数差值4.每个周期元素的总数和每个周期过渡元素的总数二.“位、构、性”的相互推导失电子能力↓⇒金属性↑1.结构与性质 原子半径↑⇒F↓得电子能力↓⇒非金属性↓(1)原子核对最外层电子的引力核电核数↓ ⇒F↓半径↓ 半径↑ (主)同周期 F↓ 同主族 F↓ 质子数↑ 质子数↓(次)2.位置与结构(1) 周期数=电子数主族序数=3位置与性质①、核外电子排布②、原子半径性质递变 ③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性电子层数 相同条件下,电子层越多,半径越大。
元素周期表与周期律知识总结
知识结构图:
一·周期表结构
二·“位,构,性”的相互推导
元素周期律三·原子结构
四·碱金属
五·卤素
一.周期表结构
1.元素周期表
注意:A元素周期表的上界②金属与非金属的边界线
B元素周期表中几个量的关系:
(1)原子序数=核电荷数=质子数=核外电子数
(2)周期序数=核外电子层数
(3)主族序数=最外层电子数=元素的最高正价数(F无正价,O一般也无正价)
(4)非金属元素:|最高正价数|+|负价数|=8
C主族元素化合价
(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);
(2)同一主族的元素的最高正价、负价均相同
(3)主族元素的最高正价和+最低负价的绝对值=8
2. 推断元素位置的规律
判断元素在周期表中位置应牢记的规律:
(1)元素周期数等于核外电子层数;
(2)主族元素的序数等于最外层电子数;
(3)确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。
最后的差数就是族序数,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数。
3推算元素的原子序数的简便方法
同一主族相邻两元素原子序数差值(上周期的元素种类数)
同一周期相邻两主族元素的原子序数差值
4.每个周期元素的总数和每个周期过渡元素的总数
二.“位、构、性”的相互推导
失电子能力↓⇒金属性↑
1.结构与性质 原子半径↑⇒F↓
得电子能力↓⇒非金属性↓
(1)原子核对最外层电子的引力
核电核数↓ ⇒F↓
半径↓ 半径↑ (主)
同周期 F↓ 同主族 F↓ 质子数↑ 质子数↓(次)
2.位置与结构
(1) 周期数=电子数
主族序数=
3位置与性质
①、核外电子排布
②、原子半径
性质递变 ③、主要化合价
④、金属性与非金属性
⑤、气态氢化物的稳定性
⑥、最高价氧化物的水化物酸碱性
电子层数 相同条件下,电子层越多,半径越大。
判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。
最外层电子数 相同条件下,最外层电子数越多,半径越大。
微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)
如:Na>Mg>Al>Si>P>S>Cl.
2、同主族元素的原子半径随核电荷数的增大而增大。
如:Li<Na<K<Rb<Cs
具体规律 3、同主族元素的离子半径随核电荷数的增大而增大。
如:F --<Cl --<Br --<I --
4、电子层结构相同的离子半径随核电荷数的增大而减小。
如:F -> Na +>Mg 2+>Al 3+
ⅡA ⅢA 二三
X X+1 四五
X X+11 六七 X X+25
221r q q G F =
5、同一元素不同价态的微粒半径,价态越高离子半径越小。
如Fe>Fe 2+>Fe 3+
三:元素的金属性或非金属性强弱的判断
比较金属性的强弱,其实质是看元素原子失去电子的能力,越易失电子,金属性越强。
①从元素原子结构判断
a .当最外层电子数相同时,电子层数越多,原子半径越大,越易失电子,金属性越强。
b .当电子层数相同时,核电荷数越多越难失电子,金属性越弱(以后学)。
②从元素单质及其化合物的相关性质判断
a .金属单质与水或酸反应越剧烈,元素金属性越强。
b .最高价氧化物对应水化物的碱性越强,元素金属性越强。
③根据金属活动性顺序表判断
一般来说排在前面的金属元素其金属性比排在后面的强。
④离子的氧化性强弱判断
离子的氧化性越强,则对应金属元素的金属性越弱。
特别提醒 金属性强弱的比较,关键是比较原子失去电子的难易,而不是失去电子的多少。
如Na 失去一个电子,而Mg 失去两个电子,但Na 的金属性比Mg 强。
2.元素非金属性强弱
比较方法比较元素非金属性的强弱,其实质是看元素原子得到电子的难易程度,越易得电子,非金属性越强。
①从元素原子结构判断
a .当电子层数相同时,核电荷数越多,非金属性越强;
b .当最外层电子数相同时,核电荷数越多,非金属性越弱。
②从元素单质及其化合物的相关性质判断
a .单质越易跟H 2化合,生成的氢化物也就越稳定,氢化物的还原性也就越弱,其非金属性也就越强。
b .最高价氧化物对应水化物的酸性越强,其非金属性越强。
如H 2SO 4的酸性强于H 3PO 4,说明S 的非金属性比P 强。
c .非金属单质间的置换反应,例如:Cl 2+2KI===2KCl +I 2,说明氯的非金属性比碘强。
d .元素的原子对应阴离子的还原性越强,元素的非金属性就越弱。
如S 2-的还原性比Cl -
强,说明Cl 的非金属性比S 强。
中子N
原子核
质子Z
四:原子结构 :
电子数(Z 个)核外电子 排布规律 → 电子层数 周期序数及原子半径
表示方法 → 原子(离子)的电子式、原子结构示意图 五:碱金属单质的相似性与递变性
(1)相似性
①与O 2反应生成相应的氧化物,如Li 2O 、Na 2O 等。
②与Cl 2反应生成RCl ,如NaCl 、KCl 等。
③与H 2O 反应,能置换出H 2O 中的氢,反应通式为2R +2H 2O===2ROH +H 2↑。
④与非氧化性酸反应,生成H 2,反应通式为2R +2H +===2R +
+H 2↑。
(R 表示碱金属元素)
(2)递变性
从Li 到Cs ,随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子核对核外电子的吸引能力逐渐减弱,失电子能力逐渐增强,金属性逐渐增强。
表现为:
①与O 2的反应越来越剧烈,产物更加复杂,如Li 与O 2反应只能生成Li 2O ,Na 与O 2反应还可以生决定原子呈电中性 X)
(A Z
成Na 2O 2,而K 与O 2反应能够生成KO 2等。
②与H 2O 的反应越来越剧烈,如K 与H 2O 反应可能会发生轻微爆炸,Rb 与Cs 遇水发生剧烈爆炸。
③对应离子的氧化性依次减弱,即氧化性:Li +>Na +>K +>Rb +>Cs +。
④最高价氧化物对应水化物的碱性逐渐增强,CsOH 的碱性最强。
特别提醒 (1)碱金属单质性质的相似性和递变性是其原子结构的相似性和递变性的必然结果。
(2)因Na 、K 等很活泼的金属易与H 2O 反应,故不能从溶液中置换出不活泼的金属。
六.卤素
①物理性质:单质熔、沸点都比较低
②化合价:-1,+2,+3,+5,+7
③活泼非金属,易得电子
④单质氧化性很强
⑤H 2+X 2→HX
⑥X 2+H 2O→HX+HXO(F 2除外)
⑦X 2+NaOH→NaX+NaXO+H 2O(F 2除外)
⑧X 2+M→MX n
⑨卤代反应
⑩加成反应
①从上到下单质的熔、沸点,密度增大
②单质的状态:气→液→固
③单质的颜色变深
2.递变性 ④非金属性减弱
⑤原子、离子半径增大,
⑥HX 的酸性增强
⑦X 2+H 2O→HX+HXO 的反应强度减弱
①氟的化合价只有-1,没有正价
②氟没有含氧酸
③2F 2+2H 2O=4HF+O 2 ④F 2+NaOH= NaF+OF 2↑+H 2O
⑤F 2不能置换其他卤化物水溶液中的卤素,直接和水反应
⑥I 2和Fe 反应生成Fe 2+ I 2+Fe→FeI 2 (Fe+X 2→FeX 3)
3.特殊性 1.相似性。