-6考点一 考点二 考点三
基础梳理
考点突破 高考微题组
盐的 类型 强酸强 碱盐 强酸弱 碱盐 强碱弱 酸盐
是否水解 否 是 是
水解的 溶液的 溶液 实例 离子 酸碱性 的 pH — 中性 pH=7 pH<7 pH>7 NaCl、KNO3 NH4 Cl、 Cu(NO3 )2 CH3 COONa、 Na2 CO3
-12考点一 考点二 考点三
基础梳理
考点突破 高考微题组
水解 水解 水解产生离 平衡 程度 子的浓度 弱酸根离子的水解程度 外加酸 增大, 弱碱阳离子的水解 程度减小 弱酸根离子的水解程度 外加碱 减小, 弱碱阳离子的水解 程度增大 因素
解释 加入酸或碱能促进或抑制盐类 的水解。如:水解呈酸性的盐溶 液, 若加入碱, 就会中和溶液中 的 H+, 使平衡向水解的方向移 动而促进水解;若加入酸, 则抑 制水解
-5考点一 考点二 考点三
基础梳理
考点突破 高考微题组
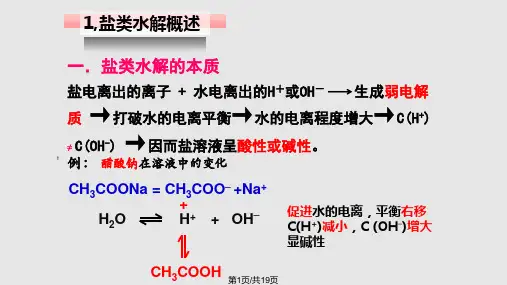
(4)盐类水解的规律: ①基本规律:难溶不水解,有弱才水解,无弱不水解;谁弱谁水解,越 弱越水解,都弱都水解;谁强显谁性(适用于正盐),同强显中性,弱弱 具体定;越热越水解,越稀越水解。(即盐的构成中有弱碱阳离子或 弱酸根阴离子,该盐就会水解;这些离子对应的碱或酸越弱,则水解 程度越大,溶液的pH变化越大;水解后溶液的酸碱性由构成该盐离 子对应的酸和碱的相对强弱决定,酸强显酸性,碱强显碱性。)
-11考点一 考点二 考点三
基础梳理
考点突破 高考微题组
(2)外因:
水解 水解 水解产生离 解释 平衡 程度 子的浓度 升高 水解反应为吸热反应, 升温平 右移 增大 增大 温度 衡右移, 水解程度增大 根据勒夏特列原理, 改变平衡 增大盐 体系中每一种物质的浓度, 都 右移 减小 增大 的浓度 可使平衡向着削弱这种改变的 方向移动 减小盐 的浓度 右移 增大 减小 盐的浓度越小, 水解程度越大 (即稀释) 因素