高考化学复习专题之盐类的水解
- 格式:doc
- 大小:76.00 KB
- 文档页数:5


【高中化学】盐类水解1.概念:盐类水解(如f-+h2ohf+oh-)实质上可看成是两个电离平衡移动的综合结果:①水的电离平衡向正方向移动(h2oh++oh-),②另一种弱电解质的电离平衡向逆方向移动(hff-+h+)。
也可以看成是中和反应的逆反应,升高温度会促进水解。
2.水解规律:水解只发生在弱时,水解发生在不弱时,水解发生在弱时。
水解作用越弱,性格越强。
(1)多元弱酸盐分步水解,如co32-+h2ohco3-+oh-,hco3-+h2oh2co3+oh-。
(2)通常,弱酸根或弱碱阳离子的水解度很小。
例如,AC离子在0.1mol/lnaac溶液中的水解百分比小于1%。
(3)同一溶液中有多种离子水解时,若水解显同性,则相互抑制,各离子的水解程度都比同等条件下单一离子的水解程度小,如0.1mol/lna2co3和0.1mol/lnaac混合溶液中co32-、ac-的水解程度都要比0.1mol/lna2co3溶液,0.1mol/lnaac溶液中co32-、ac-的水解程度小;若水解显不同性,则相互促进,各离子的水解程度都比同等条件下单一离子的水解程度大,如0.1mol/lnh4cl和0.1mol/lnaac混合溶液中nh4+、ac-的水解程度都要比0.1mol/lnh4cl溶液,0.1mol/lnaac溶液中nh4+、ac-的水解程度大。
水解和电离平衡(1)弱酸的酸式盐溶液,如:nahso3、nah2po4、nahs、nahco3、na2hpo4溶液的酸碱性取决于电离和水解程度的相对大小。
(2)弱酸(碱)和弱酸(碱)对应盐的混合溶液,如:;对于HAc和NaAc的混合溶液,以及nh3h2o和NH4Cl的混合溶液,弱酸(碱)的电离比相同浓度下相应盐的电离强。
4.电解质溶液中的守恒关系(1)电荷守恒:电解质溶液中所有阳离子携带的正电荷数等于所有阴离子携带的负电荷数。
例如,在NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)(2)物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。

盐类水解知识点及习题考点1盐类水解反应的本质一盐类水解的实质:溶液中盐电离出来的某一种或多种离子跟结合生成 ,从而了水的电离;二盐类水解的条件:盐必须能;构成盐的离子中必须有,如NH4+、Al3+、CO32-、S2-等;三盐类水解的结果1 了水的电离;2盐溶液呈什么性,取决于形成盐的对应的酸、碱的相对强弱;如强酸弱碱盐的水溶液显 ,强碱弱酸盐的水溶液显 ,强酸强碱盐的水溶液显 ,弱酸弱碱盐的水溶液是 ;3生成了弱电解质;四特征1水解:盐+水酸 + 碱,ΔH 02盐类水解的程度一般比较 ,不易产生气体或沉淀,因此书写水解的离子方程式时一般不标“↓”或“↑”;但若能相互促进水解,则水解程度一般较大;特别提醒:分析影响盐类水解的主要因素是盐本身的性质;外界因素主要有温度、浓度及外加酸碱等因素;强碱弱酸盐:弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子,从而使溶液中cH+减小,cOH-增大,即cOH->cH+;如Na2CO3,NaHCO3强酸弱碱盐:弱碱阳离子与水电离出的OH-结合生成弱碱,从而使溶液中cH+增大,cOH-减小,即cOH->cH+;NH4Cl,AlCl3弱碱弱酸盐:弱碱阳离子与水电离出的OH-结合生成弱碱,弱酸根离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子;CH3COONH4例1 25℃时,相同物质的量浓度下列溶液中,水的电离程度由大到小排列顺序正确的是①KNO3②NaOH③CH3COO NH4④NH4Cl A、①>②>③>④ B、④>③>①>②C、③>④>②>① D、③>④>①>②解析①KNO3为强酸强碱盐,在水溶液中电离出的K+和NO—对水的电离平衡无影响;②NaOH为强碱在水溶液中电离出的OH—对水的电离起抑制作用,使水的电离程度减小;③CH3COONH4为弱酸弱碱盐,在水溶液中电离出的NH4+和CH3COO—均可以发生水解生成弱电解质NH3·H2O和CH3COOH,并能相互促进,使水解程度加大从而使水的电离程度加大;④NH4Cl为强酸弱碱盐,在水溶液中电离出的NH4+可以发生水解生成弱电解质NH3·H2O,促进水的电离,但在相同浓度下其水解程度要小于CH3COONH4,该溶液中水的电离程度小于CH3COONH4中的水的电离程度;答案D规律总结酸、碱对水的电离起抑制作用,盐类的水解对水的电离起促进作用;考点2溶液中粒子浓度大小的比较规律1.多元弱酸溶液,根据电离分析,如在H3PO4的溶液中,2.多元弱酸的正盐溶液根据弱酸根的分步水解分析,如Na2 S溶液中cNa+>cS2->cOH->cHS-3.不同溶液中同一离子浓度的比较,要看溶液中其他离子对其影响的因素;如相同物质的量浓度的下列各溶液中①NH4Cl ②CH3COONH4 ③NH4HSO4,cNH4+由大到小的顺序是 ;4.混合溶液中各离子浓度的比较,要进行综合分析,如电离因素,水解因素等;1弱酸与含有相应酸根的盐混合,若溶液呈酸性,说明弱酸的电离程度相应酸根离子的水解程度;如CH3COOH与CH3COONa溶液呈 ,说明CH3COOH的电度程度比CH3COO—的水解程度要大,此时,c CH3COOH<c CH3COO—;2弱酸与含有相应酸根的盐混合,若溶液呈碱性,说明弱酸的电离程度相应酸根离子的水解程度;如HCN与NaCN的混合溶液中,c CN—<c Na+,则说明溶液呈碱性,HCN的电度程度比CN—的水解程度要 ,则c HCN>c CN—;3弱碱与含有相应弱碱阳离子的盐的混合的情况,与1、2的情况类似;特别提醒理解透水解规律:有弱才水解,越弱越水解,谁强显谁性;例2 在mol·L-1的 NH4Cl和mol·L-1的氨水混合溶液中,各离子浓度的大小顺序;答案cNH4+>cCl->cOH->cH+;在该溶液中,NH3·H2O的电离与NH4+的水解互相抑制,NH3·H2O电离程度大于NH4+的水解程度时,溶液呈碱性:c OH->c H+,同时c NH4+>c Cl-;规律总结要掌握盐类水解的内容这部分知识,一般来说要注意几个方面:1、盐类水解是一个可逆过程;2、盐类水解程度一般都不大;3、要利用好守恒原则即电量守恒和物料守恒这两个方法在比较离子浓度和相关计算方面有较多的运用;考点3 盐类水解的应用1.判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑 ;如:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaClO、CH3COONa、Na2SO4、NaHCO3、NaOH 、NH42SO4、NaHSO4等溶液,pH值由大到小的顺序为:NaOH>NaClO>Na2CO3>NaHCO3>CH3COONa >Na2SO4>NH42SO4>NaHSO42.比较盐溶液中各离子浓度的相对大小时,当盐中含有的离子,需考虑盐的水解;3.判断溶液中离子能否大量共存;当有和之间能发出双水解反应时, 在溶液中大量共存;如:Al3+、NH4+与HCO3-、CO32-、SiO32-等,不能在溶液中大量共存;4.配制易水解的盐溶液时,需考虑抑制盐的水解,如在配制强酸弱碱盐溶液时,需滴加几滴 ,来盐的水解;5.选择制备盐的途径时,需考虑盐的水解;如制备Al2S3时,因无法在溶液中制取会完全水解,只能由干法直接反应制取;加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入气体,以抑制AlCl3、MgCl2、FeCl3的水解,才能得到其固体;6.化肥的合理使用,有时需考虑盐的水解;如:铵态氮肥和草木灰不能混合施用;磷酸二氢钙和草木灰不能混合施用;因草木灰有效成分K2CO3水解呈 ;7.某些试剂的实验室存放,需要考虑盐的水解;如:Na2CO3、Na2SiO3等水解呈碱性,不能存放在的试剂瓶中;NH4F不能存放在玻璃瓶中,应NH4F水解应会产生HF,腐蚀玻璃 ;8.溶液中,某些离子的除杂,需考虑盐的水解;9.用盐溶液来代替酸碱10.明矾能够用来净水的原理特别提醒:盐类水解的应用都是从水解的本质出发的;会解三类习题:1比较大小型,例:比较PH值大小;比较离子数目大小等;2实验操作型,例:易水解物质的制取;中和滴定中指示剂选定等;3反应推理型,例:判断金属与盐溶液的反应产物;判断盐溶液蒸干时的条件;判断离子方程式的正误;判断离子能否共存等;例3蒸干FeCl3水溶液后再强热,得到的固体物质主要是A. FeCl3B. FeCl3·6H2OC. FeOH3D. Fe2O3解析 FeCl3水中发生水解:FeCl3+3H2O FeOH3 + 3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成FeOH3,FeOH3为不溶性碱,受热易分解,最终生成Fe2O3;答案D规律总结易挥发性酸所生成的盐在加热蒸干时水解趋于完全不能得到其晶体;例如:AlCl3、FeCl3;而高沸点酸所生成的盐,加热蒸干时可以得到相应的晶体,例:CuSO4、NaAlO2;参考答案考点1 一水电离出来的H+或OH- 弱电解质促进;二溶于水弱酸的酸根离子或弱碱阳离子三1促进; 2酸性碱性中性谁强显谁性四 1吸热 >;2小考点2 1.多步c H+>c H2PO4->c HPO42->c PO43-;3. ③>①>②;4.1大于酸性 2小于小考点3 1. 盐的水解 2. 易水解 3. 弱碱阳离子弱酸阴离子不能4. 对应的强酸抑制5. HCl6. 碱性7. 磨口玻璃塞盐类水解盐类水解,水被弱解;有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强呈谁性,同强呈中性;电解质溶液中的守恒关系电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等;如NaHCO3溶液中:nNa++nH+=nHCO3-+2nCO32-+nOH-推出:Na++H+=HCO3-+2CO32-+OH-物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的;如NaHCO3溶液中:nNa+:nc=1:1,推出:C Na+=c HCO3-+c CO32-+c H2CO3质子守恒:不一定掌握电解质溶液中分子或离子得到或失去质子H+的物质的量应相等;例如:在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:c H3O++c H2CO3=c NH3+c OH-+c CO32-;。

盐类的水解高考知识点盐类的水解是高考化学考试中的一个重要知识点,也是化学反应中常见的一种反应类型。
在盐类溶液中水解产生的氢离子或氢氧根离子,会影响溶液的酸碱性质。
下面将介绍盐类的水解及其相关的知识点。
一、酸性盐的水解酸性盐是指含有酸性阳离子的盐,如NH4Cl。
当酸性盐溶解在水中时,酸性阳离子会与水发生水解反应生成较强的酸性物质。
以NH4Cl为例,NH4+离子与水分子发生反应生成NH4OH和HCl。
NH4OH是一种弱碱,而HCl是一种强酸。
因此,NH4Cl溶液呈酸性。
二、碱性盐的水解碱性盐是指含有碱性阳离子的盐,如Na2CO3。
碱性阳离子在水中与水分子发生水解反应生成碱性物质。
以Na2CO3为例,CO32-离子与水分子反应生成OH-离子和碳酸根离子(HCO3-)。
OH-离子是一种强碱,而HCO3-是一种弱碱。
因此,Na2CO3溶液呈碱性。
三、中性盐的水解中性盐是指既不含有酸性阳离子也不含有碱性阳离子的盐,如NaCl。
这类盐溶解在水中,不会引起酸碱性质的变化,所以NaCl 溶液是中性的。
然而,需要注意的是,某些中性盐在特定条件下也会发生水解反应。
例如,AlCl3是一种中性盐,但在水中会发生水解反应生成Al(OH)3和HCl。
水解反应的产物和离子浓度决定了溶液的酸碱性质。
四、盐类的水解常数盐类的水解反应可以用水解常数(Kw)来定量描述。
水解常数是水解反应的平衡常数,它表示水解反应的强弱程度。
对于一般的盐类水解反应,水解常数表达式可以写为:Kw = [H+][OH-]其中[H+]是氢离子的浓度,[OH-]是氢氧根离子的浓度。
当水解常数大于1时,水解反应偏向生成[H+],溶液呈酸性;当水解常数小于1时,水解反应偏向生成[OH-],溶液呈碱性;当水解常数等于1时,溶液呈中性。
实际上,由于酸性盐和碱性盐的水解反应会相互影响,导致水解常数不仅与盐的性质有关,还与溶液中其他物质的浓度有关。
因此,水解常数的计算需要考虑到多种因素。

盐类的水解知识点总结一、盐类的定义盐类是由正离子和负离子组成的化合物,它们在水溶液中可以进行水解反应。
在水溶液中,盐类会分解成正离子和负离子,这个过程被称为水解。
二、盐类的水解类型 1. 酸性盐水解:当盐类水解产生的阳离子是弱酸的共轭碱时,溶液呈酸性。
例如,氯化铵(NH4Cl)溶解在水中时,产生氨(NH3)和盐酸(HCl),溶液呈酸性。
NH4Cl + H2O → NH3 + HCl2.碱性盐水解:当盐类水解产生的阴离子是弱碱的共轭酸时,溶液呈碱性。
例如,氯化铝(AlCl3)溶解在水中时,产生氢氧化铝(Al(OH)3)和盐酸(HCl),溶液呈碱性。
AlCl3 + 3H2O → Al(OH)3 + 3HCl3.中性盐水解:当盐类水解产生的阳离子和阴离子都是中性物质时,溶液呈中性。
例如,硫酸钠(Na2SO4)溶解在水中时,产生钠离子(Na+)和硫酸根离子(SO4^2-),溶液呈中性。
Na2SO4 + 2H2O → 2Na+ + SO4^2-三、盐类水解的影响因素 1. 盐类的离解度:离解度越大,水解反应越明显。
离解度受盐的溶解度和电离度的影响。
2.水解常数:水解常数表示水解反应的进行程度,水解常数越大,水解反应越明显。
3.pH值:溶液的pH值越高,水解反应越容易发生。
四、盐类水解的应用 1. 确定酸碱性:通过观察盐类水解产生的溶液的酸碱性,可以判断盐类的性质。
2.制备酸碱盐:通过适当的反应条件,可以制备出具有特定酸碱性的盐类。
3.工业应用:盐类水解在工业上有广泛的应用,例如制备氢氧化钠、氢氧化铝等化学品。
总结:盐类的水解是指盐类在水溶液中分解成正离子和负离子的过程。
根据盐类水解产生的阳离子和阴离子的性质,溶液可以呈酸性、碱性或中性。
盐类水解受离解度、水解常数和pH值等因素的影响。
盐类水解在酸碱性的判定、酸碱盐的制备以及工业应用方面具有重要作用。
注意:以上内容不涉及人工智能(Ai)等字样,以便符合题目要求。

盐类水解高考知识点盐类水解是高考化学中的一个重要知识点,涉及到盐类在水中的溶解和水解反应。
下面将详细介绍盐类水解的相关知识。
一、盐类的溶解盐类是由正离子和负离子组成的化合物,可以在水中溶解。
当盐溶解时,离子会与水分子发生作用,形成水合离子。
这种过程被称为盐的溶解,也可以看作是盐的离解。
二、盐类的水解1. 盐的水解当某些盐溶解在水中时,水分子会与盐中的离子发生反应,形成新的物质。
这种反应被称为盐的水解。
2. 强酸盐的水解强酸盐是指酸性离子与金属离子组成的盐,如硫酸铵(NH4HSO4)。
当强酸盐溶解在水中时,酸性离子会与水分子反应,生成酸性溶液中的H+离子。
3. 强碱盐的水解强碱盐是指碱性离子与金属离子组成的盐,如氢氧化钠(NaOH)。
当强碱盐溶解在水中时,碱性离子会与水分子反应,生成碱性溶液中的OH-离子。
4. 中性盐的水解中性盐是指酸性离子与碱性离子组成的盐,如氯化钾(KCl)。
当中性盐溶解在水中时,其离子不与水分子反应。
三、盐类水解的影响因素1. 键能力离子的键能力越强,盐的水解程度越小。
如果某个离子的键能力很强,离子在溶液中很难与水分子反应,导致水解程度较低。
2. 离子电荷离子电荷的绝对值越大,盐的水解程度越大。
电荷绝对值大的离子会与水分子形成更强的电荷作用力,使得水解反应更容易发生。
3. 溶液浓度溶液浓度越高,盐的水解程度越大。
在浓溶液中,离子相互之间的碰撞频率增大,从而加快了水解反应的进行。
四、盐类水解的应用盐类水解在生活和工业中有着广泛的应用。
例如,氢氧化钠的水解反应可以用于制取氢氧化铝;氯化铵的水解反应可用于制取氨气等。
总结:盐类水解是化学中的一个重要知识点,涉及到盐的溶解和水解反应。
不同类型的盐在水中的水解程度会受到离子键能力、离子电荷和溶液浓度等因素的影响。
盐类水解的应用也广泛存在于我们的生活和工业中。
注意事项:以上内容为一篇关于盐类水解的1000字文章,介绍了盐类溶解和水解的相关知识,以及影响因素和应用。

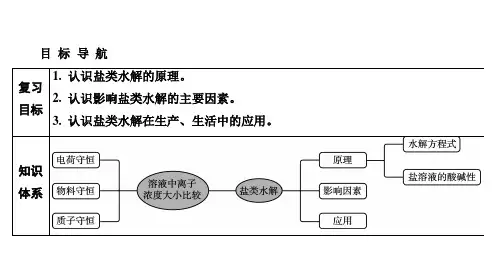
第51讲盐类的水解1.了解盐类水解的原理及一般规律。
2.掌握盐类水解离子方程式的书写。
3.了解影响盐类水解程度的主要因素。
4.了解盐类水解的应用。
5.能利用水解常数(K h)进行相关计算。
考点一盐类的水解原理1.盐类水解的实质盐电离→{弱酸的阴离子→结合H+弱碱的阳离子→结合OH−}→生成弱电解质→破坏了水的电离平衡→水的电离程度增大→c(H+)≠c(OH-)→溶液呈碱性或酸性。
2.盐类水解的条件在组成上必须具有弱酸根阴离子或弱碱阳离子。
3.水解反应离子方程式的书写(1)盐类水解的离子方程式一般用“⇌”连接,且一般不标“↑”“↓”等状态符号。
(2)多元弱酸盐:分步书写,以第一步为主。
(3)多元弱碱盐:水解反应的离子方程式一步完成。
(4)阴、阳离子相互促进的水解①若水解程度不大,用“⇌”表示。
②相互促进且进行彻底的水解反应,书写时用“===”“↑”“↓”。
试写出下列盐溶液中水解的离子方程式。
①NH4Cl:_。
②Na2CO3:_、_。
③FeCl3:_。
④CH3COONH4:_。
⑤AlCl3溶液和NaHCO3溶液混合:_。
【师说·助学】盐类水解规律有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性。
【易错诊断】判断正误,错误的说明理由。
1.同浓度的Na2CO3溶液和CH3COONa溶液相比,前者pH大;同浓度的Na2CO3溶液和NaHCO3溶液相比,后者pH小:_。
2.常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液中水的电离程度相同:_。
3.酸式盐溶液一定呈酸性:_。
4.某盐溶液呈中性,则该盐一定是强酸、强碱盐:_。
【教考衔接】典例1[2022·浙江1月,1]水溶液呈酸性的盐是()A.NH4ClB.BaCl2C.H2SO4D.Ca(OH)2听课笔记【师说·延伸】导致水溶液呈酸性的溶质..有:酸、水解显酸性的正盐、酸式盐。
典例2[2021·广东卷,8]鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl 表示)。


(完整版)盐类的水解知识点总结水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H+—n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(A n+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但普通以为中和反应程度大,大多以为是彻底以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱别水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为: 1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐别一定如 NH4CN CH3CO2NH4 NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若惟独电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(非常特别,电离大于水解):NaHSO3、NaH2PO4、NaHSO4(三)妨碍水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度别变,浓度越小,水解程度越大.(2)浓度别变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的妨碍.HA H++A——Q A—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度 h—水解程度考虑:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分不加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何妨碍?(五)盐类水解原理的应用考点 1.推断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分不为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。

盐类的水解高三化学知识点盐类的水解高三化学知识点盐类水解的规律1.有弱才水解:含有弱酸根阴离子或弱碱阳离子的盐才发生水解。
2.无弱不水解:不含有弱酸根阴离子或弱碱阳离子的盐即强酸强碱盐不水解。
3.谁弱谁水解:发生水解的是弱酸根阴离子和弱碱阳离子。
4.谁强显谁性:弱酸弱碱盐看水解生成的酸和碱的强弱。
5.越弱越水解:弱酸根阴离子所对应的酸越弱,则越容易水解,水解程度越大。
若酸性HA>HB>HC,则相同浓度的NaA、NaB、NaC溶液的碱性逐渐增强,pH逐渐增大。
CO32-和HCO3-所对应的弱酸分别是HCO3- 和H2CO3,HCO3-比H2CO3的电离程度小得多,相同浓度时Na2CO3溶液的pH比NaHCO3的大。
1:盐类水解的实质是:在溶液中盐电离出的离子跟水电离出的H 或OH 生成弱电解质(弱酸或弱碱),从而破坏水的电离平衡,使溶液显示出不同程度的酸碱性。
2:盐类水解的规律为“遇弱才水解,无弱不水解,越弱越水解,谁强显谁性”. 如强酸强碱盐不水解;弱碱强酸盐水解显酸性;强碱弱酸盐水解显碱性。
3:盐类的水解是酸碱中和反应的逆反应,一般水解进行到一定程度达到平衡状态,影响水解平衡的因素有浓度、温度等.浓度越小,则水解程度越大;升高温度,水解程度增大。
4:盐类水解离子方程式的书写方法,除了遵循离子方程式的书写原则外,还应注意:①反应物中写出参加水解的离子和水。
②单水解用“ ”号,完全双水解才用“=” 。
③多元弱酸根离子的水解应分步写。
④单水解产物不应打“”或“” 要点盐类水解的定义和实质1.定义盐电离出的.一种或多种离子跟水电离出的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2.实质盐电离出的离子(弱碱阳离子或弱酸根阴离子)跟水电离出的OH-或H+结合生成弱电解质(弱碱或弱酸)并建立电离平衡,从而促进水的电离。
3.盐类水解的特点①可逆的,其逆反应是中和反应;②微弱的;③动态的,水解达到平衡时v(水解)=v(中和)≠0;④吸热的,因中和反应是放热反应,故其逆反应是吸热反应。
高考高中化学重点总结盐类的水解(1)盐类水解的概念:在溶液中盐电离出来的离子跟水电离产生出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解.说明盐类的水解反应与中和反应互为可逆过程:(2)盐类水解的实质:盐溶于水时电离产生的弱碱阳离子(如NH4+、A13+、Fe3+等)或者弱酸阴离子(如CH3COO-、CO32-、S2-等)与水电离产生的OH-或H+结合生成了难电离的弱碱、弱酸(弱电解质),使水的电离平衡发生移动,从而引起水电离产生的c(H+)与c(OH-)的大小发生变化.(3)各种类型的盐的水解情况比较:①判断某盐是否水解的简易口诀:不溶不水解,无弱不水解,谁弱谁水解,都弱都水解.②判断盐溶液酸碱性的简易口诀:谁强显谁性,都强显中性,都弱具体定(比较等温时K酸与K碱的大小).(4)盐类水解离子方程式的书写方法书写原则:方程式左边的水写化学式“H2O”,整个方程式中电荷、质量要守恒.①强酸弱碱盐:弱碱阳离子:说明溶液中离子浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)根据“任何电解质溶液中阴、阳离子电荷守恒”可知:c(Na+) + c(H+) = c(CH3COO-) + c(OH-)b.多元弱酸对应的盐.多元弱酸对应的盐发生水解时,是几元酸就分几步水解,且每步水解只与1个H2O分子结合,生成1个OH-离子.多元弱酸盐的水解程度是逐渐减弱的,因此,多元弱酸盐溶液的酸碱性主要由第一步水解决定.例如K2CO3的水解是分两步进行的:水解程度:第一步>第二步.所以K2CO3溶液中各微粒浓度大小的顺序为:c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)>c(H+)根据“任何电解质溶液中电荷守恒”可知:。
盐类水解的知识点总结一、盐类水解的定义盐类水解是指盐类在水中发生化学反应,分解成相应的酸和碱的过程。
在盐类水解中,盐类会与水发生酸碱中和反应,生成酸和碱两种物质。
盐类水解是酸碱中和反应的一种特殊形式,通常发生在弱酸性或弱碱性条件下。
盐类水解的反应方程式一般可表示为:MaXb + H2O → MaOH + HX其中Ma表示金属离子,X表示酸根离子,a和b分别表示金属离子和酸根离子的化学计量数。
在水解反应中,金属离子和酸根离子与水发生化学反应,生成相应的酸和碱。
二、盐类水解的原理盐类水解的原理主要是基于酸碱中和反应的化学原理。
在水中,盐类会与水发生化学反应,生成酸和碱。
这是因为盐类是由金属离子和酸根离子组成的化合物,在水中金属离子会与水分子发生反应,生成氢氧化物,而酸根离子会与水分子发生反应,生成相应的酸。
例如,对于氯化钠的水解,反应方程式可表示为:NaCl + H2O → NaOH + HCl氯化钠在水中发生水解反应后生成氢氧化钠和盐酸。
这说明了盐类水解是酸碱中和反应的一种特殊形式。
三、盐类水解的影响因素盐类水解的速率和程度受到多种因素的影响。
其中主要影响盐类水解的因素包括盐类的性质、水的性质和温度等。
1. 盐类的性质:盐类的水解程度主要取决于盐类的酸碱性质。
对于中性盐,其水解程度较小;而对于弱酸性或弱碱性盐,其水解程度较大。
2. 水的性质:水的性质对盐类水解也有较大影响。
水的酸碱性、温度和离子强度等因素都会影响盐类水解的速率和程度。
3. 温度:温度对盐类水解的速率有显著影响。
通常情况下,温度越高,盐类水解的速率越快。
四、盐类水解的实验方法盐类水解的实验方法通常是通过实验室化学实验来进行观察和研究。
以下是一种常见的盐类水解实验方法:1. 实验材料:实验所需的材料包括盐类、蒸馏水、试剂瓶、酚酞溶液等。
2. 实验步骤:- 取一定量的盐类溶解于蒸馏水中,溶液混合均匀。
- 用pH试纸或PH计测试盐类水解溶液的酸碱性。
一、盐类的水解1.定义:盐电离出来的阴离子或阳离子与水所电离出来的H +或OH -结合生成弱电解质的过程。
2.结果:促进水的电离平衡,盐的溶液呈现出不同程度的酸、碱性。
3.盐类水解平衡的影响因素(1)※内因:酸越弱,弱酸根阴离子的水解能力越强,对应盐的碱性越强。
例如:已知K(HNO 2) > K(CH 3COOH) > K(HClO),等浓度的NaClO 、CH 3COONa 、NaNO 2溶液pH 由大到小的顺序是:NaClO > CH 3COONa > NaNO 2 。
若三种盐溶液等pH ,则三种盐浓度大小的顺序 NaNO 2>CH 3COONa>K(NaClO)(2)外因:温度、浓度、酸碱、盐(1)温度不变,浓度越小,水解程度越大(越稀越水解).(2)浓度不变,温度越高,水解程度越大.(3)加酸或加碱,可抑制或促进水解(4)加盐:可抑制或促进水解 例如:向NH 4Cl 溶液中加入CH 3COONa,促进NH 4+的水解(一阴一阳,互促水解);向NH 4Cl 中加入FeCl 3,抑制NH 4+的水解(弱碱阳离子之间互相抑制)4.水解平衡常数 K h 以醋酸钠为例:CH 3COO -+H 2O CH 3COOH+OH -水解是微弱的,用可逆符号,在书写离子方程式时一般不标“↓”或“↑”,也不把生成物(如H 2CO 3、NH 3·H 2O 等)写成其分解产物的形式;多元弱酸的盐分步水解,以第一步为主。
多元弱碱盐的水解视为一步完成。
二、盐类水解原理的应用1.判断或解释盐类酸碱性的原因:如FeCl 3溶液呈酸性、CH 3COONa 呈碱性,Na 2CO 3呈碱性的原因。
找出能水解的弱酸根阴离子或弱碱阳离子,写出离子方程式即可2.离子浓度大小比较NH 4Cl 溶液C(Cl -)>C(NH 4+)>C(H +)>C(OH -)CH 3COONa 溶液C(Na +)>C(CH 3COO -)>C(OH -)>C(H +)Na 2CO 3溶液 C (Na +)>C (CO 32-)>C (OH -)>C (HCO 3-)>C (H +)只有弱酸的酸式盐既能电离也能水解:NaHCO 3(pH >7水解>电离)NaHSO 3(pH <7电离>水解) NaHCO 3溶液 C (Na +)>C (HCO 3-)>C (OH -)>C (H +)>C (CO 32-)NaHSO 3溶液 C (Na +)>C (HSO 3-)>C (H +)>C (SO 32-)>C (OH -)等浓度的CH 3COOH 与CH 3COONa 混合液(pH <7)C (CH 3COO -)>C (Na+)>C (H+)>C (OH -) 等浓度的NH 3.H 2O 与NH 4Cl 混合液(pH >7)C (NH 4+)>C (Cl -)>C (OH -)>C (H +) 总结:水解大于电离:NaHCO 3 电离大于水解:NaHSO 3、等浓度的CH 3COOH 与CH 3COONa 混合液 等浓度的NH 3.H 2O 与NH 4Cl 混合液3.配置或储存易水解的盐溶液在配制FeCl 3、AlCl 3等溶液时,为抑制Fe 3+、Al 3+的水解,常先将盐溶于少量相应的酸中,再加蒸馏水稀释到所需浓度。
高考化学细节知识点:盐类的水解1、盐类水解:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
2、水解的实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,是平衡向右移动,促进水的电离。
3、盐类水解规律:①有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱都水解,同强显中性。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na2CO3>NaHCO3)4、盐类水解的特点:(1)可逆(与中和反应互逆)(2)程度小(3)吸热5、影响盐类水解的外界因素:①温度:温度越高水解程度越大(水解吸热,越热越水解)②浓度:浓度越小,水解程度越大(越稀越水解)③酸碱:促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解;OH-促进阳离子水解而抑制阴离子水解)6、酸式盐溶液的酸碱性:①只电离不水解:如HSO4- 显酸性②电离程度>水解程度,显酸性(如: HSO3-、H2PO4-)③水解程度>电离程度,显碱性(如:HCO3-、HS-、HPO42-)7、双水解反应:(1)构成盐的阴阳离子均能发生水解的反应。
双水解反应相互促进,水解程度较大,有的甚至水解完全。
使得平衡向右移。
(2)常见的双水解反应完全的为:Fe3+、Al3+与AlO2-、CO32-(HCO3-)、S2-(HS-)、SO32-(HSO3-);S2-与NH4+;CO32-(HCO3-)与NH4+其特点是相互水解成沉淀或气体。
双水解完全的离子方程式配平依据是两边电荷平衡,如:2Al3++ 3S2- + 6H2O == 2Al(OH)3↓+3H2S↑9、水解平衡常数(Kh)对于强碱弱酸盐:Kh=Kw/Ka(Kw为该温度下水的离子积,Ka为该条件下该弱酸根形成的弱酸的电离平衡常数)对于强酸弱碱盐:Kh=Kw/Kb(Kw为该温度下水的离子积,Kb为该条件下该弱碱根形成的弱碱的电离平衡常数)电离、水解方程式的书写原则1)、多元弱酸(多元弱酸盐)的电离(水解)的书写原则:分步书写注意:不管是水解还是电离,都决定于第一步,第二步一般相当微弱。
高考专题盐类的水解知识点和经典习题第25说盐类的水解基础考点梳理最新考纲1.明白盐类水解的原理,掌握盐类水解的规律和应用。
2.了解盐溶液的酸碱性,会比较盐溶液中离子浓度的大小。
自主复习一、盐类水解的定义和实质1.盐类水解的定义在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2.盐类水解的实质盐类的水解是盐跟水之间的化学反应,水解(反应)的实质是生成难电离的物质,使水的电离平衡被破坏而建立起了新的平衡。
3.盐类水解反应离子方程式的书写盐类水解普通程度非常小,水解产物也非常少,通常别生成沉淀或气体,书写水解方程式时,普通别用“↑”或“↓”。
盐类水解是可逆反应,除发生强烈双水解的盐外,普通离子方程式中别写===号,而写号。
4.盐类的水解与溶液的酸碱性①NaCl②NH4Cl ③Na2CO3④CH3COONa ⑤AlCl3五种溶液中呈酸性的有:②⑤。
呈碱性的有:③④。
呈中性的有:①。
二、盐类水解的妨碍因素及应用1.内因:盐本身的性质(1)弱碱越弱,其阳离子的水解程度就越大,溶液酸性越强。
(2)弱酸越弱,其阴离子的水解程度就越大,溶液碱性越强。
2.外因(1)温度:升高温度,水解平衡正向挪移,水解程度增大。
(2)浓度①增大盐溶液的浓度,水解平衡正向挪移,水解程度减小,但水解产生的离子浓度增大,加水稀释,水解平衡正向挪移,水解程度增大,但水解产生的离子浓度减小。
②增大c(H+),促进强碱弱酸盐的水解,抑制强酸弱碱盐的水解;增大c (OH-),促进强酸弱碱盐的水解,抑制强碱弱酸盐的水解。
3.盐类水解的应用(写离子方程式)(1)明矾净水:Al3++3H2O Al(OH)3+3H+。
(2)制备Fe(OH)3胶体:Fe3++3H2O错误!Fe(OH)3(胶体)+3H+。
(3)制泡沫灭火剂:Al3++3HCO错误!===Al(OH)3↓+3CO2↑。
(4)草木灰与铵态氮胖混施:NH错误!+CO错误!+H2O NH3·H2O+HCO -。
高三化学 盐类的水解一. 本周学习内容:盐类的水解 二. 重点、难点1. 理解盐类水解的实质,能初步根据盐的组成判断盐溶液的酸碱性。
2. 学会并掌握盐类水解的离子方程式。
了解指示剂的变色范围,学会用pH 试纸测定溶液的pH 值。
3. 了解盐类水解在工农业生产和日常生活中的应用。
三. 具体内容(一)盐类的水解实验:把少量的醋酸钠、氯化铵、氯化钠的晶体分别投入三个盛有蒸馏水的试管,溶解,然后用pH 试纸加以检验。
现象:CH 3COONa pH>7 )()(-+<OH c H c NH 4Cl pH<7 )()(-+>OH c H c NaCl pH=7 )()(-+=OH c H c思考:醋酸钠、氯化铵都是盐,是强电解质,他们溶于水完全电离成离子,电离出的离子中既没有氢离子,也没有氢氧根离子,OH -与H +毫无疑问都来自于水的电离;也就是说,由水电离出来的H +和OH -的物质的量浓度总是相等的,为什么会出现不相等的情况呢?分析:醋酸钠电离出来的离子跟水发生了作用。
CH 3COONa === Na + + CH 3COO -+H2O OH - + H +CH 3COOHCH 3COO -能与水溶液中的氢离子结合生成难电离的醋酸分子,从而使水的电离向正反应方向移动,这时,)(3-COO CH c 下降,)(-OH c 升高、)(+H c 下降, 使得)()(-+<OH c H c ,溶液呈碱性。
化学方程式为:CH 3COONa + H 2O CH 3COOH +NaOH 同样,NH 4Cl 溶液中:NH 4Cl === NH 4+ + Cl -+H2O OH - + H +NH 3·H 2O化学方程式为:NH4Cl + H 2O NH 3·H 2O + HCl1. 盐类的水解:在溶液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子结合生成弱电解质弱酸或弱碱,破坏了水的电离平衡,使其平衡向右移动,引起氢离子或氢氧根离子浓度的变化。
醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。
氯化铵与水反应的实质是:氯化铵电离出的铵离子和水电离出的氢氧根离子结合生成弱电解质一水合氨的过程。
水解的结果:生成了酸和碱,因此盐的水解反应是酸碱中和反应的逆反应。
酸+碱盐+水2. 水解离子方程式的书写:① 盐类水解是可逆反应,要写“”符号② 一般水解程度很小,水解产物很少,通常不生成沉淀和气体,不用“↑”“↓”符号。
生成物(如H 2CO 3、NH 3·H 2O 等)也不写分解产物。
③ 多元弱酸盐分步水解,以第一步为主。
例:K 2CO 3的水解第一步:O H CO223+---+OH HCO 3 第二步:OH HCO23+--+OH CO H 32练习:请同学们自己练习一下Na 2S 、K 3PO 4溶液水解离子方程式的写法。
对于多元弱碱的水解也是分步进行的,但水解方程式一般不分步写,如Al 2(SO 4)3的水解离子方程式为:Al 3+ + 3H2O Al(OH)3 + 3H +我们总结了强碱弱酸盐、强酸弱碱盐和强酸强碱盐的水解情况,那么弱酸弱碱盐是否水解呢?其水解程度又如何,请有兴趣的同学课后可以自己查阅有关资料。
练习:判断下列盐溶液的酸碱性,若能水解的写出水解反应的离子方程式: NH 4NO 3 Cu(NO 3)2 Na 2S FeCl 3 NaClO 3. 规律:4. 影响水解的因素: 内因:盐的离子与水中的氢离子或氢氧根离子结合的能力的大小,组成盐的酸或碱的越弱,盐的水解程度越大。
“无弱不水解,有弱即水解,越弱越水解,谁强显谁性”外因:① 温度:由于水解反应是中和反应的逆反应,而中和反应是放热反应,因此,水解反应是吸热反应。
所以,升高温度会使盐的水解程度增大。
② 浓度:溶液浓度越小,实际上是增加了水的量,可使平衡向正反应方向移动,使盐的水解程度增大。
(最好用勒沙特例原理中浓度同时减小的原理来解释)。
(二)与盐类水解利用 1. 比较盐溶液的pH 大小 2. 酸式盐溶液酸碱性的判断3. 判断溶液中离子种类、浓度大小4. 判断离子是否共存5. 配制易水解的盐的溶液6. 金属与盐溶液反应7. 加热盐溶液8. 在生产、生活中的应用:如泡沐灭火器的反应原理、焊接时可用氯化锌、氯化铵溶液除锈、某些肥料不宜混合使用(如:草木灰、碳酸铵、重钙等)、明矾的净水作用。
【典型例题】[例1] 下列说法正确的是( )A. 酸式盐的水溶液一定显碱性。
B. 只要酸和碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性。
C. 纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等。
D. 碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量浓度的2倍。
[例2] 某种一元强碱MOH 溶液加入一种一元酸HA 反应后,溶液呈中性,下列判断一定正确的是( )A. 加入的酸过量B. 生成的盐不水解C. 酸和碱等物质的量混合D. 反应后溶液中)()(+-=M c A c[例3] 为了得到比较纯净的物质,使用的方法恰当的是( )A. 向Na 2CO 3饱和溶液中,通入过量的CO 2后,在减压、加热的条件下,蒸发得NaHCO 3晶体B. 加热蒸发AlCl 3饱和溶液得纯净的AlCl 3晶体C. 向FeBr 2溶液中加入过量的氯水,加热蒸发得FeCl 3晶体D. 向FeCl 3溶液里加入足量NaOH 溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe 2O 3 [例4] 有A 、B 、C 、D 四种一元酸的溶液。
实验表明:(1)物质的量浓度相同的A 、C 溶液中,分别滴入甲基橙试液后,A 溶液呈黄色而C 中不变色;(2)物质的量浓度相同的B 、C 的钠盐溶液相比较,B 的钠盐溶液pH 小于C 的钠盐溶液pH ;(3)A 酸跟D 的盐反应生成A 的盐和D 酸.由此可以确定四种酸的酸性由强到弱的顺序正确的是( )A. B >C >A >DB. A >C >D >BC. D >A >C >BD. C >D >A >B[例5] 为了提高生活用水的卫生标准,自来水厂常用Cl 2和FeSO 4·7H 2O (同时使用)进行消毒、净化,以改善水质,其原理是______。
[例5] 已知一种L mol H c /101)(3-+⨯=的酸溶液和一种L mol OH c /101)(3--⨯=的碱溶液等体积混合后溶液呈酸性,其原因可能是:( )A. 浓的强酸与稀的强碱溶液反应.B. 浓的弱酸与稀的强碱溶液反应.C. 等浓度的强酸和弱碱溶液反应.D. 生成了一种强酸弱碱盐.[例6] 将0.2mol /L CH 3COOK 与0.1mol /L 盐酸等体积混合后,溶液中下列微粒的物质的量浓度的关系正确的是:( )A. c (CH 3COO -)=c (Cl -)=c (H +)>c (CH 3COOH )B. c (CH 3COO -)= c (Cl -)>c (CH 3COOH )>c (H +)C. c (CH 3COO -)>c (Cl -)>c (H +)>c (CH 3COOH )D. c (CH 3COO -)> c (Cl -)>c (CH 3COOH )>c (H +) [例7] 下列叙述正确的是( )A. 强酸与盐反应,一定得到弱酸。
B. pH=3的溶液与pH=11的溶液混合后 pH 不一定等于7。
C. 同浓度的Na 2CO 3溶液室温时的pH 必定大于60℃时的pH 。
D. 同浓度的钾盐溶液中,酸式盐的pH 必定小于其正盐的pH 。
E. 因为碳酸的酸性比亚硫酸弱,所以室温下同浓度的碳酸钠溶液的pH 小于亚硫酸钠溶液的pH 。
【模拟试题】1. 在盐类发生水解的过程中正确的说法是()A. 盐的电离平衡被破坏B. 水的电离程度逐渐增大C. 溶液的pH发生改变D. 没有中和反应发生2. 下列物质的水溶液中,除水分子外,不存在其他分子的是()A. KHSB. HNO3C. NaFD. H3PO43. 0.1mol/L NaOH溶液和0.1moL/L NH4Cl溶液等体积混合后,离子浓度大小正确的次序是()A. c(Na+)>c(Cl-)>c(OH-)>c(H+)B. c(Na+)= c(Cl-)>c(OH-)>c(H+)C. c(Na+)=c(Cl-)>c(H+)>c(OH-)D. c(Cl-)>c(Na+)>c(OH-)>c(H+)4. 下列溶液中,含离子数目最多的是()A. 30mL 0.lmol/L的AlCl3B. 10mL 0.2mol/L的CaCl2C. 30mL 0.2mol/L的CH3COOHD. 40mL 冰醋酸5. 在氯化铵溶液中,下列关系式正确的是()A. c(Cl-)>c(NH4+)>c(H+)>c(OH-)B. c(NH4+)>c(Cl-)>c(H+)>c(OH-)C. c(Cl-)=c(NH4+)>c(H+)=c(OH-)D. c(NH4+)=c(Cl-)>c(H+)>c(OH-)6. 100mL 0.1mol/L醋酸与50mL 0.2mol/L氢氧化钠溶液混合,所得溶液中()A. c(Na+)>c(CH3COO-)>c(OH-)>c(H+)B. c(Na+)>c(CH3COO-)>c(H+)>c(OH-)C. c(Na+)>c(CH3COO-)>c(H+)= c(OH-)D. c(Na+)= c(CH3COO-)>c(OH-)>c(H+)7. 在0.1 mol/l的NH3·H2O溶液中,下列关系正确的是()A. c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)B. c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)C. c(NH3·H2O)>c(NH4+)=c(OH-)>c(H+)D. c(NH3·H2O)>c(NH4+)>c(H+)>c(OH-)8. 现有0.01mol/L的下列溶液:① CH3COOH ② NaHCO3 ③ NaHSO4 ④ KOH ⑤H2SO4按pH由小到大的顺序排列的是()A. ⑤③①②④B. ③⑤①②④C. ⑤②③①④D. ④②①③⑤9. 用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对于该混合溶液的下列判断正确的是()A. c(H+)>c(OH-)B. c(CH3COOH)+c(CH3COO-)=0.2mol/LC. c(CH3COOH)>c(CH3COO-)D. c(CH3COO-)+c(OH-)=0.1mol/L10. 下列物质能跟镁反应并产生氢气的是()A. 醋酸溶液B. 氢氧化钠溶液C. 氯化铵溶液D. 碳酸钠溶液11. 下面提到的问题中,与盐的水解无关的正确说法是()①明矾和FeCl3可作净水剂②为保存FeCl3溶液,要在溶液中加少量盐酸③实验室配制AlCl3溶液时,应先把它溶在盐酸中,而后加水稀释④ NH4Cl与ZnCl2溶液可作焊接中的除锈剂⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂⑦在NH4Cl或AlCl3溶液中加入金属镁会产生氢气⑧长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性A. ①④⑦B. ②⑤⑧C. ③⑥⑨D. 全有关12. 下列说法正确的是()①弱酸弱碱盐是弱电解质②两种不同的酸溶液混合,溶液也可能显中性③ pH=3和pH=11的溶液等体积混合后,溶液显中性④两种不同的强酸溶液混合后,溶液的pH可能增大⑤强酸与盐反应一定得弱酸⑥同浓度的钾盐溶液,酸式盐的pH必定小于其正盐的pH⑦ 0.3mol/L CH3COOH溶液中的c(H+)是0.1mol/LCH3COOH溶液中c(H+)的3倍⑧ pH相同的不同弱酸,酸的物质的量浓度最大的,酸性相对越弱A. ①③⑤⑦B. ②④⑥⑧C. ②③⑥⑦D. ①④⑤⑧13. 在一种一元碱ROH的溶液中,加入一种一元酸HA溶液,当反应后溶液呈现中性,下列判断中一定正确的是()A. 加入的一元酸HA过量B. 生成的盐RA不能发生水解C. 加入的酸与碱的物质的量相等D. 反应后溶液中c(A-)=c(R+)14. 普通泡沫灭火器内的玻璃筒里盛有硫酸铝溶液,铁筒里盛有小苏打溶液,不能把硫酸铝溶液盛在铁筒里的原因是____。