2-
2-
-
-
mol·L-1 的 Na2SO3 和 Na2CO3 的混合溶液中,SO3 、
CO3 、
HSO3 、
HCO3
浓度从大到小的顺序为
。
已知:H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
)=10-6 mol·
L-1,所以 pH=6 的溶液
W
-1 的说明在水溶液中只存在电离平
B.25 ℃时
,0.1 mol·L-1的
NaHSO3mol·
溶液LpH=4,
显中性,A
项错误;25
℃时,0.1
NaHSO3 溶液 pH=4,不能说
衡
-
明在水溶液中只存在电离,亚硫酸是弱酸,HSO3 既电离又水解,溶液
-
Al(OH)3↓+3CO2↑
为 Al3++3HCO3
明矾可作净水剂,
Al(OH)3(胶体)+3H+
原理为 Al3++3H2O
铵态氮肥与草木灰不得混合使用
NH4Cl 与 ZnCl2 溶液可作焊接时的除锈剂
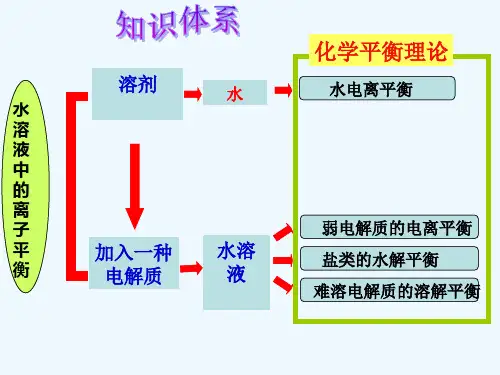
第十八页,共五十四页。
-19-
核心考点
考点(kǎo
diǎn)一
如 NH4Cl 的水解离子方程式为
NH4++H2O
NH3·H2O+H+。
第五页,共五十四页。
-6-
核心考点
考点(kǎo
diǎn)一
考点(kǎo
diǎn)二
考点三
基础(jīchǔ)考点突破