血培养标本留取流程
- 格式:doc
- 大小:13.00 KB
- 文档页数:1

下面红色字体为赠送的个人总结模板,不需要的朋友下载后可以编辑删除!!!!xx年电气工程师个人年终总结模板根据防止人身事故和电气误操作事故专项整治工作要求,我班针对现阶段安全生产工作的特点和重点,为进一步加强落实安全工作,特制定了防止人身事故和防电气误操作事故的(两防)实施细则。
把预防人身、电网、设备事故作为重点安全工作来抓,检查贯彻落实南方电网安全生产“三大规定”情况,检查(两防)执行情况,及时发现和解决存在的问题,提高防人身事故和防电气误操作事故的处理能力,从源头上预防和阻止事故的发生,使安全管理工作关口前移,从而实现“保人身、保电网、保设备”安全生产目标收到一定的效果。
通过前段的检查和整改工作,现将我班到现时为止在此方面的情况总结如下一、在防止人身事故方面(重点防范高处坠落事故)在运行维护、施工作业过程中的防触电、防高空坠落事故。
我班通过对每周的安全会议和工作负责人对现场高处作业管理的检查,使得安全防范思想、工作、监督到位;使安全工作责任、措施及整改落实,从而安全工作得到保证。
1、作业前的准备工作和控制措施工作。
包括高空作业现场查勘,使工作人员对该任务的危险点(安全措施卡)有清晰、准确、全面的认识,采取相应的控制和安全措施,并正确派选合适胜任的工作负责人和工作班成员。
2、在开工前,工作负责人向作业人员交待工作内容、安全注意事项及该作业的危险点。
作业过程中明确监护人员,监护人实时监控高处作业人员动向,及时提醒和纠正作业中的不安全行为,使安全措施不折不扣地落实和执行到位。
3、认真落实高处作业人员的安全保护措施。
配备可靠的(按规定期限内检验合格的)安全工器具,如安全带(绳)、升降板、脚扣、竹(木)梯等,并能够正确使用此类工器具。
4、在高空作业的工作全过程中,强调工作人员自始至终确保自身安全行为:△定期对登高工具和安全工器具(安全带、安全绳、脚扣、升降板、竹木梯子等)进行试验,试验或外观检查不及格的立即报废,严禁留作备用。

血培养标本的采集与运送操作规程一目的1、确保血标本样本培养的准确性。
2、采集血标本做细菌培养。
二用物准备一次性换药弯盘、碘酊、75%酒精、血培养瓶2套、10ml注射器2支、止血带三操作方法及程序1、洗手、戴口罩。
2、消毒用消毒液消毒培养瓶橡皮塞待干后使用。
用消毒液从穿刺点向外面划圈消毒至消毒区域直径达5cm以上待消毒液挥发干燥后30S穿刺采血。
消毒方法75%酒精消毒---碘酊消毒---75%酒精消毒待干。
3、采集部位外周静脉血、中心静脉血。
4、外周血标本采集参照护理部静脉血采集法。
5、中心静脉血标本采集遵循以上消毒方法对导管的肝素帽或输液接头进行消毒然后用10ml射器回抽导管5ml后弃掉然后用10ml注射器采集血样标本后立即注入血培养瓶内。
再用10ml无菌生理盐水脉冲式冲洗导管管腔内的残留血后给予封管液3ml进行封管封管后夹闭导管或继续输液治疗。
6、穿刺取血后排尽针头内空气直接注入血培养瓶勿更换针头先注入厌氧瓶、绕后注入需氧瓶轻轻混匀以防血液凝固。
同时采集标本间隔时间小于5分钟。
7、立即送实验室室温放置不超过12小时。
四注意事项1、检验单需注明抗菌药物使用情况、血液采集时间和部位、临床诊断等患者信息。
2、采血部位通畅为肘静脉切忌在静滴抗菌药物的静脉处采血。
3、采血时机发热高峰1小时内或开始时最好在使用抗生素之前或停用抗菌药物24h后。
4、采血次数应该同时分别在两个不同部位采集血标本在两个不同部位分离到同样菌才能确定时病原菌。
5、采血量以培养基与血液之比10:1为宜成人每次每培养瓶采血8-10ml婴幼儿2ml。
6、运送要求所有标本采集后都应立即送往实验室最好在2小时内。
血培养瓶送到检验科放入培养箱之前不应暂存于冰箱内。
血液培养标本采集的注意事项血培养标本采集和运送是血液细菌培养成功的重要环节!但由于标本的采集和运送常有护士或医生完成,所以也是最容易忽视的事情,由于不了解问题所在,引发的主要后果是血培养阳性率下降,这也是目前国内血培养阳性率低的主要原因。
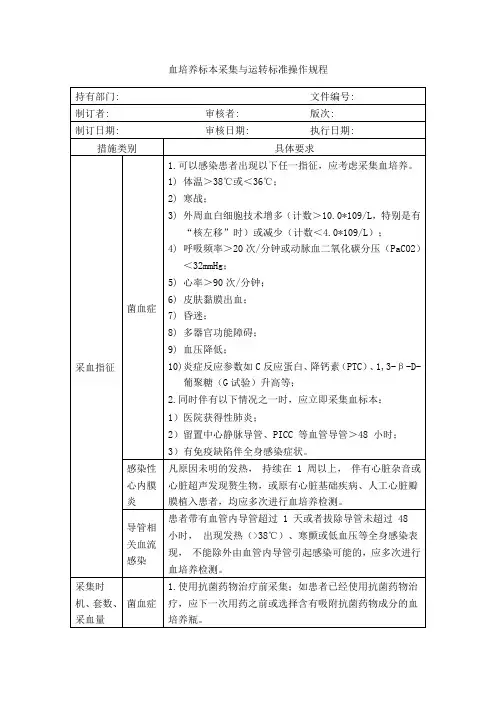
血培养标本采集与运转标准操作规程
导管血及导管尖端标本采集流程
怀疑导管相关血流感染,准备采集血培养标本
是否保
留导管
去除血培养的塑料瓶帽,使用75% 无菌操作拔出中央导管乙醇或70%异丙醇消毒或其他有效
消毒剂消毒血培养瓶口
手卫生,戴无菌手套
1.戴无菌手套
2.去掉导管前端无针接头,使用酒
精棉片消毒导管接头,待干无菌操作剪取导管尖端
3.连接注射器,回抽肝素丢弃 5cm,置于无菌容器中
4.重新连接注射器
从导管内抽取血液,分别注入需氧摘手套,手卫生
瓶和厌氧瓶,每瓶注入8-10mL,
颠倒混匀
注明采集时间
再次用酒精棉片擦拭消毒导管接头,
待干
同一时间采集1-2套外周摘手套,手卫生;血培养瓶上注明血培养标本,注明采集部采血部位和时间位和时间
导管端尽可能在15分钟内转运至实验室,其他血培养标本尽可能在
2小时内转运至实验室
怀疑导管相关血流感染且保留导管时,应尽快采集1-2套外周静脉血,并同时尽快采集1套等量的导管血。
准备1-2套血培养
瓶,无菌容器等
准备1-2套血培养
瓶,无菌容器等
是否。

血培养采集操作规程一、概述当微生物侵入血液迅速繁殖超出免疫系统清除这些微生物的能力时形成菌血症或真菌菌血症。
血液和骨髓的细菌学培养对菌血症的诊断具有重要价值。
临床菌血症按病程可分为一过性菌血症、间歇性菌血症、持续性菌血症。
菌血症患者多数为间歇性菌血症,病原菌周期性出现在血液中,随之为无细菌时期。
不管临床症状经历的严重程度,患者血液中病原菌浓度相当低,据此要求临床多次采集血液标本进行培养,但24h内一般不超过3次。
血培养常见菌:革兰阴性菌主要包括大肠埃希菌、肺炎克雷伯菌、肠杆菌,伤寒沙门菌、绿脓假单胞菌、不动杆菌属等;革兰阳性菌主要包括金黄色葡萄球菌、凝固酶阴性葡萄球菌、念珠菌属等。
菌血症是临床医学急症,应尽快采集血液进行培养。
二、物品准备与检验申请1、领取专用血培养瓶。
请拿检验申请单到病房二楼细菌室登记领取。
细菌室周一到周六上午正常上班。
其他时间如中午、夜班、节假日请到生化室联系。
普通血培养领取普通双相血培养瓶(绿色帽),全自动血培养领取:成人血培养领成人瓶(灰色帽),儿童血培养领儿童瓶(粉红色帽)。
2、填写检验申请单。
用钢笔填写,字迹清楚,填写完整。
填写内容包括:患者姓名、性别、年龄、科别、病区、床号、住院号、临床诊断、送检目的、申请医生及送检时间。
三、采集指征一般患者出现以下一种体征时可作为采血的重要指征:发热(≥38℃) 或低温(≤36℃) ,寒战,白细胞增多(计数大于10. 0×109/ L ,特别有“核左移”时) ,皮肤黏膜出血、昏迷、多器官衰竭,血压降低,C 反应蛋白升高及呼吸加快,血液病患者出现粒细胞减少,血小板减少等,或同时具备上述几种体征时而临床可疑菌血症应采集血液培养。
新生儿可疑菌血症,应该同时做尿液和脑脊液培养。
对入院危重感染患者应在未进行抗菌药物治疗之前,及时做血培养。
四、采集方法1、操作流程: 打开血培养瓶塑料盖用75%酒精消毒血培养瓶橡皮塞并擦干表面残余酒精→消毒皮肤后用无菌注射器抽取血液从橡皮塞处注入血培养瓶内→用75%酒精重新消毒血培养瓶橡皮塞并盖好塑料盖→立即送检。

1. 方法1.1 选取适当的采血管:在留取血培养标本时,首先要选择适当的采血管,通常使用含有抗凝剂的血管,如EDTA管或肝素管。
1.2 消毒皮肤:接下来要对患者的采血部位进行消毒处理,以减少外部细菌的污染。
常用的消毒剂有酒精、碘酒或氯己定等。
1.3 抽取血样:消毒后,使用一次性采血器具,将血样采集到抗凝管内,通常要留取足够的血样做血培养检验。
1.4 标注标本信息:在留取血培养标本后,务必要在标本管上标注患者的相关信息,如尊称、性莂、芳龄、病区、科室等。
2. 注意事项2.1 避免空气污染:在留取血培养标本时,要尽量避免空气污染,避免将外部空气中的细菌带入血样中,尤其在离心和接种血培养时更要注意。
2.2 注意采血技巧:采血人员要有一定的采血技巧,避免在采血过程中对患者造成过多疼痛,也要避免对血样造成不必要的污染。
2.3 避免过度摇晃:在留取血培养标本后,要避免过度摇晃标本管,以免破坏细菌的生长和培养。
轻轻摇匀即可。
2.4 选择合适的培养基:在进行血培养前,要根据临床情况和病原体的猜测,选择合适的培养基,如青霉素富养基或厌氧培养基等。
3. 丰富的续写和扩展内容3.1 血培养标本处理血培养标本的处理是非常关键的环节。
在采集完血样后,需要将标本尽快送到临床微生物实验室进行处理。
在送检前,要确保标本的密封性,避免血样泄漏或被外部污染。
要根据医学实验室的规范和操作流程进行标本的处理和运送,以确保标本的完整性和可靠性。
3.2 血培养标本的保存对于血培养标本的保存,要避免高温、阳光直射、冷冻等不利因素。
通常建议在室温下保存,但也要避免放置在过于潮湿或通风不良的环境中。
保持标本的原有状态,确保在送检前细菌的数量和种类不发生改变。
3.3 血培养标本的接种在进行血培养时,需要根据医学实验室的规范和要求进行标本的接种。
通常情况下,要使用专门的接种环境和设备,如无菌培养皿、接种环、无菌移液器等。
接种时要正确添加培养基,避免过度或不足的添加,同时要确保标本的均匀分布。

血培养标本的采集注意事项和运送第一篇:血培养标本的采集注意事项和运送血培养标本的采集注意事项和运送血流感染的发生发展可以严重威胁患者的生命,其正确诊断不仅可以减少抗菌药物的误用和滥用,同时可以大大地改善患者的预后,降低患者的病死率,减少医疗花费。
本文向读者详细介绍血培养标本采集时间、套数、血量要求、样本运输、皮肤消毒注意事项、导管相关性血流感染以及感染性心内膜炎诊断规范、快速鉴定血培养中的念珠菌、MRSA、葡萄球菌等新方法。
提醒广大医务工作者严格执行血流感染的诊断规范,快速报告实验结果,强调及时与临床,提高血流感染诊断水平的重要意义。
1、采血时间研究表明,大量入血的时间为患者寒颤发热前1小时,在此期间,应同时(或间隔30-60 min)采集2-3套血培养,只有在怀疑患者有感染性心内膜炎或其它血管内感染(如导管相关性感染)时,才有必要间隔较长时间多次采集血培养。
2、血培养数量在每次败血症期间,推荐采集2-3套血培养。
对于成人,不应仅做1套血培养,不仅因为采血量不足,而且1套血培养的结果较难解释。
由于在开始抗菌治疗后,患者中的致病菌不会立即清除,2-5天内无须重复进行血培养。
但对于感染性心内膜炎患者,应多次进行血培养以评估和指导治疗;由金葡球菌引起的败血症(非感染性心内膜炎),应在48-96 小时重复培养以判断其是否为复杂性金葡菌败血症。
3、血培养采血量采血量对于败血症的检测非常重要。
对于成人,采血量在2-30 ml 时致病菌的检测与血量成正比,虽然采血量增长至40 ml(甚至更高)时血培养阳性率仍在提高,但已经不再与采血量成正比。
对于婴幼儿,采血量不应超过患儿总血量的1%。
4、血标本在需氧瓶和厌氧瓶间的分配在常规血培养中,推荐成对使用需氧瓶和厌氧瓶。
如果采血量低于推荐血量,应将血标本先注入需氧瓶,再将剩余血液注入厌氧瓶,因为大部分败血症是由需氧或兼性细菌及酵母菌引起的。
如果仅做需氧培养,每套培养应使用2个需氧瓶并保证有足够的血量。


可编辑修改精选全文完整版血培养标本细菌学采集、运送、验收标准操作规程1.目的标准血培养标本细菌学采集、运送、验收标准操作规程,确保检验结果精确可靠。
2. 范围微生物实验室受理血培养瓶。
3. 职责3.1 医护人员正确采集血培养标本送检。
3.2 临床科室标本运输人员负责及时将血培养标本送至检验科微生物室。
2血培养指证2.1患者出现寒战,发热〔≥38℃〕或低温〔≤36℃〕.2.2白细胞增多〔>10×109/L,特别有“核左移〞未成熟的或带状的白细胞增多〕皮肤粘膜出血;血液病患者出现粒细胞减少〔成熟的多形核白细胞<1×109/L〕,血小板减少等.2.3疑心血流感染时,医院内肺炎.2.4留置中心静脉导管超过72h.2.5感染性心内膜炎、骨髓炎、昏迷。
2.6有严峻根底疾病、免疫缺陷伴全身感染病症、多器官衰竭。
2.7临床医生疑心有血流感染可能的其他情况.〔血压降低,CRP 升高及呼吸快〕。
2.8新生儿菌血症,应同时做尿液和脑脊液培养。
3血培养采集3.1采集血量:采血量以培养基的 1/10 为宜,成人每瓶采集:5~10ml,婴儿每瓶采集:1~2ml。
儿童每瓶采集:2~5 ml。
婴幼儿病人,一般只抽一瓶需氧瓶进行培养,无需常规做厌氧瓶。
3.2血培养份数和采血时间对疑心菌血症的成人患者,推举同时采集2-3套〔不同部位〕血培养标本。
婴幼儿患者,推举同时采集2次〔不同部位〕血培养标本。
一次静脉采血注入到多个培养瓶中应视为单份培养或一套血培养。
屡次采血不应在同一部位进行,应更换部位。
对于间歇性寒颤或发热应在寒颤或体温顶峰到来之前0.5-1小时采集血液。
对于某些全身性和局部感染患者采血培养的建议:〔一瓶需氧瓶,一瓶厌氧瓶为一套,或者两套需氧瓶为一套〕急性发热疑心菌血症者,应尽量在抗菌药使用之前,在10分钟内于不同部位采集两套血培养标本。
对于非急性感染,疑心有菌血症者,应在24h内于不同部位采集2-3份血标本,每次采血的间隔不应小于3h,并应于抗菌给药前采血。

血培养标本采集、运送与报告标准操作规程一、血培养指征患者出现寒战,体温超过38℃或低体温,怀疑血流感染时,尤其存在以下情况时,应抽血做细菌和真菌培养:医院内肺炎;留置中心静脉导管超过72h;感染性心内膜炎;骨髓炎;有严重基础疾病、免疫缺陷伴全身感染症状;临床医生怀疑有血流感染可能的其他情况。
二、采血时机一旦怀疑有血流感染可能,应立即采血做培养,最好在抗菌治疗前或停用抗菌药物24h后,以寒战、发热时采集为宜。
三、采血流程(一)消毒1、培养瓶消毒程序:用消毒液消毒培养瓶橡皮塞,待干燥后使用。
2、皮肤消毒程序:用消毒液从穿刺点向外画圈消毒,至消毒区域直径达5cm以上,待消毒液挥发干燥后(常需30s以上)穿刺采血。
(二)静脉穿刺和培养瓶接种成人用注射器无菌穿刺取血后,排尽针头内的空气,直接注入血培养瓶,勿换针头(如果行第二次穿刺或用头皮针取血时,应换针头),先注入厌氧培养瓶,避免注入空气,然后注入需氧培养瓶,轻轻混匀以防血液凝固。
近年来,临床普遍采用负压血培养瓶,将血从患者静脉直接吸入血培养瓶,减少污染环节。
(三)注意事项1、检验单需要注明抗菌药物使用的情况、血液采集时间和部位、临床诊断等患者信息。
2、采血部位通常为肘静脉,疑为细菌性心内膜炎时以肘动脉或股动脉采血为宜,切忌在静滴抗菌药物的静脉处采血。
除非怀疑有导管相关的血流感染,否则不应从留置静脉或动脉导管取血,因为导管易被皮肤正常菌群污染。
3、采血次数:对于成年患者,应该同时分别在两个部位采集血标本,在两个不同部位分离到同样菌种才能确定是病原菌。
4、细菌性心内膜炎:在24h内取血3次,每次间隔不少于30min;必要时次日再做血培养2次。
5、采血量:以培养基与血液之比10:1为宜,以稀释血液中的抗菌药物、抗体等杀菌物质。
采血量过少会明显降低阳性率。
成人每次每培养瓶采血8~10ml,婴幼儿每次每培养瓶采血2ml。
四、运送要求1、所有标本采集后都应立即送往实验室,最好在2h内。

血液标本采集注意事项一、血液标本采集注意事项采血前应核对患者姓名、床号等信息,明确检验项目、标本要求及需血量。
建议使用“真空血液采集针”采集血液标本。
如采静脉血时止血带结扎过久,可引起检测结果的误差,建议回血后立即解除压脉带。
血液标本采集顺序:蓝帽管在第二管位置血培养瓶(或第一支红帽)→蓝帽管→红帽管→紫帽管→……1. 采集自凝血:均使用大红帽自凝管采血,采血量以送检科室为单位只需3ml即可。
由于自凝管中有促凝剂或分离胶,标本采集后,最好颠倒混匀3~4次。
2.采集防凝血:3.标本溶血常见原因:采血不熟练;注射器血急速注入试管;试管混匀用力过猛;从已有血肿的静脉采血;采血量不足后二次采血;穿刺处所用消毒液未干;注射器和针头连接不紧采血时空气进入产生泡;采血用针头过细;静脉穿刺不顺利等原因均会引起溶血,溶血会影响部分检测项目的准确性。
4. 特别注意采血不能在输液的同侧进行,更应杜绝在输液管内采血,因输液成分会影响检测结果(使相应的结果偏高,如输K+、Glu时,可使所测K+、Glu明显增高),或使血液稀释结果偏低。
5. 血液培养的样品要采用无菌技术,防止污染。
葡萄糖耐量测定:试验前三天正常饮食,试验当日清晨空腹抽血2ml,将75克葡萄糖溶于300ml温水中嘱病人一次服下,立即记录时间;然后分别在服糖后60、120、180分钟,各抽防凝血2ml,试管上标明时间标记,立即送检。
二、尿液标本采集注意事项根据检测项目不同,尿液标本留取方法可分为晨尿、随机尿、24小时尿、无菌尿。
(1) 晨尿:为住院病人留尿的主要方法,早晨起床后收集第一次尿,可用尿常规、尿肾功检验,但留取至送检时间不宜超过2小时。
(尽量留取新鲜尿液为宜)(2) 随机尿:多为门诊就诊病人的留尿检验方法。
应留取新鲜尿液置清净、干燥容器中立即送检。
(静脉滴注大剂量青霉素、VitC时可影响尿蛋白、尿糖及尿隐血结果,应尽量避免)。
(3)24h尿:主要用于化学组分的测定,亦用于某些需要浓缩检查项目。
如何正确留取血培养标本正常情况下,血液内是无菌的,当局部感染逐渐蔓延或者全身感染时,病灶组织处的细菌会侵入血液内引起感染症状,例如毒血症、菌血症、脓毒血症、败血症等,此时需及时进行血液培养,查出是何种原因导致的感染,进而给予针对性治疗,以保证患者生命安全。
但要想获得准确的培养结果,还需正确留取血培养标本,进而才能给予有效的治疗。
给予比,本文讲一讲如何正确留取血培养标本,具体如下。
一、准备工作要想正确留取血培养标本,需要先做好准备工作。
掌握患者各方面的情况,是否存在皮疹、发热、化脓性病灶、化脓性损害、关节疼痛、血压透析、长期输液、黏膜损伤性病灶、介入治疗、肝脾肿大、休克、神志昏迷等现象,然后再进行血液样本采集。
虽然血液样本能清晰的反应血液内是否有微生物、真菌、细菌等,但培养结果受多种因素的影响。
要想提升血液培养准确度,还需注意相应影响因素,把控好各个环节,特别是血液标本的留取工作,更要把握好采集部位、采集时间、采集次数、采集量、送检过程等,以获得准确的血培养结果,为后续治疗提供可靠依据。
二、采集血液标本的时间(1)采集原则:正常情况下,在患者发热初期或者发热高峰期采集血液样本,且原则上,需在使用抗生素治疗之前采集,对于已经使用抗生素进行治疗,而无法中途停药的病人,需在下次抗生素治疗之前采集血液样本。
(2)不明因素发热者:对于不明因素发热的患者,要在发热周期内进行多次血液样本采集。
若24小时内血培养结果都是阴性,则需继续采集2至3份血液样本,再次进行血培养。
(3)心内膜炎患者:对于患有急性心内膜炎的患者,治疗之前的1至2小时内进行血液样本采集,从三个部位采集血液样本,然后分别进行血液培养。
对于亚急性内膜炎患者,除了在发热阶段采集血液样本,在其他阶段也要多次采血,一般情况下,第1日需采集3次血液样本,进行三次血培养。
若24小时内,血培养结果均是阴性,则需再次进行多次血液样本采集,实施3次或者更多次的血液培养。