多电子原子中电子分布
- 格式:ppt
- 大小:1.96 MB
- 文档页数:13


原子核外电子排布的几个问题一、核外电子排布所遵守的规则多电子原子的核外电子排布是有规律的,首先是电子按层排布,而且每层最多容纳的电子数为2n2个;其次,最外层电子数不得超过8个,而次外层的电子数则不能超过18个。
这些规律是从实验和周期律总结出来的,核外电子的排布服从如下的三个规则:1,能量最低原理:核外电子的排布将尽可能使体系的能量最低。
因此,电子首先排布在能量最低的轨道上,最低轨道排满后,电子再进入能量较高的轨道。
2、保里原理:在同一个原子中,最多只能有两个电子处在同一状态(这里指的是由三个量子数n,1,n规定的状态或称为轨道),但这两个电子的自旋方句必须相反。
这就是说,在同一原子中不可能有二个戈更多个电子有完全相同的四个量子数。
这个原理是呆里根据实验总结出来的,保里原理是自旋量子数为'K}整数的一类粒子(如电子、质子和中子等)所遵从钩统计规律的反映。
从几率的观点来看,两个电子在某一瞬间同时在空间某点出现的几率等于零,这说明电子有相互回避的特性,这种特性就反映在保里原理3、洪特规则:在不违背能量最低原理和保里原理的前提下,在由相同的主量子数n和角量子数1规定的等价轨道上排布电子时,电子总是先单独而且自旋平行地占据尽量多的轨道,当各等价轨道上都占有一个电子后,电子继续填充时才逐一填充在已有一个电子的轨道上。
这一规则是洪特根据光谱实验总结出来的,又称为尽量不成对原理。
作为洪特规则的特例,全充满、半充满和全空的状态较为稳定。
这里我们对洪特规则作些说明。
二、屏蔽效应和钻穿效应在确定原子轨道能级高低时,徐光宪教授曾从光谱实验总结出一个规则,即对原子而言,外层轨道能级大小由n十0,71决定,对离子而言,外层轨道能级大小由,十。
.^1决定,对原子和离子的内层执道,墓洪特规则的实质还是能量最低原理。
电子在等价轨道上分占不同轨道并且自旋平行的排布,比其他的排布方式具有较低的能量,特别是在全充满、半充满及全空的情况下,原子体系的总能量是各种可能排布y能星最低的h1s种排布方式。


原子结构中的电子排布规律与原子能级图在原子结构中,电子的排布规律决定了元素的性质和化学行为。
电子按照一定的规则分布在原子的能级上,形成了原子能级图。
本文将探讨原子结构中的电子排布规律以及原子能级图的构建。
一、电子排布规律1. 起始原则:根据泡利不相容原理,每个原子中的电子的四个量子数(主量子数n、角量子数l、磁量子数ml和自旋量子数ms)不能完全相同。
因此,首先填充最低能级的电子。
2. 奥卡规则:根据奥卡规则,电子填充顺序为按照能级的升序(主量子数n增大)填充。
当能级相同时,按照角量子数l的升序填充。
这一规则保证了电子填充的有序性。
3. 霍克规则:根据霍克规则,每个轨道(具有相同主量子数n和角量子数l的电子组合)最多容纳2个电子,且这2个电子的自旋量子数相反。
这一规则成为“违反泡利不相容原理”的例外。
二、原子能级图在原子能级图中,横坐标表示主量子数n,纵坐标表示能量。
每条横线代表一个能级,能级距离越小,电子的能量越高。
以下是一些常见的原子能级图:1. 氢原子:氢原子只有一个电子,根据能级公式En = -13.6/n^2(n为主量子数),氢原子的能级图为一系列离散的水平线。
每条水平线上的能级数目由角量子数l决定。
2. 多电子原子:多电子原子的能级图更为复杂。
由于电子之间的排斥作用,使得能级分裂成了更多的子能级。
不同角量子数对应的子能级之间存在能级差。
3. 周期表:通过观察周期表中的元素,我们可以了解到原子能级图的一些规律。
周期表中的每一行代表一个主量子数n的能级,而每个周期表中的元素代表不同的电子填充顺序。
总结起来,原子结构中的电子排布遵循一定的规律,其中起始原则、奥卡规则和霍克规则是主要的规律。
而原子能级图则是用来表示不同能级和子能级之间的能量关系。
通过研究电子的排布规律和原子能级图,我们可以更好地理解原子的性质和化学行为。
通过本文的讨论,我们可以得出结论:原子结构中的电子排布规律与原子能级图是相互关联的,它们共同构成了描述原子结构的重要工具。


斯莱特规则斯莱特规则(Slater's rule)是一种在量子力学中常用的近似规则,用于计算多电子原子的基态电子分布。
这个规则是由美国物理学家罗伯特·斯莱特(Robert S. Slater)提出的,它提供了一种简单的方法来估算原子中电子的分布情况。
斯莱特规则的主要内容是:在原子中,电子按照波函数分布,而波函数可以表示为电子到原子核的距离的函数。
根据量子力学的原理,电子在原子中的运动是概率密度的分布,而不是确定的位置。
斯莱特规则假设电子之间的相互作用是相互排斥的,因此电子会分布在尽可能远离彼此的位置。
具体而言,斯莱特规则假设电子按照占据数目的递增顺序,尽可能远地分布在整个原子轨道上。
这意味着,在原子中,电子首先按照1s轨道排列,然后是2s轨道、2p轨道、3s轨道、3p轨道,以此类推。
这种排布方式可以最小化电子之间的排斥作用,从而使得整个原子的能量最低。
斯莱特规则在计算多电子原子的基态电子分布时非常有用,因为它提供了一种快速而简便的方法来估计电子的分布情况。
然而,需要注意的是,斯莱特规则是一种近似方法,它可能不适用于所有情况。
在处理复杂的化学问题时,可能需要使用更精确的量子力学方法,例如密度泛函理论或分子轨道理论等。
除了在原子物理学和化学领域的应用外,斯莱特规则还可以用于其他领域的研究。
例如,在生物学领域,斯莱特规则可以用于研究分子结构与功能的关系。
此外,在材料科学领域,斯莱特规则可以用于预测材料的电子结构和物理性质。
总之,斯莱特规则是一种在量子力学中常用的近似方法,用于计算多电子原子的基态电子分布。
虽然它是一种近似方法,但在许多情况下,它能够提供足够准确的结果,使得科学家们能够更好地理解原子的性质和行为。

【同步教育信息】一. 本周教学内容:1. 了解原子的核外电子是分层排布及原子结构示意图的涵义。
2. 了解离子的概念。
3. 了解化合价的实质及正负价的含义并记住常见元素和原子团的化合价。
4. 了解元素化合价和化学式的关系,能根据化学式判断元素的化合价,并能根据元素的化合价写出物质的化学式。
5. 通过元素的性质跟它的原子结构关系的学习,掌握结构、性质之间的辩证关系。
6. 理解化学式的概念及化学式所表示的意义(①表示一种物质②表示组成该物质的元素③表示组成该物质的各元素的原子个数比)。
7. 能正确书写常见单质和两种元素组成并已知各元素原子个数比的化合物的化学式。
8. 理解化学式前和化学式中有关数字的不同的意义。
二. 重点分析和讲解1. 核外电子排布的初步知识(1)电子层及与电子能量关系从原子的结构得知原子核很小,电子也很小,电子在很大的一个区域内高速运动,但电子的运动并不是杂复无章的。
多电子原子中电子是分层运动的,核外电子根据能量的差异和通常运动的区域离核的远近不同,分属于不同的电子层。
电子层及与电子能量关系如下:电子层数(n):1、2、3、4、5、6、7 表示符号:K、L、M、N、O、P、Q离核距离:由近→远能量高低:由低→高(2)原子结构示意图的含义原子结构示意图是用来表示核外电子排布状况的图示,可有助于理解核外电子的分层排布。
例如:用原子结构示意图表示钠原子的核外电子排布。
对于1~18号元素符号,名称要记住并且会画原子结构示意图。
1~18号元素原子核外电子排布有以下规律,掌握住便于记忆。
(3)元素的原子最外层电子的特点从1~18号元素的原子结构示意图可以看出,稀有气体元素、金属元素和非金属元素的原子最外层的电子数目及性质有如下特点。
元素分类原子最外层电子数结构特征化学性质金属元素1~3个电子不稳定结构在化学变化中,易失去最外层电子非金属元素4~7个电子在化学变化中,易得到电子稀有气体元素8个电子(氦2个电子)稳定结构稳定,一般不参加化学反应金属元素、非金属元素与稳定结构关系如下:由上面的分析和以前学过的知识,我们得到以下结论:a. 原子最外层电子数−−→−决定元素化学性质 b. 质子数(核电荷数)−−→−决定元素种类 c. 质子数与电子数−−→−决定微粒电性 (4)离子离子:带电的原子或原子团叫离子。


多电子原子能级和徐光宪规则在多电子原子中,电子排布遵循泡利不相容原理和洪特规则。
泡利不相容原理指出,每个能级上的电子数目不能超过2个,并且这两个电子的自旋方向必须相反。
洪特规则指出,电子首先填满低能级,然后再填满高能级。
基于这两个原理,我们可以应用徐光宪规则来确定多电子原子的电子排布。
徐光宪规则是以中国科学家徐光宪的名字命名的,他在20世纪30年代提出了这一规则。
根据徐光宪规则,电子首先填满能量最低的壳层(K 壳),然后从内层向外层依次填满能级,直到填满最外层的电子。
在填充过程中,如果有多个具有相同能量的能级,那么电子会优先填满轨道数最少的能级。
这一规则可以帮助我们理解多电子原子的电子排布和能级分布。
例如,让我们考虑氧原子(O)的电子排布。
氧原子有8个电子,按照泡利不相容原理,这些电子会占据1s、2s和2p能级。
根据徐光宪规则,我们先填满1s轨道,这个轨道只有一个能级。
所以,氧原子的1s轨道上有2个电子。
然后,我们填满2s轨道,这个轨道也只有一个能级。
所以,氧原子的2s轨道上也有2个电子。
最后,我们填满2p轨道,这个轨道有3个不同的能级(ml=-1, 0, 1)。
根据徐光宪规则,我们会先填满ml=0这个能级,然后再填满ml=-1和ml=1、所以,氧原子的2p轨道上有6个电子。
综上所述,氧原子的电子排布为1s²2s²2p⁴。
徐光宪规则还可以用来解释电子排布中的一些现象。
例如,徐光宪规则可以解释为什么2s轨道的能量低于2p轨道的能量。
根据徐光宪规则,轨道的能量取决于电子之间的相互作用。
2s轨道上的电子更靠近原子核,所以与核之间的相互作用更强,能量更低。
而2p轨道上的电子离核更远,所以与核的相互作用较弱,能量较高。
徐光宪规则还可以解释为什么在填充4s和3d能级时,优先填充4s能级。
根据徐光宪规则,当填充3d能级时,会出现不相容的电子排布,即两个电子在同一个3d轨道上具有相同的自旋,这样的排布会增加能量。
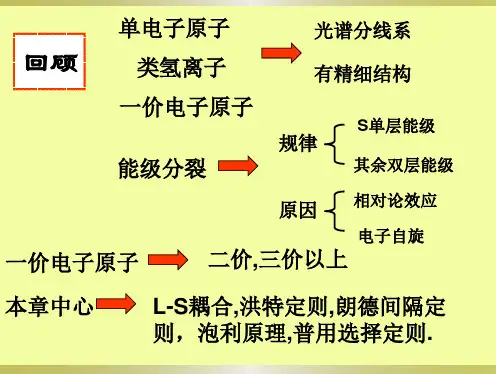

多电子原子的核外电子排布-江南大学教务处多电子原子是指核外有多个电子的原子。
核外电子的排布可以通过填写电子构型来表示。
电子构型描述了不同能级、子能级和轨道中电子的分布方式。
江南大学教务处提供了多电子原子的核外电子排布的相关信息。
多电子原子的核外电子排布遵循一些基本的规则。
首先是泡利不相容原理,该原理指出一个原子的任何两个电子不能具有完全相同的四个量子数。
这意味着每个电子必须在不同的轨道中。
其次是Hund规则,该规则描述了电子如何填充电子能级和子能级。
根据Hund规则,当有多个等能级可用时,电子更趋向于单独占据这些可用的能级,而不是成对占据。
在了解这些规则后,我们可以通过填写电子构型来描写多电子原子的核外电子排布。
电子构型使用一系列数字和字母来表示核外电子的排布顺序。
电子构型的写法通常以核外电子的主量子数和轨道类型开头。
主量子数表示电子所在能级的大小,而轨道类型则表示电子所在轨道的形状。
常用的轨道类型有s、p、d和f。
其中s轨道最简单,能容纳2个电子;p轨道能容纳6个电子;d轨道能容纳10个电子;f轨道能容纳14个电子。
接下来是核外电子的副量子数,表示电子所在子能级的类型。
副量子数的值从0开始递增,最大值取决于所在能级的大小。
例如,当主量子数为1时,副量子数的值可以是0或1,表示属于1s或2s轨道。
最后是核外电子的自旋量子数,表示电子自旋的方向。
自旋量子数可以是正(+1/2)或负(-1/2)。
以氧原子(O)为例,氧原子的原子序数为8,因此核内有8个质子和8个中子。
根据泡利不相容原理,氧原子有两个电子填充在1s轨道中,两个电子自旋量子数一个为正,一个为负。
接着,氧原子的剩余6个电子填充在2s和2p轨道中。
根据Hund规则,氧原子的6个电子会单独占据2s和2p轨道。
所以,氧原子的电子构型可以写为:1s² 2s² 2p⁴。
以上是氧原子的电子构型,而其他多电子原子的电子构型可以通过类似的填写规则来确定。