22多电子原子的结构
- 格式:ppt
- 大小:3.41 MB
- 文档页数:44



第三节多电子原子的原子结构外层只有一个电子时,由于该电子仅受到核的吸引如氢原子或类氢原子,可以精确求解出波函数。
但多电子原子核外有2个以上的电子,电子除受核的作用外,还受到其他电子对它的排斥作用,情况要复杂得多,只能作近似处理。
但上述氢原子结构的某些结论还可用到多电子原子结构中:在多电子原子中,每个电子都各有其波函数ψi,其具体形式也取决一组量子数n、l、m。
多电子原子中的电子在各电子层中可能占据的轨道数,与氢原子中各电子层轨道数相等。
多电子原子中每个电子的波函数的角度部分Y(θ,φ)和氢原子Y(θ,φ)相似,所以多电子原子的各个原子轨道角度分布图与氢原子的各个原子轨道的角度分布图相似。
同理两者的Y 2图也相似。
处理多电子原子问题时,认为其他电子对某个电子i的排斥,相当于其他电子屏蔽住原子核,抵消了一部分核电荷对电子i的吸引力,称为其他电子对电子i的屏蔽作用(screening effect),引进屏蔽常数σ(screening constant)表示其他电子所抵消掉的核电荷。
这样多电子原子中电子i的能量公式可表示为式中(Z –σ)= Z′称为有效核电荷(effective nuclear charge)。
多电子原子电子的能量和Z、n、σ有关。
Z愈大,相同轨道的能量愈低,如基态氟原子1s电子的能量比基态氢原子1s电子的能量低;n愈大,能量愈高;起屏蔽作用的电子愈多,总的屏蔽作用愈强。
σ愈大,能量愈高。
影响σ有以下因素:1. 外层电子对内层电子的屏蔽作用可以不考虑,σ=0;2. 内层 (n-1层)电子对最外层(n层)电子的屏蔽作用较强,σ=,离核更近的内层(n-2层)电子对最外层电子的屏蔽作用更强,σ=;3. 同层电子之间也有屏蔽作用,但比内层电子的屏蔽作用弱,σ=,1s之间σ=。
n相同l不同时,l愈小的电子,它本身的钻穿能力愈强,离核愈近,它受到其他电子对它的屏蔽作用就愈弱,能量就愈低E n s <E n p <E n d <E n f。

原子结构讲解
原子结构是指原子的组成以及各组成部分之间的相对位置。
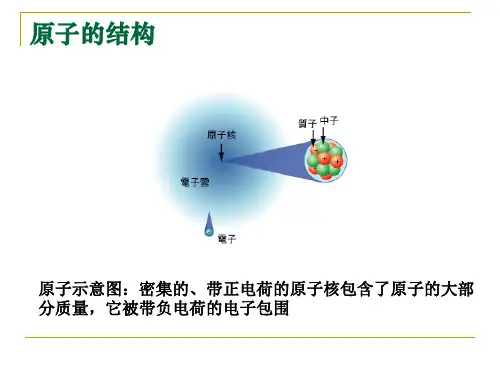
原子是由原子核和核外电子组成的,原子核位于原子的中心,核外电子围绕原子核高速旋转。
原子结构示意图是一种表示原子结构的图示,它用圆圈和小圈分别表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。
原子的核外电子是分层排列的,从里到外分别称为第一层、第二层、第三层等。
每层最多可以排2×(n)^2个电子,其中n表示层数。
最外层电子数不
超过8个,次外层电子数不超过18个,倒数第三层不超过32个。
原子的性质由其核外电子的排布决定。
根据电子排布的不同,原子可以分为金属原子、非金属原子和稀有气体原子。
金属原子的最外层电子数一般小于4,容易失去电子,表现出金属的特性;非金属原子的最外层电子数一般大
于或等于4,容易得到电子,表现出非金属的特性;稀有气体原子的最外层电子数为8个(氦为2个),是一种稳定结构,表现出稀有气体的特性。
以上就是原子结构的简要介绍,如需获取更多信息,建议查阅化学书籍或咨询化学专家。

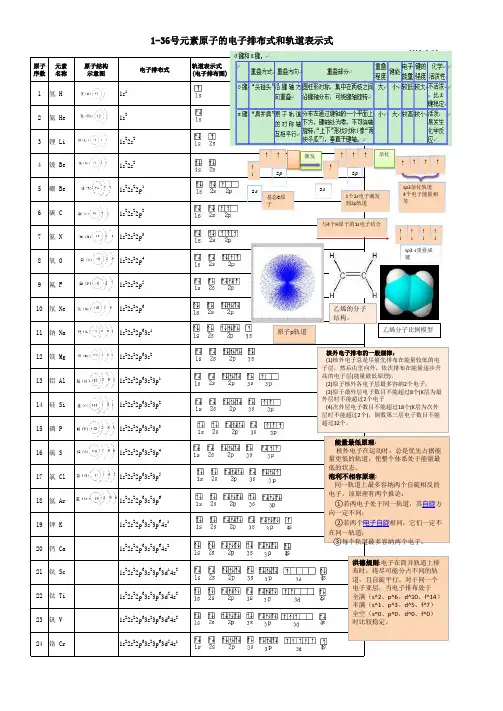
族IA IIA ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0周期表中纵列数第1列第2列第3列第4列第5列第6列第7列第8列第9列第10列第11列第12列第13列第14列第15列第16列第17列第18列第一周期(1-2号)原子序数元素符号名称1 H 氢2 He 氦2种元素电子排布式 1s 11s 2电子排布图原子结构示意图第二周期(3-10号)原子序数元素符号名称3 Li 锂4 Be 铍5 B 硼6 C 碳7 N 氮8 O 氧9 F 氟10 Ne 氖8种元素电子排布式 1s 22s 1 1s 22s 21s 22s 22p 11s 22s 22p 21s 22s 22p 31s 22s 22p 41s 22s 22p 51s 22s 22p 6电子排布图原子结构示意图第三周期(11-18号)原子序数元素符号名称11 Na 钠12 Mg 镁13 Al 铝14 Si 硅15 P 磷16 S 硫17 Cl 氯18 Ar 氩8种元素电子排布式1s 22s 22p 63s 11s 22s 22p 63s 21s 22s 22p 63s 23p 11s 22s 22p 63s 23p 21s 22s 22p 63s 23p 31s 22s 22p 63s 23p 41s 22s 22p 63s 23p 51s 22s 22p 63s 23p 6电子排布图原子结构示意图第四周期18种(19-36号)原子序数元素符号名称19 K 钾20 Ca 钙21 Sc 钪22 Ti 钛23 V 钒24 Cr 铬25 Mn 锰26 Fe 铁27 Co 钴28 Ni 镍29 Cu 铜30 Zn 锌31 Ga 镓32 Ge 锗33 As 砷34 Se 硒35 Br 溴36 Kr 氪电子排布式【Ar 】4s 11s 22s 22p 63s 23p 64s 21s 22s 22p 63s 23p 63d 14s2【Ar 】3d 24s 21s 22s 22p 63s 23p 63d 34s21s 22s 22p 63s 23p 63d 54s 1【Ar 】3d 24s 21s 22s 22p 63s 23p 63d 64s2【Ar 】3d 74s 21s 22s 22p 63s 23p 63d 84s21s 22s 22p 63s 23p 63d 104s 11s 22s 22p 63s 23p 63d 104s 21s 22s 22p 63s 23p 63d 104s 24p 11s 22s 22p 63s 23p 63d 104s 24p 2【Ar 】3d 104s 24p 31s 22s 22p 63s 23p 63d 104s 24p 4【Ar 】3d 104s 24p 5【Ar 】3d 104s 24p 6第五周期18种37-54号价电子排布式4s 14s 23d 14s 23d 24s 23d 34s 23d 54s 13d 54s 23d 64s 23d 74s 23d 84s 23d104s 13d 104s 24s 24p 14s 24p 24s 24p 34s 24p 44s 24p 54s 24p 6第六周期32种55-86号 镧系电子排布图价电子排布图第七周期?种满32种87-满118号锕系原子结构示意图共价键分类s-sσ键s-pσ键p-pσ键p-pΠ键分子或离子CO 2SO 2 CO 32-CH 4NH 4+ 中心原子杂化轨道类型spsp2sp3a 64+2=65-1=4x 234H 2O NH 3b221sp3sp3中心原子上的孤对电子数0100分子或离子的价层电子对数2334VSEPR模型名称直线形平面三角形平面三角形正四面体形正四面体形分子或离子的立体构型名称直线形V形平面三角形正四面体形正四面体形配合物形成:颜色改变、溶解度改变无机含氧酸分子酸性1、对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
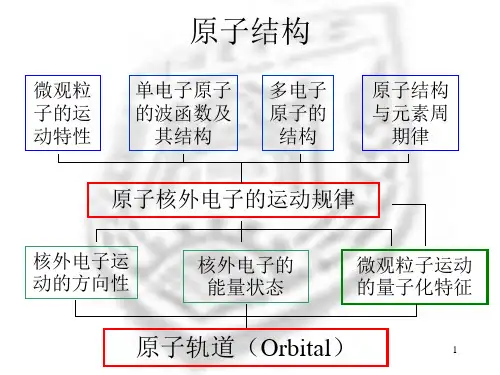

基态ti原子的价层电子排布图
钛是一种常见的金属元素,其原子序数为22,原子量为47.867,在自然界中含量较丰富。
钛元素的价层电子排布图是钛原子的基态构型的表述。
以下是ti原子的基态构型和价层电子排布图:钛原子的基态构型为[Ar]3d2 4s2,它具有22个电子,电子排布如下:1s2 2s2 2p6 3s2 3p6 4s2 3d2,此时原子处于低能状态。
从基态Ti原子的价层电子排布图中可以看出,它共有8个价层,从外到内如下:s,p,d,f,s,p,d,f。
s层有2个电子,占外层的总电子数的25%;p层有6个电子,占外层的总电子数的75%;第二层有10个电子,占第二层总电子数的25%;第一层的电子数为8个,占第一层总电子数的100%。
由于Ti原子的价层电子排布图较为复杂,因此,可以运用简化的价层电子排布图来描述Ti原子的价层电子排布结构。
简化版的Ti原子价层电子排布图如下:外层2s2 2p6,内层3s2 3p6 3d2。
也就是说,外层由2个1s电子、2个2s电子和6个2p电子组成;内层由2个3s电子、6个3p电子和2个3d电子组成。
钛原子的价层电子排布图,直观地反映了Ti原子的价层电子结构,即外层由2个1s电子、2个2s电子和6个2p电子组成,内层由2个3s电子、6个3p电子和2个3d电子组成。
Ti原子的价层电子排布结构,可以帮助我们更清晰地了解Ti原子的原子构型,也可以帮助我们理解Ti原子的化学性质。
钛原子的价层电子排布图,不仅可以用于描述Ti原子的价层结
构,还可以用于研究Ti原子在物理和化学中的多种性质。

多电子原子的结构首先要了解的是,每个电子都有四个量子数,即主量子数(n)、角量子数(l)、磁量子数(ml)和自旋量子数(ms)。
主量子数决定了电子所处的能级,角量子数决定了电子轨道的形状和能量,磁量子数决定了电子轨道在空间中的取向,而自旋量子数表示电子自旋方向上的差异。
根据波尔的原子模型,多电子原子的结构可以用壳、亚壳、轨道来描述。
壳是由具有相同主量子数的电子的集合组成,亚壳是由具有相同主量子数和角量子数的电子的集合组成,而轨道则是由具有相同主量子数、角量子数和磁量子数的电子的集合组成。
每个壳包含的亚壳数目等于主量子数n的值,而每个亚壳包含的轨道数目等于2l+1,其中l是角量子数的值。
例如,当n=1时,只有一个壳,其中含有一个s亚壳,包含一个s轨道。
当n=2时,有两个壳,其中一个含有一个s亚壳和一个p亚壳,而另一个则只含有一个s亚壳,每个亚壳又包含一个s轨道和三个p轨道。
多电子原子的能级结构比氢原子更加复杂,这是因为电子之间的相互作用会引起能级的分裂。
这种相互作用包括库仑相互作用(电子之间的静电相互作用)和斯塔克效应(电子在外加电场中的行为)。
当电子之间的相互作用不考虑时,多电子原子的能级就是简并的,也就是说,拥有相同主量子数的能级具有相同的能量。
然而,这种简并可以通过考虑相互作用来取消。
由于库仑相互作用,主量子数相同但角量子数不同的亚壳之间的能级发生了分裂。
例如,在n=2的壳中,2s亚壳的能级低于2p亚壳的能级。
同样,角量子数相同但磁量子数不同的轨道之间的能级也发生了分裂。
最后,自旋量子数不同的电子具有不同的能量。
这种由于相互作用引起的能级分裂称为自旋-轨道相互作用。
要描述多电子原子的结构,可以使用一种方法称为Hartree-Fock方法。
在这种方法中,先假设每个电子都处于一个平均势场中,其它所有电子引起的平均势场。
然后,通过求解薛定谔方程来获得每个电子的波函数和能量。
然而,Hartree-Fock方法只能给出近似解,因为它没有考虑到电子之间的动态相关性。
二氧化氮的电子结构二氧化氮是一种由一个氮原子和两个氧原子组成的分子,化学式为NO2、它是一种有毒气体,但在大气中起着重要的作用,是大气中的一个重要组分。
二氧化氮的电子结构如下:氮原子的电子结构为1s22s22p3、氮原子共有7个电子,其中1s轨道上有2个电子,2s轨道上有2个电子,2p轨道上有3个电子。
在二氧化氮中,氮原子提供了一个未成对的电子,这个电子将参与到与氧原子之间的成键中。
氧原子的电子结构为1s22s22p4、氧原子共有8个电子,其中1s轨道上有2个电子,2s轨道上有2个电子,2p轨道上有4个电子。
在二氧化氮中,每个氧原子都提供两个未成对的电子,这两个未成对的电子将与氮原子的未成对电子形成成键。
因此,NO2分子的电子结构可以描述为:一个氮原子提供了一个未成对的电子,两个氧原子分别提供了各自的两个未成对的电子。
这些未成对的电子将参与到氮氧之间的成键中,形成共价键。
NO2分子的Lewis结构如下:O=N=O在这个结构中,氮原子与两个氧原子之间的双键代表氮原子的未成对电子与氧原子的未成对电子之间形成的共价键,而氮原子与每个氧原子之间的单键代表氮原子的未成对电子与每个氧原子的未成对电子形成的共价键。
根据分子轨道理论,NO2分子的分子轨道可以通过氮原子的2s轨道、氮原子的2p轨道和氧原子的2p轨道的线性组合形成。
由于氧原子提供的未成对电子较多,NO2分子中的分子轨道将包含多个有重叠的原子轨道。
这些分子轨道将形成分子键和非键轨道,这些轨道的排布决定了分子的稳定性和反应性。
二氧化氮分子的分子轨道结构是一个复杂的问题,需要使用计算化学的方法进行研究和计算。
总的来说,二氧化氮分子的电子结构是由氮原子和氧原子的原子轨道的线性组合形成的,其中包含多个未成对电子参与到成键中。
这些成键形成了NO2分子的分子结构,使其在化学反应中表现出特定的性质和反应性。
22号元素价电子构型22号元素价电子构型1、22号元素是什么?22号元素是一种重要的非金属元素,也称为锂(Li),它的原子序数为3,是一种5阳离子元素,原子半径为152 pm,质量为6.941。
2、22号元素的特性?22号元素是一种轻量级的单子双电子元素,在电子结构中拥有唯一的一个排列:1s2 2s1。
它具有亲电性,但无明显的磁性,化学性质类似一些无机物,例如氯化物和氧化物。
它也具有溶解性,可溶于水。
3、22号元素价电子构型是什么?22号元素价电子构型指的是它的电子结构排列,它的电子结构中总共有三个电子:一个位于1s的轨道中,另外两个位于2s的轨道中。
由此可以看出,它的价电子构型是:1s2 2s1。
这种构型也是它的典型表现,是一种稳定的构型,融合反应具有明显罚分的能力,特别适用于还原反应。
4、22号元素价电子构型的应用?22号元素价电子构型的应用非常广泛,因为它的原子半径很小,且比较稳定,具有较强的还原能力。
例如,它常被用于制造锂电池、锂锰电池,为家庭电器和手机提供强大、可靠的能量,从而延长使用寿命。
此外,22号元素也被用于电子行业、化学行业等多个领域,用于一系列合成反应和过程,5、22号元素价电子构型的优点?22号元素价电子构型最显著的优点之一是稳定性,因为其电子构型中对称排列的轨道给电子带来的冲击力减小,使电子更容易处于稳定状态;另一个优点是它的化学特性很类似于无机物,这让它在不同的化学反应中展现出更强大的还原能力;最后,它的电子结构中价电子分布较为均匀,使之更容易发生反应,也更容易在高温下稳定。