2011高考化学一轮复习 专题九《溶液中的离子反应·第一单元》 苏教版
- 格式:doc
- 大小:165.50 KB
- 文档页数:17

高中化学学习材料(灿若寒星**整理制作)专题3 溶液中的离子反应第一单元弱电解质的电离平衡温故知新新知预习一、强电解质和弱电解质1.电解质的水溶液能导电,因为它们溶于水后发生________________,产生自由移动的________________。
2.金属与盐酸等酸反应的本质是________________________________________________。
同浓度同体积的醋酸与盐酸分别与Mg反应,盐酸与Mg反应速率明显________________醋酸与Mg的反应速率,pH测定结果盐酸的pH________________醋酸的pH,说明,相同条件时,盐酸电离出来的氢离子浓度________________醋酸电离出来的氢离子浓度。
3.在水溶液中能够________________的电解质称为强电解质,________________、________________和绝大部分________________属于强电解质;在水溶液中只能________________电离的电解质称为弱电解质,________________、________________属于弱电解质。
二、弱电解质的电离平衡1.一定温度下,弱电解质在水溶液中电离达到最大程度时,电离过程并没有________________。
此时弱电解质分子电离速率与离子结合成弱电解质分子的速率________________,溶液中分子和离子的浓度不再发生________________,达到________________状态。
2.在一定温度下,醋酸达到电离平衡时,________________是一常数,称为醋酸的电离平衡常数,通常用________________表示弱酸的电离平衡常数,用________________表示弱碱的电离平衡常数,平衡常数不随________________变化而变化,但弱电解质的________________与电解质溶液的浓度有关。

专题九溶液中的离子反应教学案【课题】第一单元弱电解质的电力平衡(第1~2课时)总第1~2 课时【课标及考纲要求】1. 了解强电解质、弱电解质在水溶液中电离程度的差异,能判断常见的强电解质和弱电解质。
2.了解电离平衡概念,能描述弱电解质在水溶液中的电离平衡。
3.会书写常见弱电解质的电离方程式。
4.了解酸碱电离理论。
【教学重点】铁及其化合物的化学性;【教学难点】Fe3+的氧化性,认识Fe3+ +和Fe2+之间的相互转化;【教学方法】归纳;推理【自主梳理】友情提示:元素化合物知识是化学基本概念和基本理论的载体。
考点1 电解质、非电解质、强电解质、弱电解质等概念辨析【讨论与思考】请指出下列物质中哪些是电解质,哪些是非电解质,哪些既不是电解质也不是非电解质,哪些是强电解质,哪些是弱电解质(填序号),并说出你的判断依据。
⑴H2SO4 ⑵液氨⑶Ca(OH)2 ⑷石墨⑸NH3·H2O ⑹H2O ⑺CH3COONH4⑻C2H5OH ⑼CaCO3 ⑽氨水⑾H3PO4⑿Na2O电解质:判断依据:非电解质:判断依据:既不是电解质也不是非电解质:判断依据:强电解质:判断依据:弱电解质:判断依据:1.电解质和非电解质⑴电解质的概念:常见物质类别:。
⑵非电解质的概念: 常见物质类别:。
【注意】1.电解质和非电解质的范畴都是化合物,所以单质既不是电解质也不是非电解质。
2.化合物为电解质,其本质是自身能电离出离子,有些物质溶于水时所得溶液也能导电,但这些物质自身不电离,而是生成了一些电解质,则这些物质不属于电解质。
如:SO2、SO3、CO2、NO2等。
3.常见电解质的范围:酸、碱、盐、离子型氧化物。
4.溶剂化作用:电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引、相互结合,以―水合离子‖或―水合分子‖的形态存在,这种溶质分子或离子与溶剂相互吸引的作用叫做溶剂作用。
2.强电解质和弱电解质⑴强电解质的概念:常见物质类别:。
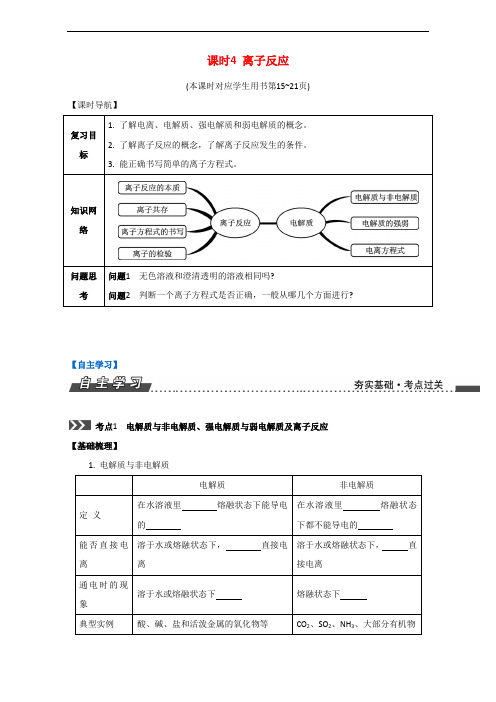
课时4 离子反应(本课时对应学生用书第15~21页)【课时导航】复习目标1. 了解电离、电解质、强电解质和弱电解质的概念。
2. 了解离子反应的概念,了解离子反应发生的条件。
3. 能正确书写简单的离子方程式。
知识网络问题思考问题1无色溶液和澄清透明的溶液相同吗?问题2判断一个离子方程式是否正确,一般从哪几个方面进行?【自主学习】考点1电解质与非电解质、强电解质与弱电解质及离子反应【基础梳理】1. 电解质与非电解质电解质非电解质定义在水溶液里熔融状态下能导电的在水溶液里熔融状态下都不能导电的能否直接电离溶于水或熔融状态下,直接电离溶于水或熔融状态下,直接电离通电时的现象溶于水或熔融状态下熔融状态下典型实例酸、碱、盐和活泼金属的氧化物等CO2、SO2、NH3、大部分有机物2. 强电解质与弱电解质强电解质弱电解质定义电离时电离的电解质电离时电离的电解质电离程度不可逆过程,电离程度为可逆过程,存在电离方程式用“”符号表示H2SO4Ba(OH)2NaHCO3水溶液中:NaHSO4熔融条件下:NaHSO4用“”符号表示NH3·H2OCH3COOHH2CO3HC-3O溶液中存在的粒子(水分子不计) 电离出的,不存在电解质分子既有电离出的阴、阳离子,又有典型实例强酸:HNO3、H2SO4等;强碱:KOH、Ba(OH)2等;绝大多数盐:NaCl、BaSO4、Na2CO3等弱酸:HF、CH3COOH等;弱碱:NH3·H2O、Fe(OH)3等;水3. 离子反应和离子方程式(1) 离子反应:有离子或离子的反应叫离子反应。
离子反应是在溶液中进行的。
(2) 离子方程式①概念:用的离子的符号表示的式子叫离子方程式。
②离子方程式的书写:离子方程式的书写步骤可归纳为四个字:、、、。
③离子方程式的意义:离子方程式能清楚地揭示离子反应的本质,它不仅表示的反应,还表示的离子反应。
微课1离子方程式常见的错因举例错因离子方程式不符合客观事实铁与稀盐酸反应(✕)2Fe+6H+2Fe3++3H2↑(√)Fe+2H+Fe2++H2↑质量不守恒Na2O2溶于水(✕)2Na2O2+2H2O 2Na++2OH-+O2↑(√)2Na2O2+2H2O 4Na++4OH-+O2↑电荷不守恒铜与硝酸银溶液反应(✕)Cu+Ag+Ag+Cu2+ (√)Cu+2Ag+2Ag+Cu2+拆分不正确醋酸溶液与氢氧化钠溶液反应(✕)H++OH-H2O(√)CH3COOH+OH-H2O+CH3COO-漏写离子反应氢氧化钡溶液与硫酸铜溶液反应(✕)Ba2++S BaSO4↓(√)Ba2++S+2OH-+Cu2+BaSO4↓+Cu(OH)2↓得失电子不守恒铝和稀盐酸反应(✕)Al+2H+Al3++H2↑(√)2Al+6H+2Al3++3H2↑化学计量数简化不正确氢氧化钡溶液滴入稀硫酸中(✕)Ba2++OH-+H++S BaSO4↓+H2O (√)Ba2++2OH-+2H++S BaSO4↓+2H2O漏掉“↓”或“↑”(✕)MnO2+4H++2Cl-Mn2++2H2O+Cl2(√)MnO2+4H++2Cl-Mn2++2H2O+Cl2↑“”“”使用不合适(✕)Cl2+H2O Cl-+H++HClO (√)Cl2+H2O Cl-+H++HClO微课2有条件的离子方程式如何书写举例1.往Ca(HCO3)2溶液中加入少量NaOH溶液(把不足的物质当做1 mol,过量的物质需要多少就可以提供多少)1 mol NaOH电离出1 mol OH-最多需要1 mol HCHC+OH-C+H2O 最多需要1 mol Ca2+Ca2++C CaCO3↓总的离子方程式:OH-+HC+Ca2+CaCO3↓+H2O2. 往Ca(HCO3)2溶液中加入过量NaOH溶液(把不足的物质当做1 mol,过量的物质需要多少就可以提供多少)1 mol Ca(HCO3)2电离出1 mol Ca2+和2 mol HC最多需要 2 mol OH-2HC+2OH-2H2O +2C1 mol Ca2+与生成的2 mol C反应生成1 mol CaCO3,剩余1 mol C总的离子方程式:Ca2++2HC+2OH-CaCO3↓+2H2O+C【举题说法】例题1下列关于电解质电离的叙述正确的是()A. 碳酸钙在水中的溶解度很小,其溶液的导电性很弱,所以碳酸钙是弱电解质B. 氢氧化钙微溶于水,但溶解的氢氧化钙全部电离,所以氢氧化钙是强电解质C. 氯气和氨气的水溶液导电性都很好,所以它们是强电解质D. 水难电离,纯水几乎不导电,所以水是非电解质【答案】 B【解析】电解质强弱与溶液导电性没有必然关系,强弱电解质的根本区别在于能否完全电离,碳酸钙溶于水的部分完全电离,所以碳酸钙为强电解质,A错;B正确;氯气为单质,既不是电解质也不是非电解质,氨气的水溶液导电,导电的离子是一水合氨电离的,不是氨气本身电离的,所以氨气为非电解质,C错;水为极弱的电解质,水能够电离出氢离子和氢氧根离子,D错。



高中化学专题3 溶液中的离子反应第一单元弱电解质的电离平衡2 弱电解质的电离平衡学案苏教版选修4编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学专题3 溶液中的离子反应第一单元弱电解质的电离平衡2 弱电解质的电离平衡学案苏教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学专题3 溶液中的离子反应第一单元弱电解质的电离平衡2 弱电解质的电离平衡学案苏教版选修4的全部内容。
弱电解质的电离平衡【考点精讲】1。
电离平衡的建立在一定条件下(如温度、压强等),当弱电解质电离的速率和离子结合成分子的速率相等时,电离过程达到了平衡.2。
电离平衡的特征3。
外界条件对电离平衡的影响①内因:弱电解质本身的性质.②外因:以0-1-+实例(稀溶液)CH3COOH H++CH3COO-ΔH〉0改变条件平衡移动方向n(H+)c(H+)导电能力Ka加水稀释→增大减小减弱不变加入少量冰醋酸→增大增大增强不变加HCl(g)←增大增大增强不变加NaOH(s)→减小减小增强不变加入镁粉→减小减小增强不变升高温度→增大增大增强增大a。
升高温度,电离平衡向电离方向移动,电离程度增大,原因是电离过程吸热。
b。
浓度:加水稀释,使弱电解质的浓度减小,电离平衡向电离的方向移动,电离程度增大。
c. 同离子效应:例如向CH3COOH溶液中加入CH3COONa固体,溶液中c(CH3COO-)增大,CH3COOH 的电离平衡向左(填“左”或“右”)移动,电离程度减小,c(H+)减小,pH值增大。
d。
电离过程是可逆过程,可直接用化学平衡移动原理去分析电离平衡。
深度思考1. 电离平衡右移,电解质分子的浓度一定减小吗?离子的浓度一定增大吗?答案:都不一定。
专题三溶液中的离子反应A卷一、选择题(本题包括12小题。
每题5分,共60分)1.能说明醋酸是弱电解质的事实是()A.醋酸溶液的导电性比盐酸弱B.醋酸溶液与碳酸钙反应,缓慢放出二氧化碳C.醋酸溶液用水稀释后,溶液的pH增大D.0.1 mol·L-1的醋酸溶液中,氢离子浓度约为0.001 mol·L-12.若t℃时水的离子积常数为1×10-12mol2·L-2。
t℃时,下列叙述正确的是(多选)()A.pH为7的溶液为中性B.100 mL 0.01 mol·L-1盐酸的pH为2C.100 mL 0.01 mol·L-1NaOH的pH为12D.pH为7的溶液为碱性3.一定温度下,用水稀释c mol·L-1的稀醋酸,若用K W表示水的离子积,则下列数值随水量的增加而增大的是()A.c(CH3COO-)/c(CH3COOH)B.c(CH3COOH)/c(H+)C.c(H+)/c(OH-)D.c(H+)/K W4.(天津耀华中学5月)已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2。
就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是()A.Mg2++2HCO3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2OB.Cu2++H2S===CuS↓+2H+C.Zn2++S2-+2H2O===Zn(OH)2↓+H2S↑D.FeS+2H+===Fe2++H2S↑5.(全国高考)0.1 mol/L NaHCO3溶液的pH最接近于()A.5.6 B.7.0C.8.4 D.13.06.在由水电离产生的H+的浓度为1×10-13mol/L的溶液中,一定能大量共存的离子组是()①K+、Cl-、NO3-、S2-②K+、Fe2+、I-、SO42-③Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3-⑤K+、Ba2+、Cl-、NO3-A.①③B.③⑤C.③④D.②⑤7.下列离子方程式的书写正确的是()A.硫化钠水解:S2-+2H2O H2S↑+2OH-B.硫氢化钠水解:HS-+H2O H3O++S2-C.硫化钾水解:S2-+H2O===HS-+OH-D.硫酸铝溶液跟偏铝酸钠溶液反应:Al3++3AlO2-+6H2O===4Al(OH)3↓8.将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是()A.c(NH4+)>c(Cl-)>c(H+)>c(OH-)B.c(NH4+)>c(Cl-)>c(OH-)>c(H+)C.c(Cl-)>c(NH4+)>c(OH-)>c(H+)D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)9.(四川高考)在25 ℃时,将pH=11的NaOH溶液与pH=3的CH3COOH 溶液等体积混合后,下列关系式中正确的是()A.c(Na+)=c(CH3COO-)+c(CH3COOH)B.c(H+)=c(CH3COO-)+c(OH-)C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)10.在BaSO4饱和溶液中,加入Na2SO4(s)达平衡时()A.c(Ba2+)=c(SO42-)B.c(Ba2+)=c(SO42-)=[K ap(BaSO4)]1 2C.c(Ba2+)≠c(SO42-),c(Ba2+)·c(SO42-)=K sp(BaSO4) D.c(Ba2+)≠c(SO42-),c(So42-)≠K sp(BaSO4)11.实验室用标准盐酸测定NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是()A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失C.锥形瓶内溶液颜色由黄色变橙色,立即记下滴定管内液面所在刻度D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次12.下图是对10 mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH 溶液滴定的图象,依据图象推出盐酸和NaOH溶液的物质的量浓度是下表内各组中的()A B C Dc(HCl)/mol·L-10.12 0.04 0.03 0.09c(NaOH)/mol·L-10.04 0.12 0.09 0.0313.(8分)(2009年龙岩高二质检)室温下,pH=2的某酸H n A(A n-为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为8。
溶液中离子浓度关系1.0.02 mol/L HCN溶液与0.02 mol/L NaCN溶液等体积混合,已知混合溶液c(CN-)<c(Na+),则下列关系正确的是()A.c(Na+)>c(CN-)>c(OH-)>c(H+) B.c(HCN)+c(CN-)=0.04 mol/LC.c(OH-)=c(H+)+c(HCN) D.c(CN-)>c(HCN)解析:根据电荷守恒有c(Na+)+c(H+)=c(OH-)+c(CN-),因c(Na+)>c(CN-),得c(H+)<c(OH-),A正确;混合后c(HCN)+c(CN-)=0.02 mol/L,B不正确;根据质子守恒,NaCN溶液中c(OH-)=c(H+)+c(HCN),但是本题溶液中本身含有HCN,必有c(OH-)<c(H+)+c(HCN),C不正确;CN-+H2O HCN+OH-,溶液中存在HCN,若HCN以电离为主,则有c(CN-)>c(Na+),与题意相悖,故以水解为主,必有c(HCN)>c(CN-),D不正确。
答案:A2.NH3·H2O的电离平衡常数为K=[NH+4][OH-][NH3·H2O]。
氨水中各离子和分子的浓度大小关系为()A.c(NH+4)=c(OH-)=c(NH3·H2O) B.c(NH+4)>c(OH-)>c(NH3·H2O)C.c(NH+4)=c(OH-)<c(NH3·H2O) D.c(NH+4)<c(OH-)<c(NH3·H2O)解析:由于NH3·H2O的电离是微弱的,故c(OH-)<c(NH3·H2O),c(NH+4)<c(NH3·H2O),在NH3·H2O的电离中c(NH+4)=c(OH-),由于水电离出一部分OH-,故最终溶液中c(NH+4)<c(OH-),所以c(NH+4)<c(OH -)<c(NH3·H2O)。
高三化学苏教版复习讲义第1部分专题2 第1单元离子反应离子方第一单元离子反应离子方程式考纲定位 1.了解电解质的概念;了解强电解质和弱电解质的概念。
2.理解电解质在水溶液中的电离以及电解质溶液的导电性。
3.了解离子反应的概念、离子反应发生的条件。
4.能正确书写离子方程式,并能进行相关计算。
核心素养 1.微观探析――从离子间的反应认识离子反应的实质。
2.证据推理――从化学反应条件、环境等方面推出离子发生反应的条件。
3.模型认知――能正确依据离子及其变化信息建构书写离子方程式模式。
4.科学探究――根据离子的性质和实验目的能设计并优化实验方案,完成实验操作,能观察现象记录探究成果。
考点一| 电解质的分类和电离1.电解质和非电解质 (1)分类依据(2)电解质的强弱与物质类别的关系强电解质―强酸、强碱、绝大多数盐,如HNO3、NaOH、CaCO3等。
|弱电解质―弱酸、弱碱和水,如乙酸、一水合氨等。
[深度归纳] 常见酸、碱的强弱ⅠA 除LiOH外其余都是强碱 1ⅡA ⅢA ⅣA 除Mg(OH)2、Be(OH)2外其余都是强碱 Al(OH)3是两性氢氧化物 H2CO3、H2SiO3均为弱酸强酸:HNO3;中强(或弱)酸:HNO2、H3PO4;弱碱:NH3・H2O ⅤA ⅥA强酸:H2SO4;弱酸:H2SO3、H2S 强酸:HCl、HBr、HI、HClO4等ⅦA 弱酸:HF、HClO等过渡元素中 Fe(OH)3、Fe(OH)2、Cu(OH)2、AgOH等常见的弱碱 2.电解质的电离 (1)电离是指电解质在水溶液里或熔融状态下,产生能够自由移动离子的过程。
(2)电离方程式的书写①强电解质的电离方程式中,用“===”连接,弱电解质(包括弱酸的酸式酸根)的电离方程式中,用“”连接。
2-如Na2SO4:Na2SO4===2Na++SO4;HClO:HClOH++ClO-。
②多元弱酸的电离分步书写,多元弱碱的电离一步写出。
专题九溶液中的离子反应第一单元弱电解质的电离平衡1.90℃时水的离子积K W=3.8×10-13 mol2·L-2,该温度时纯水的pH()A.等于7 B.介于6~7之间C.大于7 D.无法确定解析:90℃时纯水中的c(H+)= 3.8×10-13=10-7×38,pH=-lg[c(H+)]=-lg(10-7×38)=7-lg38,因其大于6,小于7,故选B。
答案:B2. 纯水在25℃时的氢离子浓度与90℃时的氢离子浓度的关系是()A.大于B.等于C.小于D.不能肯定解析:水的电离过程是吸热的,所以90℃时纯水电离出的c(H+)和c(OH-)比25℃时纯水电离出的c(H+)和c(OH-)大。
答案:C3.水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是() A.1×1014B.55.6×107C.1×107D.55.6解析:根据常温时,1 L(1 00018mol)水中只有1×10-7 mol的水电离,可以确定如下关系:1 00018mol×N A~1×10-7 mol×N An 1解得n=55.6×107。
答案:B4.pH相同的醋酸和盐酸,分别用蒸馏水稀释至原来体积的m倍和n倍。
稀释后的溶液的pH仍相等,则m和n的关系是()A.m>n B.m=n C.m<n D.不能确定解析:pH相同的CH3COOH和HCl,当稀释相同的倍数时,因醋酸电离平衡右移,CH3COOH的pH较小,若要稀释至两者pH相等,则要求m>n。
答案:A5.pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,则混合液的pH为() A.7.2 B.8 C.6 D.无法计算解析:pH=5的盐酸溶液中c(H+)=10-5 mol·L-1,pH=9的氢氧化钠溶液中c(OH-)=10-5 mol·L-1,两者以体积比11∶9混合,则酸过量,混合液的pH小于7。
答案:C6.(2009·重庆理综,10)物质的量浓度相同的下列溶液,pH由大到小排列正确的是() A.Ba(OH)2、Na2SO3、FeCl3、KCl B.Na2SiO3、Na2CO3、KNO3、NH4ClC.NH3·H2O、H3PO4、Na2SO4、H2SO4D.NaHCO3、C6H5COOH、C2H5OH、HCl解析:A项,FeCl3水解使溶液呈酸性,比KCl溶液的pH小;C项,Na2SO4溶液呈中性,H3PO4为中强酸;D项,C6H5COOH溶液呈酸性,C2H5OH溶液呈中性。
答案:B7.常温下,在pH=12的某碱溶液中,由水电离出的c(OH-)为()A.1.0×10-7 mol/L B.1.0×10-6 mol/LC.1.0×10-3 mol/L D.1.0×10-12 mol/L解析:由水电离的c(H+)=10-pH=1.0×10-12 mol/L,由水电离出的c(OH-)等于由水电离出的c(H+),所以,c(OH-)也等于1.0×10-12 mol/L。
答案:D8.在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如右图所示。
请回答下列问题:(1)曲线Ⅰ代表的温度下,水的离子积为__________,曲线Ⅰ所代表的温度________(填“高于”、“低于”或“等于”)曲线Ⅱ所代表的温度。
你判断的依据是________________________________________________________________________。
(2)曲线Ⅰ所代表的温度下,0.01 mol/L的NaOH溶液的pH为________________________________________________________________________。
解析:(1)根据曲线中的数据,可以知道曲线Ⅰ代表的温度下水的离子积为1×10-12,水的电离过程是吸热过程,温度越高,水的离子积就越大,曲线Ⅰ所代表的离子积比曲线Ⅱ的大,所以,曲线Ⅰ代表的温度高。
(2)曲线Ⅰ所代表水的离子积为1×10-12,0.01 mol/L的NaOH溶液中c(OH-)=10-2 mol/L,则c(H+)=10-10mol/L,pH=10。
答案:(1)1×10-12 mol2·L-2高于曲线Ⅱ所代表的离子积比曲线Ⅰ的小,由于水的电离过程是吸热过程,温度越高,水的离子积越大,故曲线Ⅱ代表的温度低(2)109.(1)能否用pH试纸测氯水的pH?_____________________________________________。
(2)只从下列试剂中选择实验所需的试剂,你能否区分0.1 mol/L的H2SO4和0.01 mol/L的H2SO4,简述操作过程。
试剂:①紫色石蕊试液②酚酞试液③甲基橙溶液④蒸馏水⑤BaCl2溶液⑥pH试纸________________________________________________________________________。
解析:(1)由于氯水有漂白性,所以不能用pH试纸测定氯水的pH。
(2)可通过测定溶液的pH区分0.1 mol/L和0.01 mol/L的H2SO4溶液。
答案:(1)不能(2)能;把两片pH试纸放在表面皿上,用玻璃棒分别蘸取两种溶液滴在两张pH试纸上,用标准比色卡比较pH,pH较小的为0.1 mol/L的H2SO410. 在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则(1)该温度下水的离子积常数K W=________。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L。
(3)在该温度下,将100 mL 0.1 mol/L 的稀硫酸与100 mL 0.4 mol/L 的NaOH 溶液混合后,溶液的pH =________。
解析:由c (H +)=10-a mol/L ,c (OH -)=10-b mol/L 和a +b =12,可知K W =c (H +)×c (OH -)=10-12 mol 2·L-2;该NaOH 溶液的物质的量浓度的精确值是溶液的c (OH -)与水电离的c (OH -)之差,即10-b -10-a ;在该温度下,将100 mL 0.1 mol/L 的稀硫酸与100 mL 0.4 mol/L 的NaOH 溶液混合后,NaOH 过量,c (OH -)=0.1 L ×0.4 mol/L -0.1 L ×0.2 mol/L 0.2 L=10-1 mol/L ,K W =c (H +)×c (OH -)=10-12 mol 2·L -2,则c (H +)=10-11 mol/L ,进一步求出溶液的pH =11。
答案:(1)10-12mol 2·L -2 (2)10-b -10-a (3)1111.某温度(t ℃)时,水的离子积为K W =1×10-13mol 2·L -2,则该温度(填“大于”、“小于”或“等于”)________25℃,其理由是________________________________________________________________________。
若将此温度下pH =11的苛性钠溶液a L 与pH =1的稀硫酸b L 混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比: (1)若所得混合液为中性,则a ∶b =________。
(2)若所得混合液的pH =2,则a ∶b =__________。
此溶液中各种离子的浓度由大到小排列顺序是____________。
解析:K W 随温度升高而增大,本题温度为高于25℃。
(1)H 2SO 4中,c (H +)=0.1 mol/L ,则NaOH 溶液中c (OH -)=10-1310-11=0.010.01 mol/L ×a L =0.1 mol/L ×b L ,a ∶b =10∶1(2)若pH =2,则c (H +)混=0.1 mol/L ×b L -0.01 mol/L ×a La +b=0.01 mol/L ,a ∶b =9∶2离子浓度关系:假如原来NaOH 溶液为9 L ,H 2SO 4溶液则为2 L ,n (Na +)=0.01 mol/L ×9 L =0.09 mol ,剩余n (H +)=0.01 mol/L ×(9 L +2 L)=0.11 moln (SO 2-4)=0.1 mol/L 2×2 L =0.1 mol ,所以:c (H +)>c (SO 2-4)>c (Na +)>c (OH -)答案:大于 室温时水的K W =1×10-14mol 2·L -2,小于10-13,水的电离是吸热的,升温时水的电离平衡正向移动,K W 增大 (1)10∶1 (2)9∶2 c (H +)>c (SO 2-4)>c (Na +)>c (OH -) 12.下表是不同温度下水的离子积常数:试回答以下问题:(1)若25<t 1<t 2,则a __________1×10-14mol 2·L-2(填“>”、“<”或“=”),做此判断的理由是______________________________________________________________________。
(2)25℃时,某Na 2SO 4溶液中c (SO 2-4)=5×10-4mol/L ,取该溶液1 mL 加水稀释至10 mL ,则稀释后溶液中c (Na +)∶c (OH -)=__________。
(3)t 2℃时,将pH =11的苛性钠溶液V 1 L 与pH =1的稀硫酸V 2 L 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V 1∶V 2=________。
此溶液中各种离子的浓度由大到小的顺序是____________。
解析:(1)25<t 1<t 2,温度升高,促进水的电离,c (H +)=c (OH -)>1×10-7 mol/L , 所以K W >1×10-14 mol 2·L -2。