第3章 烯烃和炔烃(1)
- 格式:pdf
- 大小:2.04 MB
- 文档页数:34









高中烯烃炔烃知识点总结一、高中烯烃和炔烃的化学性质1. 烯烃的化学性质烯烃是内饱和烃的一类,其分子中含有一个碳原子间的双键。
烯烃的化学性质主要表现在加成反应上,例如:(1)烯烃与溴水反应烯烃和溴水(Br2)在室温下都可以发生加成反应,生成溴代烷。
(2)烯烃与酸的酸化反应烯烃可以和酸反应,生成酸酯化合物。
(3)烯烃和卤化氢气体反应烯烃和卤化氢气体(HCl、HBr等)可以发生加成反应,生成卤代烷。
(4)烯烃和过氧化氢反应烯烃和过氧化氢(H2O2)反应会发生氧化反应,生成醇和脂肪醛。
2. 炔烃的化学性质炔烃是一类碳氢化合物,其分子中含有一个碳原子间的三键。
炔烃的化学性质主要表现在加成反应和氧化反应上,例如:(1)炔烃与溴水反应炔烃和溴水(Br2)可以发生加成反应,生成溴代烷。
(2)炔烃与酸的酸化反应炔烃和酸反应可以生成酸酐。
(3)炔烃和卤化氢气体反应炔烃和卤化氢气体(HCl、HBr等)反应会发生加成反应,生成卤代烃。
(4)炔烃和过氧化氢反应炔烃和过氧化氢(H2O2)反应会发生氧化反应,生成酮和醛。
二、高中烯烃和炔烃的物理性质1. 烯烃的物理性质烯烃的主要物理性质包括色泽、气味、沸点和溶解度等。
(1)色泽和气味一般情况下,烯烃是无色无味的液体或气体,在室温下呈无色透明,有些具有特殊的气味。
(2)沸点和溶解度烯烃的沸点一般低于相应的饱和烃,且烯烃通常具有较好的溶解度,可以溶解在非极性溶剂中。
2. 炔烃的物理性质炔烃的主要物理性质也包括色泽、气味、沸点和溶解度等。
(1)色泽和气味炔烃大多是无色无味的液体或气体,在室温下呈无色透明,有些具有特殊的气味。
(2)沸点和溶解度炔烃的沸点一般低于相应的饱和烃,且炔烃通常具有较好的溶解度,可以溶解在非极性溶剂中。
三、高中烯烃和炔烃的应用1. 烯烃的应用烯烃在工业生产中有着广泛的应用,其中乙烯是一种重要的有机化工原料,主要用于合成乙烯聚合物。
另外,烯烃还可以用于合成醇、醛、酮等有机物,制备胶粘剂、颜料、染料等化工产品。
第三章不饱和烃:烯烃和炔烃♦烯烃/炔烃的结构、同分异构和命名;烯烃炔烃的化学性质;♦/♦烯烃亲电加成反应的历程和马氏规则;♦乙烯氢和烯丙氢的含义和反应特点;♦掌握烯烃的自由基加成反应。
♦烯烃的系统命名法;♦烯烃的亲电加成反应和马氏规则、氧化反应。
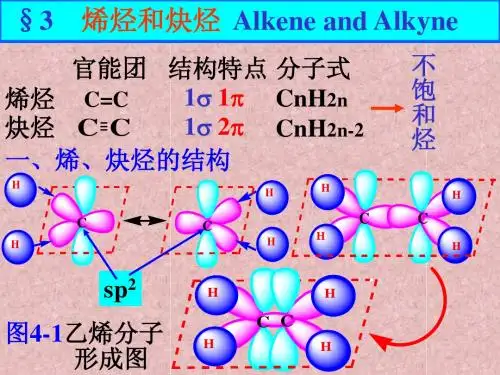
3.1 烯烃和炔烃的结构3.1.1碳碳双键的组成 3.1.1 碳碳双键的组成含有碳碳双键的不饱和烃叫做烯烃,单烯烃分子中只有一个双键;碳碳双键叫做烯键, 是烯烃的官能团。
单烯烃的通式是C n H 2n ;H H CC 最简单的烯烃是乙烯:HH C C)一) 乙烯的结构H 1170.108nm H H 0.133nm 物理方法证明: 1. 所有碳原子和氢原子共平面;键角接2. 键角接近120°;3.双键键长0.133nm 比单键键长0.154nm 短;4. 双键键能611kJ/mol 小于单键键能两倍347×2=694 kJ/mol347264kJ/l611-347 =264 kJ/mol二)碳原子的SP 2C 2p 2p激发2s 2s2p 2p sp 2杂化sp 2 C = C sp 2-sp 2 σ键2p 2p 2p-2p π键{2>C 3电负性:C sp C sp二) 双键的结构π键不同于σ键, π键具有以下特点:1.π键无轴对称, 不能自由旋转;2. π键键能比σ键能小;611-347=264kJ/mol 3. π电子云具有流动性;C=C 键能C-C 键能破坏π键的能量π电子云位于成键原子的上下两层, 原子核对π电子云的束缚能力弱, 因此, π键易被试CC 剂进攻发生反应, π键比σ键更活泼。
3.1.2 碳碳三键的组成炔烃的结构乙炔是最简单的炔烃, 为线型分子。
H C C H炔烃的官能团是碳碳三键, 碳原子是sp杂化, 两个sp轨道在同一条直线上。
碳碳三键的特点:①炔烃的亲电加成活性不如烯烃。
原因:两个碳原子之间电子云密度大;C-C 键长短, 使π键的重叠程度大;②碳碳三键上的氢炔-H 有一定的酸性。
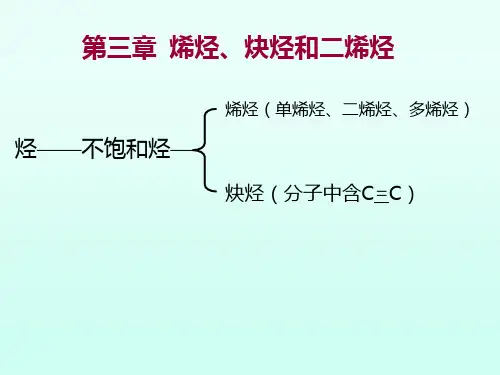
第三章烯烃、炔烃和二烯烃第一节烯烃和炔烃单烯烃是指分子中含有一个C=C的不饱和开链烃,简称烯烃.通式为C n H2n。
炔烃是含有(triple bond) 的不饱和开链烃。
炔烃比碳原子数目相同的单烯烃少两个氢原子,通式CnH2n-2。
一、烯烃和炔烃的结构乙烯是最简单的烯烃, 乙炔是最简单的炔烃,现已乙烯和乙炔为例来讨论烯烃和炔烃的结构。
(一)乙烯的结构分子式为C2H4,构造式H2C=CH2,含有一个双键C=C,是由一个σ 键和一个π 键构成。
现代物理方法证明,乙烯分子的所有原子都在同一平面上,每个碳原子只和三个原子相连.杂化轨道理论根据这些事实,设想碳原子成键时,由一个s轨道和两个p轨道进行杂化,组成三个等同的sp2杂化轨道,sp2轨道对称轴在同一平面上, 彼此成1200角.此外,还剩下一个2p轨道,它的对称轴垂直于sp2轨道所在的平面。
乙烯:C-C σ键4C-H σ键在乙烯分子中,两个碳原子各以一个sp2轨道重叠形成一个C-Cσ键,又各以两个sp2轨道和四个氢原子的1s轨道重叠,形成四个C-Hσ键,五个σ键都在同一平面上。
每个碳原子剩下的一个py轨道,它们平行地侧面重叠,便组成新的分子轨道,称为π轨道。
其它烯烃的双键也都是由一个σ键和一个π键组成的。
双键一般用两条短线来表示,如:C=C,但两条短线含义不同,一条代表σ键,另一条代表π 键。
π键重叠程度比σ键小,不如σ键稳定,比较容易破裂。
(二)乙炔的结构乙炔的分子式是C2H2,构造式H-C≡C-C,碳原子为sp 杂化。
两个sp杂化轨道向碳原子核的两边伸展,它们的对称轴在一条直线上,互成180°。
在乙炔分子中,两个碳原子各以一个sp轨道互相重叠,形成一个C-Cσ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠形成C-Hσ键。
此外,每个碳原子还有两个互相垂直的未杂化的p轨道(px,py),它们与另一碳的两个p轨道两两相互侧面重叠形成两个互相垂直的π键。