第三章烯烃和炔烃
- 格式:ppt
- 大小:3.80 MB
- 文档页数:170










烯烃与炔烃的知识点总结一、结构1. 烯烃的结构烯烃是一类碳氢化合物,其分子中含有碳-碳双键,通式为CnH2n。
烯烃的分子式可以表示为CnH2n,其中n为分子中碳原子的个数。
烯烃的普遍结构式为RCH=CHR',其中R和R'分别是烃基。
烯烃分为直链烯烃和支链烯烃两种,其结构式分别为RCH=CHR'和RR'C=CHR'。
直链烯烃和支链烯烃的碳原子排列不同,因而其物理性质和化学性质也有所区别。
2. 炔烃的结构炔烃是一类碳氢化合物,其分子中含有碳-碳三键,通式为CnH2n-2。
炔烃的分子式可以表示为CnH2n-2,其中n为分子中碳原子的个数。
炔烃的分子结构式为RC≡CR',其中R 和R'分别是烃基。
炔烃分为直链炔烃和支链炔烃两种,其结构式分别为RC≡CR'和RRC≡CR'。
和烯烃一样,直链炔烃和支链炔烃的物理性质和化学性质也有所区别。
二、物理性质1. 烯烃的物理性质烯烃通常是无色、有味或挥发性液体。
烯烃的沸点较烷烃高,密度小于水。
烯烃在一定温度下能燃烧,产生碳 dioxide、水和热。
烯烃对氧化质子有较高的活性,容易与氢气或卤素发生加成反应。
由于其含有双键,烯烃通常会发生立体异构现象。
此外,烯烃还可以与酸、醇、醛或酮等发生加成反应,生成醚、醇、胺等不同的功能团。
2. 炔烃的物理性质炔烃通常是无色、易燃的气体或液体,密度小于水。
炔烃的火焰温度较高,燃烧后会产生大量的光和热。
炔烃容易与氢气和卤素发生加成反应,生成炔烃的立体异构。
由于其含有三键,炔烃在化学反应中具有较高的活性,可以与酸、醇、醛或酮发生加成反应,生成多种功能团。
三、化学性质1. 烯烃的化学性质烯烃是一类具有较高反应活性的有机化合物。
烯烃在加成反应中容易发生立体异构,生成不同的加成产物。
烯烃可以在氧化剂的作用下发生氧化反应,生成醇或醛。
此外,烯烃还可以与卤素发生卤代反应,生成卤代烃。
第三章烯烃炔烃二烯烃Ⅰ学习要求1. 了解不饱和烃的结构特点,熟练掌握烯烃、炔烃、二烯烃及烯烃顺反异构体的系统命名。
2. 掌握不饱和烃的化学反应及其应用,熟练掌握应用亲电加成反应历程,马氏规则及其影响因素判断加成反应的主要产物(或方向)。
3. 了解共轭体系的类型,掌握应用诱导效应和共轭效应判断亲电加成反应的速率。
4. 掌握鉴别烯烃、炔烃的化学方法。
5. 掌握各类碳正离子的稳定性顺序。
Ⅱ内容提要一.不饱和烃的结构1. 烯烃的官能团是碳碳双键,形成双键的两个碳原子是sp2杂化。
碳碳双键是由一个碳碳σ键和一个碳碳π键组成,具有刚性,不能绕碳碳双键自由旋转。
π键的键能较小,易被极化,容易和亲电试剂发生亲电加成反应。
2. 在炔烃分子中碳碳叁键是官能团,形成叁键的两个碳原子是sp杂化,碳碳叁键是直线型,其中两个π键相互垂直。
sp杂化的碳原子的电负性较sp2杂化的碳原子电负性大,所以炔烃中的π键比烯烃的π键较难极化,亲电加成反应炔烃较烯烃难。
3. 共轭二烯烃在结构特征上是指碳碳单键和碳碳双键交替排列的情况。
即分子中有四个sp2杂化的碳原子依次相连,称做共轭链。
共轭二烯烃的四个sp2碳原子共存在于同一平面,形成两个π键的四个p轨道相互平行,π键电子可在共轭链上离域,这种共轭体系的π键又称离域大π键。
它更易极化,亲电反应活性高于独立的π键。
4. 共轭体系是指在分子、离子或自由基中能够形成π键或p轨道离域的体系,在共轭体系中π键电子或p轨道电子不是定域,而是离域的。
这种电子在共轭体系中离域并传递的电子效应称共轭效应。
共轭体系与非共轭体系相比较,具有较低的热力学能,有较高的化学反应活性和特有的化学性质,存在有键长平均化现象。
共轭体系又具体分为:π–π共轭体系、p–π共轭体系、p–p共轭体系、σ–π超共轭体系和σ–p超共轭体系。
5. 共轭效应是指π键电子或p轨道电子在共轭体系中间离域并传递而产生的电子效应,仅存在于共轭体系中;诱导效应则是指σ键电子在σ键中偏移并传递的电子效应,存在于所有的极性σ键中。
第三章烯烃、炔烃和二烯烃第一节烯烃和炔烃单烯烃是指分子中含有一个C=C的不饱和开链烃,简称烯烃.通式为C n H2n。
炔烃是含有(triple bond) 的不饱和开链烃。
炔烃比碳原子数目相同的单烯烃少两个氢原子,通式CnH2n-2。
一、烯烃和炔烃的结构乙烯是最简单的烯烃, 乙炔是最简单的炔烃,现已乙烯和乙炔为例来讨论烯烃和炔烃的结构。
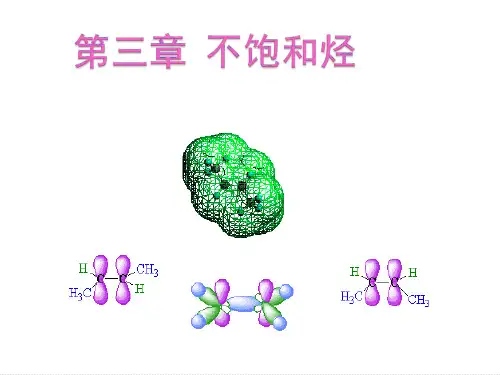
(一)乙烯的结构分子式为C2H4,构造式H2C=CH2,含有一个双键C=C,是由一个σ 键和一个π 键构成。
现代物理方法证明,乙烯分子的所有原子都在同一平面上,每个碳原子只和三个原子相连.杂化轨道理论根据这些事实,设想碳原子成键时,由一个s轨道和两个p轨道进行杂化,组成三个等同的sp2杂化轨道,sp2轨道对称轴在同一平面上, 彼此成1200角.此外,还剩下一个2p轨道,它的对称轴垂直于sp2轨道所在的平面。
乙烯:C-C σ键4C-H σ键在乙烯分子中,两个碳原子各以一个sp2轨道重叠形成一个C-Cσ键,又各以两个sp2轨道和四个氢原子的1s轨道重叠,形成四个C-Hσ键,五个σ键都在同一平面上。
每个碳原子剩下的一个py轨道,它们平行地侧面重叠,便组成新的分子轨道,称为π轨道。
其它烯烃的双键也都是由一个σ键和一个π键组成的。
双键一般用两条短线来表示,如:C=C,但两条短线含义不同,一条代表σ键,另一条代表π 键。
π键重叠程度比σ键小,不如σ键稳定,比较容易破裂。
(二)乙炔的结构乙炔的分子式是C2H2,构造式H-C≡C-C,碳原子为sp 杂化。
两个sp杂化轨道向碳原子核的两边伸展,它们的对称轴在一条直线上,互成180°。
在乙炔分子中,两个碳原子各以一个sp轨道互相重叠,形成一个C-Cσ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠形成C-Hσ键。
此外,每个碳原子还有两个互相垂直的未杂化的p轨道(px,py),它们与另一碳的两个p轨道两两相互侧面重叠形成两个互相垂直的π键。