第三章 烯烃和炔烃
- 格式:doc
- 大小:51.00 KB
- 文档页数:5










烯烃与炔烃的知识点总结一、结构1. 烯烃的结构烯烃是一类碳氢化合物,其分子中含有碳-碳双键,通式为CnH2n。
烯烃的分子式可以表示为CnH2n,其中n为分子中碳原子的个数。
烯烃的普遍结构式为RCH=CHR',其中R和R'分别是烃基。
烯烃分为直链烯烃和支链烯烃两种,其结构式分别为RCH=CHR'和RR'C=CHR'。
直链烯烃和支链烯烃的碳原子排列不同,因而其物理性质和化学性质也有所区别。
2. 炔烃的结构炔烃是一类碳氢化合物,其分子中含有碳-碳三键,通式为CnH2n-2。
炔烃的分子式可以表示为CnH2n-2,其中n为分子中碳原子的个数。
炔烃的分子结构式为RC≡CR',其中R 和R'分别是烃基。
炔烃分为直链炔烃和支链炔烃两种,其结构式分别为RC≡CR'和RRC≡CR'。
和烯烃一样,直链炔烃和支链炔烃的物理性质和化学性质也有所区别。
二、物理性质1. 烯烃的物理性质烯烃通常是无色、有味或挥发性液体。
烯烃的沸点较烷烃高,密度小于水。
烯烃在一定温度下能燃烧,产生碳 dioxide、水和热。
烯烃对氧化质子有较高的活性,容易与氢气或卤素发生加成反应。
由于其含有双键,烯烃通常会发生立体异构现象。
此外,烯烃还可以与酸、醇、醛或酮等发生加成反应,生成醚、醇、胺等不同的功能团。
2. 炔烃的物理性质炔烃通常是无色、易燃的气体或液体,密度小于水。
炔烃的火焰温度较高,燃烧后会产生大量的光和热。
炔烃容易与氢气和卤素发生加成反应,生成炔烃的立体异构。
由于其含有三键,炔烃在化学反应中具有较高的活性,可以与酸、醇、醛或酮发生加成反应,生成多种功能团。
三、化学性质1. 烯烃的化学性质烯烃是一类具有较高反应活性的有机化合物。
烯烃在加成反应中容易发生立体异构,生成不同的加成产物。
烯烃可以在氧化剂的作用下发生氧化反应,生成醇或醛。
此外,烯烃还可以与卤素发生卤代反应,生成卤代烃。
第三章烯烃炔烃二烯烃Ⅰ学习要求1. 了解不饱和烃的结构特点,熟练掌握烯烃、炔烃、二烯烃及烯烃顺反异构体的系统命名。
2. 掌握不饱和烃的化学反应及其应用,熟练掌握应用亲电加成反应历程,马氏规则及其影响因素判断加成反应的主要产物(或方向)。
3. 了解共轭体系的类型,掌握应用诱导效应和共轭效应判断亲电加成反应的速率。
4. 掌握鉴别烯烃、炔烃的化学方法。
5. 掌握各类碳正离子的稳定性顺序。
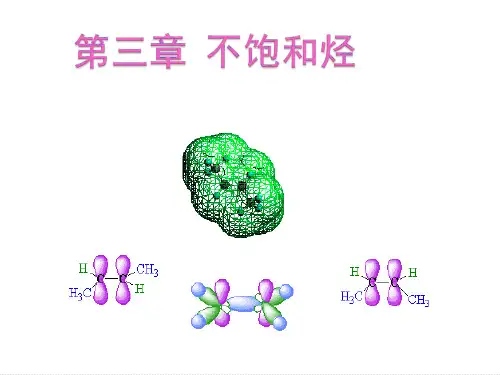
Ⅱ内容提要一.不饱和烃的结构1. 烯烃的官能团是碳碳双键,形成双键的两个碳原子是sp2杂化。
碳碳双键是由一个碳碳σ键和一个碳碳π键组成,具有刚性,不能绕碳碳双键自由旋转。
π键的键能较小,易被极化,容易和亲电试剂发生亲电加成反应。
2. 在炔烃分子中碳碳叁键是官能团,形成叁键的两个碳原子是sp杂化,碳碳叁键是直线型,其中两个π键相互垂直。
sp杂化的碳原子的电负性较sp2杂化的碳原子电负性大,所以炔烃中的π键比烯烃的π键较难极化,亲电加成反应炔烃较烯烃难。
3. 共轭二烯烃在结构特征上是指碳碳单键和碳碳双键交替排列的情况。
即分子中有四个sp2杂化的碳原子依次相连,称做共轭链。
共轭二烯烃的四个sp2碳原子共存在于同一平面,形成两个π键的四个p轨道相互平行,π键电子可在共轭链上离域,这种共轭体系的π键又称离域大π键。
它更易极化,亲电反应活性高于独立的π键。
4. 共轭体系是指在分子、离子或自由基中能够形成π键或p轨道离域的体系,在共轭体系中π键电子或p轨道电子不是定域,而是离域的。
这种电子在共轭体系中离域并传递的电子效应称共轭效应。
共轭体系与非共轭体系相比较,具有较低的热力学能,有较高的化学反应活性和特有的化学性质,存在有键长平均化现象。
共轭体系又具体分为:π–π共轭体系、p–π共轭体系、p–p共轭体系、σ–π超共轭体系和σ–p超共轭体系。
5. 共轭效应是指π键电子或p轨道电子在共轭体系中间离域并传递而产生的电子效应,仅存在于共轭体系中;诱导效应则是指σ键电子在σ键中偏移并传递的电子效应,存在于所有的极性σ键中。
第三章烯烃、炔烃和二烯烃第一节烯烃和炔烃单烯烃是指分子中含有一个C=C的不饱和开链烃,简称烯烃.通式为C n H2n。
炔烃是含有(triple bond) 的不饱和开链烃。
炔烃比碳原子数目相同的单烯烃少两个氢原子,通式CnH2n-2。
一、烯烃和炔烃的结构乙烯是最简单的烯烃, 乙炔是最简单的炔烃,现已乙烯和乙炔为例来讨论烯烃和炔烃的结构。
(一)乙烯的结构分子式为C2H4,构造式H2C=CH2,含有一个双键C=C,是由一个σ 键和一个π 键构成。
现代物理方法证明,乙烯分子的所有原子都在同一平面上,每个碳原子只和三个原子相连.杂化轨道理论根据这些事实,设想碳原子成键时,由一个s轨道和两个p轨道进行杂化,组成三个等同的sp2杂化轨道,sp2轨道对称轴在同一平面上, 彼此成1200角.此外,还剩下一个2p轨道,它的对称轴垂直于sp2轨道所在的平面。
乙烯:C-C σ键4C-H σ键在乙烯分子中,两个碳原子各以一个sp2轨道重叠形成一个C-Cσ键,又各以两个sp2轨道和四个氢原子的1s轨道重叠,形成四个C-Hσ键,五个σ键都在同一平面上。
每个碳原子剩下的一个py轨道,它们平行地侧面重叠,便组成新的分子轨道,称为π轨道。
其它烯烃的双键也都是由一个σ键和一个π键组成的。
双键一般用两条短线来表示,如:C=C,但两条短线含义不同,一条代表σ键,另一条代表π 键。
π键重叠程度比σ键小,不如σ键稳定,比较容易破裂。
(二)乙炔的结构乙炔的分子式是C2H2,构造式H-C≡C-C,碳原子为sp 杂化。
两个sp杂化轨道向碳原子核的两边伸展,它们的对称轴在一条直线上,互成180°。
在乙炔分子中,两个碳原子各以一个sp轨道互相重叠,形成一个C-Cσ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠形成C-Hσ键。
此外,每个碳原子还有两个互相垂直的未杂化的p轨道(px,py),它们与另一碳的两个p轨道两两相互侧面重叠形成两个互相垂直的π键。
第三章烯烃和炔烃
授课对象:应用化学、制药工程、化学工程与工艺、药学
学时安排:5-6h
一、教学目的与要求:
1、掌握烯烃和炔烃的结构特征和命名;烯烃的顺反异构。
2、掌握烯炔的化学性质的异同点;烯烃的亲电加成反应和氧化反应;
3、熟悉烯炔的系统命名规则;
4、了解立体选择反应和立体专一反应;
5、了解烯炔烃的物理性质;反应过渡态及反应活化能与反应速率的关系;
二、教学重点
1、烯烃的结构特征:π键的形成和特点;顺反异构的构型标记及次序规则;
2、烯烃亲电加成反应和反应机理,马氏规则及理论解释;烯烃的氧化反应;
3、炔氢的活性;
三、教学难点:
1、烯烃亲电加成反应机理;
2、立体选择反应和立体专一反应的区别;
3、反应过渡态及反应活化能与反应速率的关系;
四、教学方法
讲授法。
为突出重点,突破难点,拟采用如下教学方法:
1、关于烃的命名法则因中学的基础较好,应精选例题,边讲边练。
2、对于碳碳双键和叁键的形成和特点,应充分利用模型和课件动画,帮助学生树立立体形象。
3、从实验现象或实验数据出发,引导学生理解亲电加成反应机理,运用诱导效应和共轭效应解释马氏规则。
5、用模型对照说明溴与顺、反-2-丁烯加成的立体化学产物;举例说明立体选择反应和立体专一反应的区别。
五、教具
电脑、投影仪、Powerpoint课件、球棒模型,教鞭。
六、教学步骤及时间分配
导言:烷烃分子中各原子均以σ键相连,而烯炔烃分子中分别含有碳碳双键和叁键官能团,均为不饱和烃,双键和叁键均σ键和π键组成。
介绍本章学习的重点要求。
1.1 烯烃
一、结构特征
以乙烯的形成为例,讲解:π键和π电子的概念。
演示:乙烯分子模型,结合键长、键角等参数
强调:双键C——sp2杂化,平面构型;叁键C——sp杂化
与σ键比较,分析π键的特点:
①只能与σ键共存;
②肩并肩重叠,不能自由旋转;
③重叠程度小;键较不稳定,易于极化。
指出:C=C双键和是烯烃的官能团。
二、命名和异构现象
(一)命名
精选2-3个例子,分析命名规则的要点:
①选主链(含双键,最长);
②编号(近双键,位最小);
③表达(双键位,要标明)
列举常见的烯基:乙烯基、烯丙基和丙烯基,并指出烯丙基和丙烯基的不同。
指出:英文命名的后缀“ene”
举例说明烯炔的命名规则:
(二)异构现象
以C4H6为例,师生共同写出它的所有的异构体,指出哪些是碳链异构体,哪些是位置异构体;重点分析2-丁烯,结合π键的特点(不能自由旋转),说明顺反异构的概念和产生的原因和条件:
①分子中存在限制旋转的因素;
②被限制旋转的两个碳原子上连接两个原子或基团必须不同。
思考:化合物CH3CH=CH2与CH3CH=CH-CH=CHCH3是否存在顺反异构想现象,如有,有几个顺反异构体?
介绍顺反异构构型的两种标记法,强调:顺、反,Z、E是不同的命名系统。
举例说明:顺反异构体的性质差异,强调生理活性的差异。
练习:写出2,4-庚二烯所有顺反异构体,并用两种方法标记构型。
三、烯烃的物理性质(课后自学)
四、烯烃的化学性质
结构决定性质,紧扣碳碳双键结构特点,重点讲解亲电加成和氧化反应。
(一)加成反应
1、催化加氢(略讲,指出氢化热可解释相似结构化合物的稳定性,如反-2-丁烯比顺式要稳定;存在共轭体系的分子稳定性较大)
2、亲电加成(重点)
(1)加卤素
活性:F2>Cl2>Br2>I2(常见加Cl2和Br2)
应用:加溴,鉴别烯烃。
反应机理:以加溴的经典实验现象和结果引出。
①须在极性条件下进行
②分两步进行:
第一步,带部分正电荷的溴进攻π电子形成环状溴正离子(是反应中间体);
第二步,溴负离子从环状溴正离子反面进攻形成产物。
反应特点:
①共价键异裂,产生正、负离子,属于离子型反应;
②第一步为决速步骤,亲电试剂进攻底物,以此称亲电加成反应。
溴正离子(通常指Br2)为亲电试剂。
③溴负离子从反面进攻。
分析:环状溴正离子的构型,电子结构和活泼性,。
示投影:顺、反-2-丁烯与溴的加成
讨论:立体专一和立体选择反应(立体化学的研究结果反证机理的合理性)。
(2)加HX等不对称的试剂
反应活性:HI>HBr>HCl
马氏规则:试剂中带正电的部分(H+)主要加到含氢较多的双键碳上。
反应机理:第一步,H+进攻π电子,形成碳正离子(决速步骤);
第二步,X—与碳正离子结合形成产物(无立体选择性)分析:碳正离子的构型——平面构型
各级碳正离子的稳定性:叔>仲>伯
强调:马氏规则产物的实质:形成较稳定的碳正离子的必然结果。
说明:为什么只有加溴才形成环状溴正离子?
(3)加H2SO4
主要产物:遵循马氏规则,
应用:所得硫酸氢酯可水解得到醇(选择不同取代的烯烃,可得伯、仲、叔醇);硫酸氢酯溶于硫酸,可除去混杂在烷烃中的少量烯烃。
思考题:
比较1-丁烯、2-丁烯、异丁烯与H2SO4加成的反应活性。
3、自由基加成反应(HBr与烯烃加成的过氧化物效应)
实例:在过氧化物存在下,丙烯与溴化氢的加成,主要产物违反马氏规则。
为什么?因遵循不同反应机理。
自由基加成反应机理:
①过氧键较不稳定,易均裂形成自由基RO·;
②RO·与HBr反应,产生Br·——链引发
③Br·与烯烃CH3CH=CH2加成,主要形成2°自由基(说明为什么)。
④HBr与2°自由基反应,得到反马氏加成产物——链增长。
设问:为什么HCl和HI与烯烃的加成,不存在过氧化物效应?(从H—X 和C—X键的键能来分析)。
(二)氧化反应(Oxidation)
1、KMnO4氧化
强调:条件不同,产物不同。
(1)中性和碱性条件——邻二醇(π键断裂)
(2)酸性条件/加热——酮、酸、CO2(C=C键断裂,可采用断裂一个键,两端加羟基,再脱水的思路来帮助写出氧化产物)。
应用:根据颜色变化,鉴定不饱和烃;根据产物结构的分析,判断烯烃的结构。
例题:某烃A(C10H18),催化加氢得B(C10H22),经氧化得CH3COCH3,CH3COCH2COOH,CH3COOH。
试推断A可能的结构式。
2、臭氧氧化
与KMnO4氧化比较,产物只是醛或酮,没有酸和CO2(从反应机理和条件解释)
强调:先O3氧化,在Zn/H2O。
应用:烯烃结构的鉴定。
思考:①上例结构,如果经历臭氧氧化/锌粉-水解,其产物是什么?
②有一个化合物A(C8H12),可加2摩尔H2,A经臭氧化-锌粉水解,得一个二醛,试推断A的结构。
(三)烯烃的聚合和医用高分子材料(自学)
五、烯烃的制备(自学)
1.2 炔烃
一、炔烃的异构和命名
举例说明烯炔的命名规则:
选主链(含双键和叁键);编号(近重键),两端距重键等距时,优先双键。
表达:先烯后炔,重键位置要标明。
二、炔烃的物理性质(略炔烃的结构)
三、炔烃的结构
C的杂化状态——sp;
π键的形成:两个π键相互垂直,呈圆筒状;
反应活性:比烯烃较小。
如:CH≡C-CH2CH=CH2低温下与等摩尔的Br2加成,生成CHBr=CBr-CH2CH=CH2。
四、炔烃的制备(略)
五、炔烃的化学性质
1、加HX:按马氏规则,以丙炔为例说明。
2、炔烃的水化:先生成烯醇式,再异构化成醛或酮。
3、炔淦的生成
末端炔烃的特性反应,用来检验端炔。
分析:末端炔氢为什么有一定的酸性?(比较三种杂化碳的电负性大小)强调:炔氢酸性很弱(如乙炔pKa=25),而炔负离子是一强碱。
练习:用简便的化学方法鉴别下列化合物:丁烷、1-丁烯、1-丁炔、环丙烷
复习总结:
①强调本章的重点
②精选几个思考题进行复习总结;课堂分析几个有代表性的习题:第3题第
7 、1 3、14题。
点做习题:第1题 :(2)(4); 第2题(2)(7);第4题(2)(3)(7)(8);
第11、12题
参考资料:
①邢其毅主编《基础有机化学》(第二版)上册
②王积涛主编《有机化学》。