第九十章碳碳双键的加成反应
- 格式:ppt
- 大小:1.47 MB
- 文档页数:96



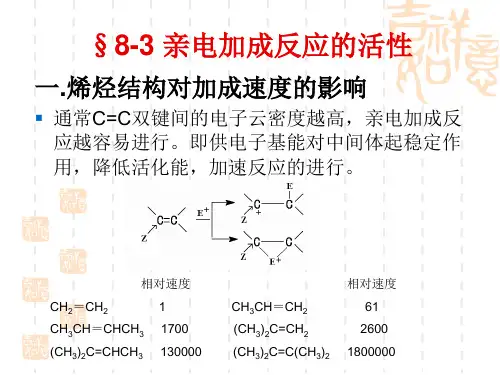
碳碳双键的加成反应加成反应包括,催化氢化、亲电加成、亲核加成和自由基加成。
4.1催化氢化催化氢化分为非均相催化(多相催化)和均相催化。
非均相催化的催化剂为固体,均相催化的催化剂溶于介质成液相,整个反应体系为一相。
4.1.1多相催化氢化氢分子和烯烃吸附在催化剂表面,使n 键和H-H 键断裂,形成金属氢化物和配合物,然后氢原子再分别转移溶剂双键碳原子,故其立体化学为顺式加成,该反应收率高,速度快。
C —C H HI'有时为了提高催化剂的催化性能,常加入惰性载体的活性炭、碳酸钙等。
4.1.2影响催化氢化反应的因素1.温度 (1)升高温度有利于氢化反应,但氢化反应的选择降低。
(2)氢化反应为放热反应,升高温度有利于逆反应,降低转化率。
(3 )升温加速催化剂的失活,增加副反应。
因此,若催化剂有足够的活性时,氢化反应尽可能在低温下进行。
2. 压力增加氢气压力相当于提高氢气浓度,从而有利于氢化的进行,但选择性降低,如 Lindlar 催化剂,常压生成烯,加压为烷烃。
3. 催化剂不同催化剂对同一反应的催化活性不同,同一反应用不同的催化剂,其产物可能不一样。
催化剂的活性与比表面、载体、助催化剂和抑制剂有关,催化剂的比表面越大,活性越高,载 体的作用是提高催化剂的分散度,增加催化剂的稳定性和比表面。
助催化剂能提高催化剂活性,而 抑制剂可部分降低催化剂活性。
_GC — + H 2 PdEaSQ”de 喹啉 / \-H j 吸附H H X C C解吸” C-CsOH 2 Ph —CH=CH CH=CHCCH 2CH 3 —*25 r Ph(CH 2)4COCH2CH 3120C Ph(CH 2)4CHCH2CH 3260 r? OH(CH 2)4CHCH 2CH 3OHI■B AAIUWWVVXJWWWWVW物结构空阻大的底物催化氢化比较困难。
活性(含有电子效应作用的结果)(RCHOH ) >RCH=CHR '(RCH 2CH 2R '>RCOR ' ( RC(OH)HR 'ArCH 2OR (ArCH 3) (RCH 2NH 2)> RCONHR'(RCH 2NHR') > PhH (溶剂的种类和极性,反应体系的酸碱性均能影响催化氢化的反应速度的选择性。

双键加成反应条件一、双键加成反应的定义和意义1.1 双键加成反应的定义双键加成反应是一类有机合成中常见的化学反应,通过在有机分子中同时形成两个键的方式,将两个分子连接在一起。
这种反应通常以不饱和化合物作为反应物,其中至少一个反应物含有双键。
反应的过程中,双键中的一个碳原子与另一个分子中的原子发生成键,而另一个碳原子则与第二个分子中的原子发生成键。
通过双键的加成,可以形成新的单键或多键,从而在有机合成反应中产生更复杂的化合物。
1.2 双键加成反应的意义双键加成反应在有机合成中具有重要的意义。
首先,通过双键加成反应可以构建多种多样的化学键,从而在有机合成中实现多样性和复杂性。
其次,双键加成反应可以用于构建具有特定功能的分子,例如药物、天然产物和功能性材料等。
此外,双键加成反应还可以用于合成高分子化合物,如聚合物和杂化材料等。
二、双键加成反应的条件2.1 反应物的选择双键加成反应的条件首先涉及到反应物的选择。
在双键加成反应中,通常需要选择含有不饱和双键的有机化合物作为反应物。
一般而言,双键加成反应适用于烯烃、炔烃等不饱和化合物,其中包括丁二烯、苯乙烯、乙炔等。
2.2 催化剂的选择双键加成反应还需要适当的催化剂。
常用的催化剂包括金属催化剂和有机催化剂。
金属催化剂常见的有钯、铑、钌等。
有机催化剂则是利用有机小分子作为催化剂,如酶、小分子有机化合物等。
2.3 反应条件的控制在进行双键加成反应时,还需要适当的反应条件来促进反应的进行。
反应条件包括温度、压力和溶剂选择等。
不同的反应条件可以导致不同的反应结果,因此在实验中需要仔细控制反应条件,以获得期望的产物。
三、常见的双键加成反应3.1 烯烃的双键加成反应3.1.1 烯烃的氢化反应烯烃的氢化反应是一种常见的双键加成反应,其中烯烃与氢气反应生成烷烃。
该反应通常在催化剂的存在下进行,常用的催化剂包括钯、铑和钌等。
3.1.2 烯烃的酸催化反应烯烃的酸催化反应是另一种常见的双键加成反应,其中烯烃与酸反应生成酸化合物。




加成反应的原理加成反应,也称共轭加成反应或Michael加成反应,是一种有机化学反应,通常用于将含有不饱和键的羰基化合物和碳碳双键活性化合物结合起来。
此类反应是有机合成中的重要反应类型之一,具有高度选择性和广泛应用的优点。
加成反应的基本原理是在碳碳双键上产生亲电源,然后发生nucleophilic addition反应,将碳-碳双键的π电子对迁移到自由的nucleophile上。
这种反应类型的重要性在于它易于控制,并且可以控制生成不同的硷型产物。
此外,加成反应还可以用于生成脂肪族和环烷基结构,以及生产具有重要生物活性的化合物。
加成反应的基本机制是亲核物质与共轭碳碳双键的反应。
亲核物质可以是任何能够捐赠电子对的物质,如Lewis碱、羟基根离子等。
加成反应通常包括以下步骤:1. 碳-碳双键进行极化,形成化学键的正极和负极;2. 亲核物质攻击电子性质中心的β碳,从而形成共轭加成物;3. 新的σ-化学键生成,且界面上的配体消除或迁移,造成加成物复原原来的共轭系统;4. 最后步骤是H+或OH-的中和,从而消除产物中的不稳定性。
加成反应还有其他的机制,或可以分解成多个反应类型。
例如,Michael加成反应是与羰基化合物和α,β-不饱和化合物的加成反应相似,但它通常包括三个步骤:羰基转移、α加成和β消除。
此外,Hetero-Michael加成、Mannich反应、Arndt-Eistert合成、Strecker合成等都是典型的加成反应类型。
与其它反应类型相比,加成反应具有灵活性、选择性高、操作简单等特点。
它可以将原料转化为合适的中间体,将其用作合成更复杂化合物的构建块。
此外,这种反应类型可以用于处理几乎所有类型的化合物,从光谱学中的小分子到高分子材料都有应用。
总的来说,加成反应是重要有机化学反应之一,通过调节反应条件可以进行高度选择性的反应,从而产生多种有用的中间体和模块化化合物。
虽然加成反应机理可能有所不同,但它们都具有在碳碳双键上产生电荷迁移的特点,这种反应机制使其在有机合成中得到广泛应用。


两个碳碳双键反应碳碳双键作为有机化合物中常见的结构基团,在化学反应中具有重要的作用。
本文将介绍两个碳碳双键参与的两种重要反应:烯烃加成反应和烯烃聚合反应。
一、烯烃加成反应烯烃加成反应是指烯烃与另一种化合物发生加成反应,生成新的有机化合物。
这种反应是有机合成中最常见的反应之一,也是工业上合成有机化合物的重要方法之一。
1. 烯烃与烷烃的加成反应烯烃与烷烃发生加成反应时,碳碳双键上的π电子云中的一个电子被烷烃中的氢原子攻击,形成一个新的碳碳单键。
这种反应通常需要催化剂的存在,催化剂可以是酸性物质、金属催化剂或有机催化剂等。
烯烃与烷烃加成反应的产物是一个饱和的烷烃。
2. 烯烃与卤代烷的加成反应烯烃与卤代烷发生加成反应时,碳碳双键上的π电子云中的一个电子被卤代烷中的卤素原子攻击,形成一个新的碳碳单键。
这种反应也需要催化剂的存在,常用的催化剂有铜、铝等。
烯烃与卤代烷加成反应的产物是一个含有卤素原子的有机化合物。
3. 烯烃与醇的加成反应烯烃与醇发生加成反应时,碳碳双键上的π电子云中的一个电子被醇中的氢氧根离子攻击,形成一个新的碳氧单键。
这种反应通常需要酸性催化剂的存在,常用的催化剂有硫酸和磷酸等。
烯烃与醇加成反应的产物是一个醇化合物。
二、烯烃聚合反应烯烃聚合反应是指烯烃分子通过碳碳双键上的π电子云的重叠,发生共轭加成反应,生成一个更长的烯烃分子的过程。
这种反应是有机合成中一种重要的反应,也是工业上合成高分子材料的常用方法之一。
1. 烯烃的开环聚合反应烯烃的开环聚合反应是指烯烃分子中的两个碳碳双键发生共轭加成反应,形成一个更长的链状烯烃分子。
这种反应通常需要催化剂的存在,常用的催化剂有铜、铝等。
烯烃的开环聚合反应可以合成一系列的高分子材料,如聚乙烯、聚丙烯等。
2. 烯烃的环化聚合反应烯烃的环化聚合反应是指烯烃分子中的两个碳碳双键发生共轭加成反应,形成一个环状的烯烃分子。
这种反应通常需要催化剂的存在,常用的催化剂有铜、铝等。