碳氧双键的加成反应共28页
- 格式:pptx
- 大小:774.26 KB
- 文档页数:28



碳碳双键的加成反应加成反应包括,催化氢化、亲电加成、亲核加成和自由基加成。
4.1催化氢化催化氢化分为非均相催化(多相催化)和均相催化。
非均相催化的催化剂为固体,均相催化的催化剂溶于介质成液相,整个反应体系为一相。
4.1.1多相催化氢化氢分子和烯烃吸附在催化剂表面,使n 键和H-H 键断裂,形成金属氢化物和配合物,然后氢原子再分别转移溶剂双键碳原子,故其立体化学为顺式加成,该反应收率高,速度快。
C —C H HI'有时为了提高催化剂的催化性能,常加入惰性载体的活性炭、碳酸钙等。
4.1.2影响催化氢化反应的因素1.温度 (1)升高温度有利于氢化反应,但氢化反应的选择降低。
(2)氢化反应为放热反应,升高温度有利于逆反应,降低转化率。
(3 )升温加速催化剂的失活,增加副反应。
因此,若催化剂有足够的活性时,氢化反应尽可能在低温下进行。
2. 压力增加氢气压力相当于提高氢气浓度,从而有利于氢化的进行,但选择性降低,如 Lindlar 催化剂,常压生成烯,加压为烷烃。
3. 催化剂不同催化剂对同一反应的催化活性不同,同一反应用不同的催化剂,其产物可能不一样。
催化剂的活性与比表面、载体、助催化剂和抑制剂有关,催化剂的比表面越大,活性越高,载 体的作用是提高催化剂的分散度,增加催化剂的稳定性和比表面。
助催化剂能提高催化剂活性,而 抑制剂可部分降低催化剂活性。
_GC — + H 2 PdEaSQ”de 喹啉 / \-H j 吸附H H X C C解吸” C-CsOH 2 Ph —CH=CH CH=CHCCH 2CH 3 —*25 r Ph(CH 2)4COCH2CH 3120C Ph(CH 2)4CHCH2CH 3260 r? OH(CH 2)4CHCH 2CH 3OHI■B AAIUWWVVXJWWWWVW物结构空阻大的底物催化氢化比较困难。
活性(含有电子效应作用的结果)(RCHOH ) >RCH=CHR '(RCH 2CH 2R '>RCOR ' ( RC(OH)HR 'ArCH 2OR (ArCH 3) (RCH 2NH 2)> RCONHR'(RCH 2NHR') > PhH (溶剂的种类和极性,反应体系的酸碱性均能影响催化氢化的反应速度的选择性。


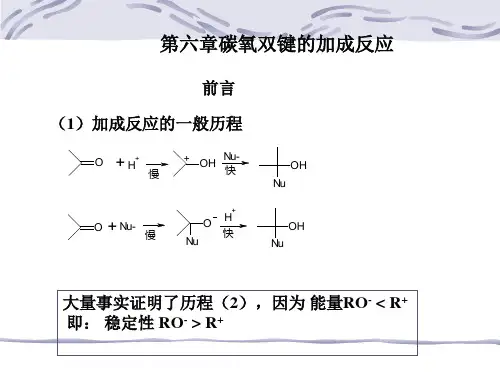

醛酮的羰基上的加成反应羰基双键与烯烃不同,由于π键的极化,氧原子带部分负电荷,碳原子带部分正电荷,由于氧原子可以形成稳定的氧负离子,有较大容纳负电荷的能力,所以碳氧双键中反应活性中心是带正电的碳原子,容易与带负电荷或有未共用电子对的原子或原子团(亲核试剂)相作用。
这种由亲核试剂进攻而发生的加成叫亲核加成。
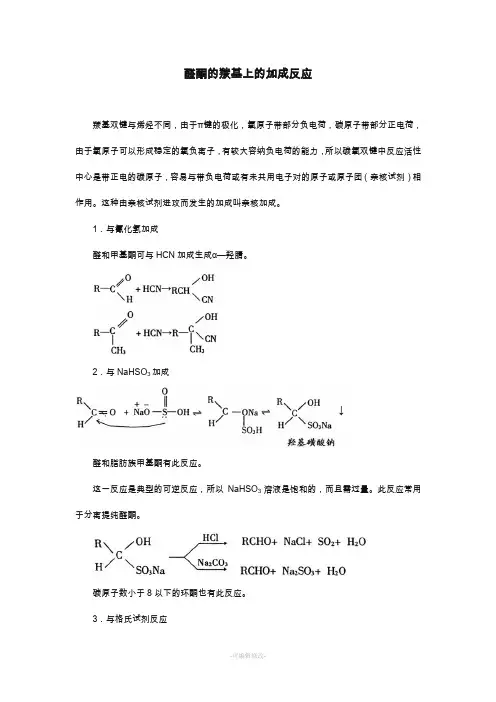
1.与氰化氢加成醛和甲基酮可与HCN加成生成α—羟腈。
2.与NaHSO3加成醛和脂肪族甲基酮有此反应。
这一反应是典型的可逆反应,所以NaHSO3溶液是饱和的,而且需过量。
此反应常用于分离提纯醛酮。
碳原子数小于8以下的环酮也有此反应。
3.与格氏试剂反应醛酮与格氏试剂反应是合成醇的重要方法之一。
从上式可看出,甲醛得1°ROH,醛生成2°ROH,酮生成3°ROH。
例如4.与醇的加成⑴.醛与醇的反应等物质的量的醇与醛反应产物叫半缩醛,半缩醛很活泼,通常可再和1mol醇生成缩醛,缩醛较稳定可分离出来。
缩醛在稀酸中加热可水解成原来的醛。
有机合成中常利用此性质保护醛基。
⑵.酮在同样条件下可生成缩酮。
有些酮反应较难,可用二元醇反应,可生成环状缩酮。
5.与氨的衍生物反应氨的衍生物如羟氨(NH2OH)、肼(NH2NH2)、2,4—二硝基苯肼()均为弱亲核试剂,可与醛酮羰基反应。
醛酮与2,4—二硝基苯肼生成黄色不溶性苯肼的反应可用于鉴别、分离纯化醛酮。
THANKS !!!致力为企业和个人提供合同协议,策划案计划书,学习课件等等打造全网一站式需求欢迎您的下载,资料仅供参考。



有机化学人名反应1.拜耳维利格Baeyer----Villiger 反应(p317)反应机理(不要求)过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例2.康尼查罗Cannizzaro 反应(p321)凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
具有α-活泼氢原子的醛和甲醛首先发生羟醛缩合反应,得到无α-活泼氢原子的β-羟基醛,然后再与甲醛进行交叉Cannizzaro反应,如乙醛和甲醛反应得到季戊四醇:反应机理醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
反应实例3.克莱森许密特Claisen—Schmidt 反应(交叉羟醛缩合)(p314)一个无氢原子的醛与一个带有氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到不饱和醛或酮:反应机理反应实例3.Claisen 重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
加成反应原理
加成反应是一种常见的有机化学反应,指两个或更多的单体分子在反
应中形成一个较大的分子。
这种反应通常是通过共价键形成来实现的,而且其原理非常简单。
加成反应通常涉及到碳碳双键或者碳氧双键的断裂和新化学键的形成。
在这种反应中,两个单体分子之间发生了一系列的电子转移和重排作用,从而导致了新分子的形成。
最常见的加成反应之一就是烯烃与烷烃之间的加成反应。
在这种情况下,烯烃中的碳碳双键会被破坏,并与烷烃中的一个氢原子结合形成
新化学键。
这种反应通常需要催化剂来促进。
除了上述情况外,加成反应还可以涉及到其他类型的官能团。
例如,
在酮和醛之间进行加成反应时,羰基碳原子上的氧原子会被还原为羟基,并与另一个官能团结合形成新化学键。
总之,加成反应是有机化学中非常重要且广泛运用于各个领域的一类
反应。
通过了解其基本原理,我们可以更好地理解有机化学反应的本质,并在实验中设计和优化反应条件,从而获得更好的反应产率和选
择性。
醛和醛的加成反应原理
答案:
两个醛基之间发生加成反应的原则:
醛基中的碳氧双键具有较强的极性,双键碳原子带部分正电荷,碳原子发生加成反应时与带部分负电荷的基团结合。
受醛基中的碳氧双键吸电子作用的影响,含醛基的分子中的α—H反应活泼性增加,可以作为加成反应的试剂。
在碱性条件下,含醛基的分子中含α—H的碳氢键断键:氢原子带部分正电荷,与醛基的碳氧双键中带部分负电荷的双键氧原子结合。
另一部分基团带部分负电性,与醛基的碳氧双键中带部分正电荷的碳原子结合。
酮的加成反应条件介绍酮是有机化合物中常见的一个官能团,由于酮中含有碳氧双键,使得酮具有一定的反应活性。
酮的加成反应是指将某些试剂与酮进行反应,生成新的化合物的过程。
本文将详细探讨酮的加成反应条件及反应机理。
酮的结构和性质酮是一类通过碳氧双键连接两个碳原子的有机化合物。
酮的通用结构为R1-C(=O)-R2,其中R1和R2可以是任意的有机基团。
酮由于含有碳氧双键,表现出一定的共振稳定性。
同时,由于酮中含有两个不同的有机基团,使得酮具有一定的立体异构性和反应活性。
酮的加成反应条件酮的加成反应受多种条件的影响,下面将分别介绍不同类型酮的加成反应的条件及具体反应机理。
1. 氢化酮氢化酮是将氢气与酮进行反应,生成相应的醇的反应。
氢化酮一般需在催化剂存在下进行。
条件: - 催化剂:氢化钌、氢化铑、氢化铂等过渡金属催化剂。
反应机理: 1. 氢气与过渡金属催化剂发生吸附,生成金属活性中心。
2. 酮分子中的碳氧双键与金属活性中心发生反应,断裂碳氧双键。
3. 新鲜的氢气经过酮分子上端的空位位移到与金属活性中心结合的位置,生成缓解能降低的高能中间体。
4. 氢气在高能中间体上发生氧化还原反应,得到醇化合物。
2. 还原酮还原酮是将还原剂与酮进行反应,生成相应的醇的反应。
条件: - 还原剂:常用还原剂有金属硼、金属钠、氢气等。
反应机理: 1. 还原剂向酮中进行电子转移,碳氧双键断裂。
2. 产生的负离子中的一个氧原子和还原剂中的一个阳离子结合,生成相应的醇。
3. 水解酮水解酮是将水和酮进行反应,生成醇和酸的反应。
水解酮是酮的常见反应之一。
条件: - 常温下反应,无需催化剂。
反应机理: 1. 酮中的碳氧双键被水分子攻击,断裂碳氧双键。
2. 水分子中氢原子和酮负离子中的氧原子结合,同时酮中的氧原子和水分子中的氢原子结合,生成相应的醇和酸。
4. 加成加成反应是指通过双键上的一个原子和试剂中的一个原子结合,生成相应的化合物的反应。