0 C实验05
- 格式:ppt
- 大小:58.00 KB
- 文档页数:17
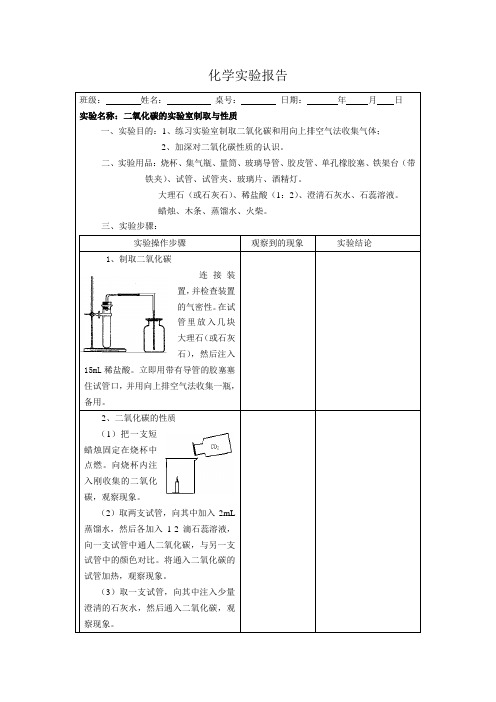
化学实验报告
班级:姓名:桌号:日期:年月日
实验名称:二氧化碳的实验室制取与性质
一、实验目的:1、练习实验室制取二氧化碳和用向上排空气法收集气体;
2、加深对二氧化碳性质的认识。
二、实验用品:烧杯、集气瓶、量筒、玻璃导管、胶皮管、单孔橡胶塞、铁架台(带
铁夹)、试管、试管夹、玻璃片、酒精灯。
大理石(或石灰石)、稀盐酸(1:2)、澄清石灰水、石蕊溶液。
蜡烛、木条、蒸馏水、火柴。
三、实验步骤:
实验操作步骤观察到的现象实验结论
1、制取二氧化碳
连接装
置,并检查装置
的气密性。
在试
管里放入几块
大理石(或石灰
石),然后注入
15mL稀盐酸。
立即用带有导管的胶塞塞
住试管口,并用向上排空气法收集一瓶,
备用。
2、二氧化碳的性质
(1)把一支短
蜡烛固定在烧杯中
点燃。
向烧杯内注
入刚收集的二氧化
碳,观察现象。
(2)取两支试管,向其中加入2mL
蒸馏水,然后各加入1-2滴石蕊溶液,
向一支试管中通人二氧化碳,与另一支
试管中的颜色对比。
将通入二氧化碳的
试管加热,观察现象。
(3)取一支试管,向其中注入少量
澄清的石灰水,然后通入二氧化碳,观
察现象。

c实验总结心得模板6篇心得写好可以使大家都陷入沉思的,心得是我们不断提升工作技能的重要工具,本店铺今天就为您带来了c实验总结心得模板6篇,相信一定会对你有所帮助。
c实验总结心得篇1新的工作年度即将开始,回首20XX工作年度,在矿山领导的指导和关怀下,化验室的工作得到顺利开展,化验室所有员工团结一致,尽职尽责,最终圆满完成各项化验任务。
同时,为顺应矿山的发展,化验室根据自身的实际要求,做出了一系列的改革措施。
现本人将本年度的工作向各位领导做一个简单汇报:一、员工技能的学习及工作成绩由于探矿工作量的加大,化验人员也随之增加,为确保新员工能尽快适应新的工作岗位和环境,我们实施一带一的援徒办法,从实际操作到专业理论对新手进行言传身教。
与此同时,加强岗位练兵,增加每个员工对化验各个环节的熟练程度,从而提高工作效率;定时对部分样品进行抽检,抽检方式分内部抽检和外部多家比较抽检,以确保分析结果的可靠性。
加强内部人员的团结合作,互相紧密配合,充分挖掘群众的潜力,由此推行了三班倒制度,以确保短时光内得出化验结果。
配合矿山生产,做好相应矿石的各种桶泡试验。
在做好本职工作的同时,坚决服从领导安排,去协助其他部门完成各项紧急任务。
经过全体化验员的共同努力,本年度共完成个矿样、约两千个堆场水样的工作量,并定时对每批次车间炼金水样进行普检。
在工作上认真细心,要求精益求精,从而降低了化验误差范围,化验合格率上升到80%以上。
随着工作效率的提高,每批次的矿石样品化验时光减少了20%。
对仪器进行合理保养,减少故障发生率,并能对部分故障进行维修处理。
二、工作纪律的加强及化验数据、资料的管理没有规矩不成方圆,因此,在平日里我们不忘做好员工的思想教育工作,并出台一系列相关的规章制度,而且随着时光的推移,这些制度还将不断完善、加强。
采取奖勤罚懒的措施,提高员工的工作主动性和用心性。
做好各类文件、资料的登记、上报、下发等工作,并把原先没有具体整理的文件按类别整理好放入贴好标签的文件夹内,给大家查阅文件带给了很大方便。

教案首页教案完成时间:2012年02月课程名称基础化学实验II 授课年级及专业2011级化学各专业教学内容授课题目(章、节)实验五荧光分光光度法测维生素C教材名称《化学实验》(下册),王伦、方宾主编,高等教育出版社教材起止页码19-23 计划学时 4教学要求掌握内容1.荧光分析法的基本原理(荧光的产生、荧光光谱的特征、荧光强度与物质浓度的关系);2.荧光定量分析方法测定维生素C;3.荧光分光光度计的使用。
教学要点重点荧光分析法的基本原理;荧光分光光度计的使用。
教学进程荧光分析法的基本原理、维生素C简介(20 min)实验步骤(15 min)仪器介绍和使用示范(20 min)教学方法原理部分以讲授为主,辅以提问、讨论等多种方式;溶液配制强调规范操作;仪器演示,学生使用为主。
(教案续页)第 1 页授课时间:2012年2月20日- 4月授课地点:2220教学主要内容一、实验目的二、实验原理(一)荧光分光光度法1、什么是荧光?——当紫外光照射到某些物质的时候,这些物质会发射出各种颜色和不同强度的可见光,而当紫外光停止照射时,这种光线也随之很快地消失,这种光线称为荧光。
2、荧光分光光度法发展的背景第一次记录荧光现象的是16世纪西班牙的内科医生和植物学家N.Monardes,1575年他提到在含有一种称为“LignumNephriticum”的木头切片的水溶液中,呈现了极为可爱的天蓝色,在17世纪,Boyle(1626—1691)和Newton(1624—1727)等著名科学家再次观察到荧光现象,并且给予更详细的描述。
1852年Stokes在考察奎宁和叶绿素的荧光时,用分光计观察到其荧光的波长比入射光的波长稍为长些,才判明这种现象是这些物质在吸收光能后重新发射不同波长的光,而不是由光的漫射作用所引起的,从而导入了荧光是光发射的概念,他还由发荧光的矿物“萤石”推演而提出“荧光”这一术语。
1867年,Goppelsröder)进行了历史上首次的荧光分析工作,应用铝—桑色素配合物的荧光进行铝的测定。

实验室制取氧化碳实验报告实验室制取二氧化碳实验报告一、实验目的1、学习实验室制取二氧化碳的方法。
2、掌握二氧化碳的性质和检验方法。
3、培养实验操作能力和观察分析能力。
二、实验原理实验室制取二氧化碳通常使用大理石(或石灰石)与稀盐酸反应,化学方程式为:CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑三、实验用品1、仪器:锥形瓶、长颈漏斗、集气瓶、玻璃导管、胶皮管、双孔橡皮塞、铁架台(带铁夹)、水槽。
2、药品:大理石(或石灰石)、稀盐酸、澄清石灰水。
四、实验步骤1、检查装置气密性连接好装置,将导管一端放入水中,用手握住锥形瓶外壁,若导管口有气泡冒出,松开手后导管内形成一段水柱,则装置气密性良好。
2、装药品先向锥形瓶中加入大理石(或石灰石),再通过长颈漏斗加入稀盐酸,使液面浸没长颈漏斗下端。
3、收集气体用向上排空气法收集二氧化碳。
因为二氧化碳的密度比空气大,且能溶于水。
将导管伸到集气瓶底部,使二氧化碳充满集气瓶。
4、验满将燃着的木条放在集气瓶口,若木条熄灭,则说明二氧化碳已收集满。
5、检验二氧化碳将气体通入澄清石灰水中,若澄清石灰水变浑浊,则证明收集到的气体是二氧化碳。
五、实验现象1、大理石(或石灰石)表面有大量气泡产生。
2、收集到的气体能使燃着的木条熄灭。
3、通入澄清石灰水后,石灰水变浑浊。
六、实验注意事项1、所用盐酸不能太浓,否则会使生成的二氧化碳中混有氯化氢气体。
2、不能用硫酸代替盐酸,因为硫酸与大理石(或石灰石)反应生成的硫酸钙微溶于水,会覆盖在大理石(或石灰石)表面,阻止反应继续进行。
3、长颈漏斗下端要伸入液面以下,防止生成的气体从长颈漏斗逸出。
七、实验思考与讨论1、为什么不能用碳酸钠粉末代替大理石(或石灰石)?答:碳酸钠粉末与稀盐酸反应速率太快,不利于气体的收集。
2、若要制取干燥纯净的二氧化碳,应如何改进实验装置?答:可以在收集装置前连接一个装有饱和碳酸氢钠溶液的洗气瓶,除去氯化氢气体,再连接一个装有浓硫酸的洗气瓶,除去水蒸气。

维生素C含量的测定实验报告维生素C含量测定一、实验目的掌握用2,6-二氯酚靛酚测定维生素C的原理和方法。
二、实验原理1.维生素C有强的还原性,在中性和微酸中,呈蓝色的染料2,6-二氯酚靛酚还原成无色的还原型2,6-二氯酚靛酚,同时自身被氧化脱氢抗坏血酸。
在维生素C全部氧化后,再滴下的2,6-二氯酚靛酚将立即使溶液呈粉红色。
2.本实验采用2,6-二氯酚靛酚滴定分析,由于提取液中的其他还原性物质还原2,6-二氯酚靛酚速度较慢,故可将滴定过程控制在2min之内,并判断终点以红色15~30S内消失为准。
三、仪器与试剂维生素C标准液,维生素C样液,0.1mg/ml2,6-二氯酚靛酚溶液,1/1000mol/l 碘酸钾,甲醛醋酸缓冲液,2%草酸溶液,1%淀粉,6%KI溶液四、实验步骤1.标准维生素C的标定:吸取标准维生素C溶液5ml放入三角瓶,加入6%KI 溶液0.05mlt和1%淀粉5滴。
用微量管以碘酸钾液进行滴定,每滴下1滴既充分摇匀,滴至出现微青蓝色为止,记下计数Vc1 ,求出标准维生素C的含量。
2.维生素C样液的滴定:取三个三角瓶标记为A,B和C。
编号 A B C样品维生素C样液10 10 -维生素C标准液-- 1甲醛醋酸缓冲液- 1 -2%草酸溶液--9以标定的2,6-二氯酚靛酚溶液滴定,并记录下所消耗的体积V1、V2、V3 V1——表示维生素C和非维生素C的其他还原性性质总共消耗V2——表示非维生素C的还原性物质的消耗五、实验结果与讨论每100g样品还原型维生素C的量(mg)=((V1-V2)*C*V*100)/A测得:V1=0.200ml V2=0.140ml Vc1=0.440ml Vc2=2.30ml 标准维生素C含量C1=(0.440*0.88)/5=0.0078mg/ml分析:标准维生素C液中有部分氧化。
样品维生素C含量=(0.200-0.140)*5*100*C/3=0.078mg1ml2,6-二氯酚靛酚溶液所能氧化维生素C的毫克数C=C1/Vc2=0.0339mg分析:一般猪肉中,100g所含的维生素C约在0.1mg,本实验所求得的维生素C 含量为0.0339,比正常水平明显要低,造成的原因可能是:1、吸取样品液前未对样液进行摇匀,造成吸取的样液局部浓度偏低,测出来的含量也就偏低;2、用2,6-二氯酚靛酚滴定标准维生素C溶液时,由于产生的粉红色难以判断出来,另外滴定过程中,仪器难以控制,造成2,6-二氯酚靛酚消耗量偏少,则计算C(1ml2,6-二氯酚靛酚溶液所能氧化维生素C的毫克数)偏低,造成所测量得的样液维生素C含量偏低。

维c含量的测定实验报告维C含量的测定实验报告维生素C,也被称为抗坏血酸,是一种重要的水溶性维生素。
它在人体内起着抗氧化、免疫增强、促进胶原蛋白生成等多种重要功能。
因此,准确测定维生素C的含量对于保持人体健康至关重要。
本实验旨在通过一系列实验步骤,测定某种水果中维生素C的含量。
实验材料和方法:1. 实验材料:某种水果样品、维生素C标准品、蒸馏水、2%碘酸钾溶液、1%淀粉溶液、硫酸、氢氧化钠溶液、甲醇、石英砂芯漏斗、滴定管等。
2. 实验步骤:a. 将某种水果样品洗净,去皮、去籽,然后将其切碎成细小的块状。
b. 取一定量的水果样品,加入适量的蒸馏水,用搅拌器搅拌均匀,制成水果汁。
c. 取两个试管,分别加入相同体积的水果汁和蒸馏水作为对照组。
d. 将第一个试管中的水果汁加入适量的2%碘酸钾溶液,混合均匀。
e. 将第二个试管中的蒸馏水加入适量的2%碘酸钾溶液,混合均匀。
f. 在两个试管中分别加入1%淀粉溶液,混合均匀。
g. 在两个试管中加入适量的硫酸,使其变为酸性溶液。
h. 将两个试管放置在水浴中加热,加热至混合液呈现紫色。
i. 随后,加入氢氧化钠溶液至溶液变为深褐色。
j. 将两个试管中的溶液分别转移到两个石英砂芯漏斗中,使用甲醇进行萃取。
k. 将甲醇层收集到滴定管中,滴定至颜色变为淡黄色。
l. 记录滴定过程中消耗的滴定液体积。
m. 重复实验三次,取平均值。
实验结果和讨论:通过实验测定,我们得到了某种水果样品中维生素C的含量。
在滴定过程中,我们观察到滴定液从紫色逐渐变为淡黄色,这表明维生素C已经被还原为无色的物质。
根据滴定液的消耗量,我们可以计算出维生素C的含量。
在本次实验中,我们选择了某种水果样品作为研究对象。
由于维生素C在水果中的含量会受到多种因素的影响,如水果的种类、成熟度、保存方式等,因此选择合适的水果样品对于准确测定维生素C的含量非常重要。
在实验过程中,我们使用了碘酸钾溶液作为氧化剂,将维生素C氧化为无色的物质。
维生素c含量测定实验报告实验报告标题:维生素C含量测定实验报告实验目的:1. 学习并掌握测定维生素C含量的方法;2. 测定某种水果中维生素C的含量。
实验原理:维生素C(抗坏血酸)可以被氧化剂氧化成脱氢抗坏血酸。
测定维生素C含量的常用方法是利用氧化反应,以氧化剂二氯化差二亚铁(DCPIP)为指示剂,其颜色变化与维生素C的浓度成正比关系。
实验步骤:1. 准备样品:选取某种水果,如柠檬或橙子,将其剥皮并榨取出果汁。
2. 制备标准曲线:取一系列维生素C溶液,浓度分别为0.1、0.2、0.3、0.4、0.5 mg/mL。
将每种浓度的维生素C溶液各取1 mL,加入试管中,随后加入5 mL的1% DCPIP溶液,混合均匀。
3. 测定样品中维生素C的含量:取一部分样品的果汁,加入试管中,然后加入5 mL的1% DCPIP溶液,混合均匀。
4. 观察和记录:观察试管中溶液的颜色变化,根据标准曲线,测定维生素C在样品中的含量。
5. 数据处理:根据标准曲线,计算样品中维生素C的含量。
实验结果:通过测量标准曲线和样品溶液的颜色变化,可以得到每种浓度维生素C对应的DCPIP溶液的吸光度值。
通过比较样品溶液的吸光度值,可以计算出样品中维生素C的含量。
实验结论:根据实验结果,可以得出某种水果中维生素C的含量。
维生素C含量的高低可以反映水果的营养价值,从而帮助人们选择更加健康的食物。
实验注意事项:1. 实验中要注意样品的制备、测量和处理的操作细节,确保实验结果的准确性;2. 保持实验环境干净整洁,避免误差的产生;3. 遵守实验安全规定,使用实验室设备时要格外小心。
实验改进方法:为了提高实验的准确性和可靠性,可以增加样品的重复测量次数,以减小测量误差。
同时,可以选取不同种类的水果进行测定,以便得到更全面的维生素C含量数据。
实验可能存在的误差:1. 样品的制备过程中可能会出现维生素C的损失,影响最终测定结果;2. 实际样品中存在的其他化合物可能会影响维生素C的测量结果;3. 测量仪器的误差也可能会对实验结果产生影响。
维生素c测定实验报告维生素 C 测定实验报告一、实验目的本次实验旨在准确测定样品中维生素 C 的含量,了解和掌握维生素C 测定的基本原理和实验方法。
二、实验原理维生素 C 又称抗坏血酸,具有较强的还原性。
本实验采用 2,6 二氯靛酚滴定法进行测定。
2,6 二氯靛酚是一种染料,在酸性溶液中呈红色,在中性或碱性溶液中呈蓝色。
其氧化型在酸性溶液中呈红色,可与维生素 C 发生氧化还原反应。
当维生素 C 全部被氧化后,稍过量的 2,6二氯靛酚会使溶液呈现红色,此时即为滴定终点。
通过滴定消耗的 2,6 二氯靛酚溶液的量,可以计算出样品中维生素 C 的含量。
三、实验材料与设备1、材料新鲜水果(如橙子、草莓等)、标准维生素 C 溶液。
2、试剂2%草酸溶液、0001mol/L 2,6 二氯靛酚溶液。
3、仪器电子天平、容量瓶、移液管、锥形瓶、酸式滴定管、玻璃棒、漏斗、滤纸。
四、实验步骤1、样品处理准确称取适量的新鲜水果,放入研钵中研磨成匀浆。
将匀浆转移至容量瓶中,用 2%草酸溶液定容至刻度,摇匀。
用漏斗过滤,收集滤液备用。
2、标准溶液的配制准确称取一定量的标准维生素 C 晶体,用 2%草酸溶液溶解并定容至一定体积,得到标准维生素 C 溶液。
3、滴定吸取一定量的样品滤液于锥形瓶中,加入2%草酸溶液至一定体积。
用 0001mol/L 2,6 二氯靛酚溶液进行滴定,边滴边摇动锥形瓶,直至溶液呈现淡红色,并保持 15 秒不褪色,即为滴定终点。
记录消耗的2,6 二氯靛酚溶液的体积。
同时进行空白实验,除不加样品滤液外,其他操作与样品滴定相同,记录空白实验消耗的 2,6 二氯靛酚溶液的体积。
五、实验数据处理1、计算 2,6 二氯靛酚溶液的实际浓度吸取标准维生素 C 溶液 1000mL 于锥形瓶中,加入 2%草酸溶液至50mL。
用 2,6 二氯靛酚溶液进行滴定,记录消耗的体积 V1(mL)。
2,6 二氯靛酚溶液的实际浓度(mol/L)=标准维生素 C 的浓度×1000÷V12、计算样品中维生素 C 的含量样品中维生素 C 的含量(mg/100g)=(V V0)×C×T×100÷W其中,V 为样品滴定消耗 2,6 二氯靛酚溶液的体积(mL);V0 为空白滴定消耗 2,6 二氯靛酚溶液的体积(mL);C 为 2,6 二氯靛酚溶液的实际浓度(mol/L);T 为 1mL 2,6 二氯靛酚溶液相当于维生素 C 的毫克数;W 为样品质量(g)。
维生素c含量测定实验报告维生素C含量测定实验报告引言:维生素C是人体所必需的一种维生素,它在许多生物体中具有重要的生理功能。
然而,由于人体无法自行合成维生素C,因此我们需要通过食物来摄入足够的维生素C。
为了了解食物中维生素C的含量,本实验旨在通过一种简单而有效的方法来测定食物样品中维生素C的含量。
实验方法:1. 实验器材准备:量筒、滴定管、烧杯、维生素C标准溶液、碘液、淀粉溶液、维生素C溶液、食物样品。
2. 样品制备:将食物样品洗净并切碎,加入适量的水,用搅拌器搅拌均匀,得到食物样品提取液。
3. 碘液制备:将适量的碘化钾溶液加入适量的碘酸钠溶液中,稀释至一定浓度。
4. 滴定溶液制备:将适量的淀粉溶液加入适量的水中,稀释至一定浓度。
5. 标准曲线绘制:取一系列不同浓度的维生素C标准溶液,分别加入碘液和淀粉溶液,并用滴定管滴定至终点出现蓝色。
6. 样品测定:取适量的食物样品提取液,加入碘液和淀粉溶液,用滴定管滴定至终点出现蓝色。
实验结果与讨论:通过实验测定,我们得到了一系列维生素C标准溶液的滴定结果,并绘制了维生素C含量与滴定体积的标准曲线。
根据标准曲线,我们可以计算出食物样品中维生素C的含量。
在本次实验中,我们选取了柠檬、橙子和苹果作为食物样品。
经过测定,我们发现柠檬中维生素C的含量最高,其次是橙子,苹果中维生素C的含量最低。
这与我们平时对这些食物的认知相符。
维生素C是一种易被氧化的物质,因此在实验中需要注意保护维生素C的稳定性。
我们在制备食物样品提取液的过程中,尽量减少氧气的接触,以防止维生素C的氧化。
另外,实验中的碘液和淀粉溶液也需要在实验过程中保持稳定,以确保测定结果的准确性。
维生素C的含量不仅与食物种类有关,还与食物的储存和加工方式有关。
长时间的储存和高温加热会导致维生素C的损失。
因此,在日常饮食中,我们应该选择新鲜的食物,并尽量减少加热和长时间储存,以保持维生素C的含量。
结论:通过本次实验,我们成功测定了柠檬、橙子和苹果中维生素C的含量,并发现柠檬中维生素C的含量最高,苹果中维生素C的含量最低。
维生素c含量的测定实验报告维生素C含量的测定实验报告一、引言维生素C是一种重要的水溶性维生素,对人体具有多种益处。
然而,由于人体无法自行合成维生素C,因此我们需要通过食物摄入来满足身体对维生素C的需求。
为了了解不同食物中维生素C的含量,我们进行了一项维生素C含量的测定实验。
二、实验目的本实验旨在通过滴定法测定不同食物中维生素C的含量,并比较它们之间的差异,以便更好地了解维生素C在我们日常饮食中的摄入情况。
三、实验材料和方法1. 实验材料:- 维生素C标准溶液- 碘酸钾溶液- 淀粉溶液- 不同食物样品(如柠檬、橙子、西红柿等)2. 实验方法:- 将不同食物样品制成适当的浆状物。
- 取适量的浆状物,加入适量的碘酸钾溶液,并搅拌均匀。
- 加入淀粉溶液,继续搅拌。
- 用维生素C标准溶液进行滴定,直至颜色变为淡黄色。
- 记录滴定所需的标准溶液体积,并计算维生素C的含量。
四、实验结果我们选择了柠檬、橙子和西红柿作为实验样品,通过滴定法测定了它们中维生素C的含量。
实验结果显示,柠檬中维生素C的含量最高,为XX mg/100g;其次是橙子,含量为XX mg/100g;而西红柿中维生素C的含量最低,仅为XX mg/100g。
五、结果分析通过对实验结果的分析,我们可以得出以下结论:1. 柠檬和橙子富含维生素C,适当增加这些水果的摄入可以有效补充维生素C。
2. 西红柿的维生素C含量较低,因此在摄入维生素C时,不应过度依赖西红柿。
六、实验误差和改进措施在实验过程中,可能存在一些误差,例如滴定过程中滴液量的误差、样品制备不均匀等。
为了减小误差,我们可以采取以下改进措施:1. 严格控制滴液量,尽量减小滴液误差。
2. 在样品制备过程中,确保样品的均匀性,避免出现局部维生素C含量过高或过低的情况。
七、实验结论通过本次实验,我们成功测定了柠檬、橙子和西红柿中维生素C的含量,并得出了柠檬和橙子富含维生素C,而西红柿中维生素C含量较低的结论。