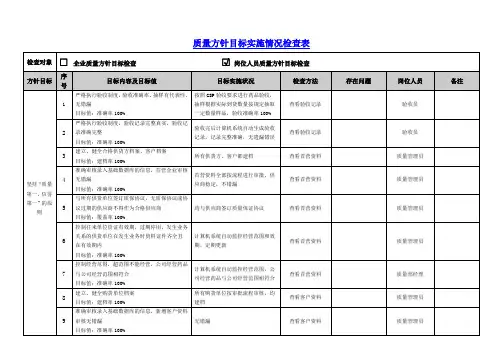
质量方针目标检查表-按岗位
- 格式:docx
- 大小:13.05 KB
- 文档页数:7
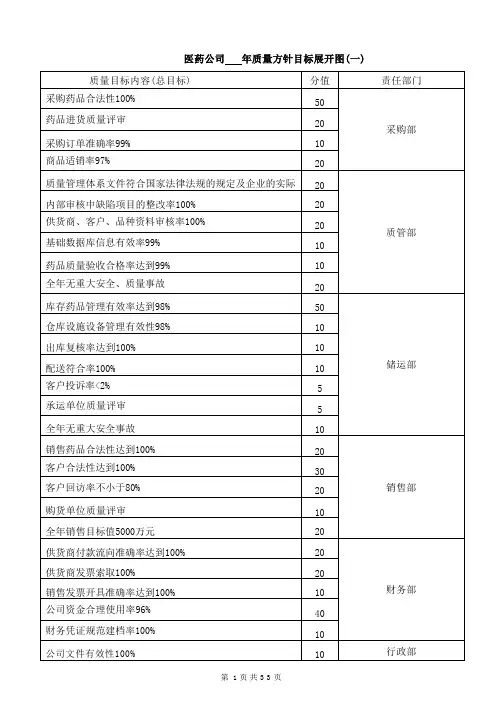
医药公司年质量方针目标展开图(一)
第 1 页共3 3 页
审核人:日期:年月日
第 2 页共 3 3 页
分解人:日期:年月日审核人:日期:年月日批准人:日期:年月日
第 3 页共3 3 页
第 4 页共 3 3 页
分解人:日期年:月日审核人:日期:年月日批准人:日期:年月日
第 5 页共3 3 页
医药公司年储运部质量方针目标展开图(二)
第 6 页共3 3 页
分解人:日期:年月日审核人:日期:年月日批准人:日期:年月日
第7 页共 3 3 页
分解人:日期:年月日审核人:日期:年月日批准人:日期:年月日
第 8 页共 3 3 页
日期:年月日审核人:日期:年月日批准人:日期:年月日
第 9 页共 3 3 页
分解人:日期:年月日审核人:日期:年月日批准人:日期:年月日
第 1 0 页共 3 3 页
医药公司年信息部质量目标展开图(二)
分解人:日期:年月日审核人:日期:年月日批准人:日期:年月日
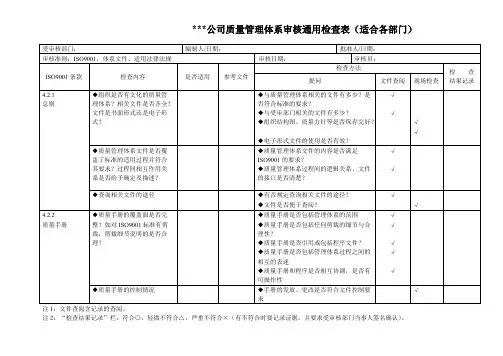
医药公司年质量方针目标检查表(一)
检查人签字:检查日期:年月日
医药公司年采购部质量方针目标检查表(二)
医药公司年质管部质量方针目标检查表(二)
检查日期:年月日责任人:检查人员签字:总得分:
医药公司年储运部质量方针目标检查表(二)
医药公司年销售部质量方针目标检查表(二)
医药公司年财务部质量方针目标检查表(二)
检查日期:年月日责任人:检查人员签字:总得分:
医药公司年行政部质量方针目标检查表(二)
:
医药公司年信息部质量方针目标检查表(二)
检查日期:年月日责任人:检查人员签字:总得分:。
质量方针目标展开图质量方针:依法经营,质量第一,用户至上文案大全经理审批签字:年月日文案大全质量方针目标检查表质量方针:填表日期:年月日经理审批签字:年月日文案大全年度质量培训计划表编号:审批人:人力资源部:质量管理部:文案大全员工培训记录表编号:培训主题:培训时间:文案大全员工培训考核表编号:填表日期:主管领导:人力资源:质量管理部:填表人:文案大全实用标准文档员工培训效果调查表编号:填表日期:员工个人培训教育档案档案编号:文案大全年度企业员工健康检查汇总表编号:文案大全实用标准文档员工健康档案编号:建档时间:注:应将历次体检结果证明文件存入档案。
文件编码登记表页码:文件发放、回收记录编号:编号:编号:文件销毁审批记录编号:信息联系处理单编号:本单一式三份:信息发出部门、接收部门、质量管理部门各一份编号:建档时间:编号:实用标准文档文案大全药品购货计划表(年第季度)编号:制表日期:制表人:业务部门经理:质管部:财务部:总经理/副总经理:实用标准文档首营企业审批表编号:填表日期:实用标准文档首营品种审批表编号:药品购进记录编号:文案大全购进药品验收记录编号:文案大全销后退回药品验收记录编号:文案大全药品验收入库通知××××药品仓储保管组:以下购进/退回药品经质量检查验收合格,请予办理入库手续。
编号:验收员:保管员:入库日期:文案大全编号:药品停售通知单年第号名有关部门:以下药品因质量问题决定停售,请按有关规定采取有效措施停止出售,等等处理。
药品通用名称规格产品批号有效期生产日期生产企业质量管理部年月日(一式四联:一联质管部留存,二联仓储部,三联业务部门,四联必要时送外联客户)解除停售通知单解除停售通知单年第号各有关部门:以下药品经质量复查结果合格,撤消年第号“药品停售通知单”,请恢复正常出库发货及销售,特此告知。
药品通用名称规格产品批号有效期生产日期生产企业质量管理部年月日(一式四联:一联质管部留存,二联仓储部,三联业务部门,四联必要时送外联客户)药品质量复查报告单编号:说明:本表一式三联,一联申请复查部门留存,二联质量管理部门复查后留存,三联复查后返回申请部门。

医疗器械质量方针和质量目标情况检查表一、引言医疗器械质量方针和质量目标是医疗器械生产企业质量管理体系的核心内容,也是确保医疗器械质量安全的关键。
医疗器械质量方针和质量目标情况检查表是企业在质量管理中评估和监控医疗器械质量方针和质量目标实施情况的一项重要工具。
本文将从医疗器械质量方针的含义、制定和实施过程、质量目标的设定及其关联性、医疗器械质量方针和质量目标情况检查表的内容和作用等方面展开探讨。
二、医疗器械质量方针的含义1. 什么是医疗器械质量方针?医疗器械质量方针是医疗器械生产企业为了提高医疗器械质量安全性和符合性而确定的质量方向和目标,是企业质量管理的宗旨和宣言。
医疗器械质量方针一般由医疗器械生产企业的高层管理层确定,并向全体员工宣传和传达。
2. 医疗器械质量方针的制定和实施医疗器械质量方针的制定要与企业的经营理念和战略目标相一致,要注重体现医疗器械生产企业的产品特点和市场需求,要与国家法律法规和相关标准相符合。
医疗器械质量方针的实施需要通过相关培训和宣传,要求全体员工都能理解和落实医疗器械质量方针。
三、医疗器械质量目标的设定及其关联性1. 医疗器械质量目标的设定医疗器械质量目标是在医疗器械质量方针的指导下,为了实现质量方针而确定的具体、可衡量、可达成的目标。
医疗器械质量目标的设定应该符合SMART原则,即具体(Specific)、可衡量(Measurable)、可达成(Achievable)、相关(Relevant)和时限(Time-bound)。
2. 医疗器械质量方针与质量目标的关联性医疗器械质量方针和质量目标是相辅相成、相互关联的。
医疗器械质量方针是企业对质量目标的总体要求和引领,而质量目标是医疗器械质量方针的具体实施和落实。
只有质量目标与医疗器械质量方针保持一致,企业才能实现医疗器械质量方针所制定的目标。
四、医疗器械质量方针和质量目标情况检查表1. 检查表的内容医疗器械质量方针和质量目标情况检查表主要包括医疗器械质量方针实施情况、医疗器械质量目标达成情况、存在的问题及改进措施等内容。

医疗器械质量方针和质量目标情况检查表医疗器械质量方针和质量目标情况检查表 - 建立高质量医疗保障体系的重要步骤【导言】医疗器械是现代医学中不可或缺的工具,它们对诊断、治疗和监测疾病起着关键作用。
在保证医疗器械质量的前提下,医疗保障体系才能有效运作并提供可靠的医疗服务。
建立医疗器械质量方针和质量目标是一项至关重要的任务,本文将全面探讨这一主题,帮助你深入了解医疗器械质量管理的重要性及相关知识。
【一、医疗器械质量方针】1. 定义和重要性医疗器械质量方针是指医疗机构或医疗器械经营企业为提高医疗器械质量,并满足法律、法规及相关技术规范要求而制定的质量管理原则和政策。
它对于确保医疗器械的可持续发展和保障患者安全起着至关重要的作用。
2. 主要内容医疗器械质量方针应包括但不限于以下几个方面:(1) 组织结构和职责分工:明确各职能部门在医疗器械质量工作中的具体职责和权限,确保各环节的协同与配合;(2) 风险管理和监测:建立风险管理制度,及时发现、评估和控制医疗器械安全问题,确保及时采取措施降低潜在风险;(3) 质量培训与提升:制定培训计划,提高员工对医疗器械质量的认知和操作标准,确保技术人员具备必要的专业知识和技能;(4) 合规和法规要求:遵守相关法规和规定,确保医疗器械的注册、生产和销售符合规定的程序和标准。
【二、质量目标情况检查表】1. 定义和应用范围质量目标情况检查表是一种系统评估工具,用于检查医疗器械质量目标的实施情况。
它有助于医疗机构或医疗器械经营企业了解自己的质量目标是否得以落地,并对不足之处进行改进。
2. 主要内容质量目标情况检查表包括但不限于以下几个方面:(1) 目标设定与管理:评估医疗机构或医疗器械经营企业是否明确制定了质量目标,并将其与组织目标相结合,确保质量目标的有效性和可操作性;(2) 监测与评估:检查医疗机构或医疗器械经营企业是否建立了科学的监测和评估体系,能够及时了解质量目标的实际达成情况,并对不达标的情况进行响应;(3) 持续改进:评估医疗机构或医疗器械经营企业是否采取措施鼓励持续改进,包括但不限于内部培训、员工参与和优秀经验分享等;(4) 信息管理:检查医疗机构或医疗器械经营企业是否建立了有效的信息管理系统,能够提供准确、及时和可追溯的相关数据,便于质量目标的跟踪和分析。

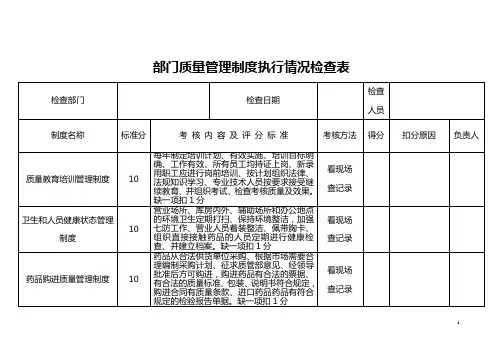
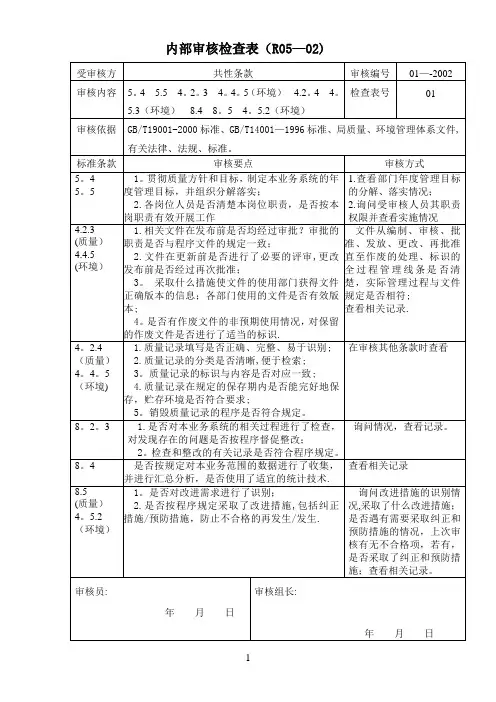
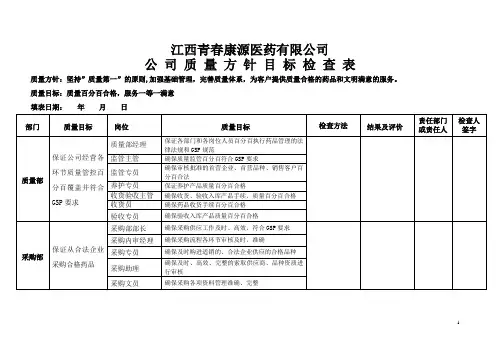
内部质量体系审核检查表(范本)
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
13
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
内部质量体系审核检查表
陪同人员:NO:28
内部质量体系审核检查表
陪同人员:NO:29
内部质量体系审核检查表
陪同人员:NO:30。
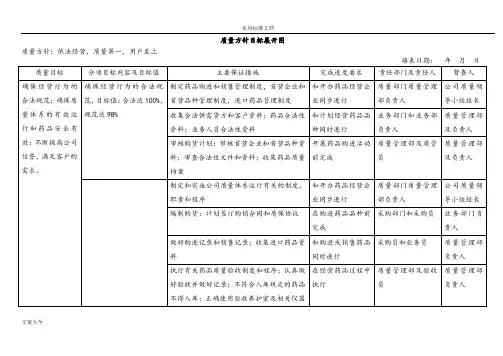
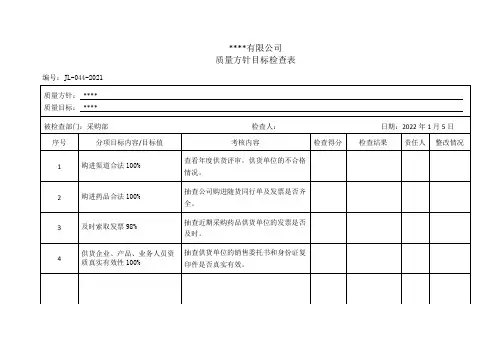
质量方针目标展开图质量方针:填表日期:年月日经理审批签字:年月日质量方针目标检查表质量方针:填表日期:年月日总经理:主管副总经理:质管部负责人:记录人:年度质量培训计划表编号:审批人:人力资源部:质量管理部:员工培训记录表编号:培训主题:培训时间:员工培训考核表编号:填表日期:主管领导:人力资源:质量管理部:填表人:员工培训效果调查表编号:填表日期:员工个人培训教育档案档案编号:年度企业员工健康检查汇总表编号:员工健康档案编号:建档时间:注:应将历次体检结果证明文件存入档案。
文件编码登记表页码:文件发放、回收记录编号:编号:编号:文件销毁审批记录编号:信息联系处理单编号:本单一式三份:信息发出部门、接收部门、质量管理部门各一份编号:建档时间:编号:药品购货计划表(年第季度)编号:制表日期:制表人:业务部门经理:质管部:财务部:总经理/副总经理:18编号:填表日期:编号:注:附药品生产企业许可证、营业执照、批准文件、质量标准、出厂检验报告、样品、价格批文、GMP证书及临床总结报告等资料。
药品购进记录编号:药品到货请验通知单验收组:现有以下购进/退回药品到货,请给予验收。
购进药品验收记录编号:销后退回药品验收记录编号:药品验收入库通知××××药品仓储保管组:以下购进/退回药品经质量检查验收合格,请予办理入库手续。
编号:验收员:保管员:入库日期:药品拒收报告单编号:药品停售通知单年第号名有关部门:以下药品因质量问题决定停售,请按有关规定采取有效措施停止出售,等等处理。
药品通用名称规格产品批号有效期生产日期生产企业质量管理部年月日(一式四联:一联质管部留存,二联仓储部,三联业务部门,四联必要时送外联客户)解除停售通知单年第号各有关部门:以下药品经质量复查结果合格,撤消年第号“药品停售通知单”,请恢复正常出库发货及销售,特此告知。
药品通用名称规格产品批号有效期生产日期生产企业质量管理部年月日(一式四联:一联质管部留存,二联仓储部,三联业务部门,四联必要时送外联客户)药品质量复查报告单编号:说明:本表一式三联,一联申请复查部门留存,二联质量管理部门复查后留存,三联复查后返回申请部门。
6、质检科内审检查表6、市场部(售后服务)内审检查表7、生产部(采购)内审检查表7、生产部(生产计划、设备,仓库)内审检查表7、生产部(车间)内审检查表出师表两汉:诸葛亮先帝创业未半而中道崩殂,今天下三分,益州疲弊,此诚危急存亡之秋也。
然侍卫之臣不懈于内,忠志之士忘身于外者,盖追先帝之殊遇,欲报之于陛下也。
诚宜开张圣听,以光先帝遗德,恢弘志士之气,不宜妄自菲薄,引喻失义,以塞忠谏之路也.宫中府中,俱为一体;陟罚臧否,不宜异同。
若有作奸犯科及为忠善者,宜付有司论其刑赏,以昭陛下平明之理;不宜偏私,使内外异法也。
侍中、侍郎郭攸之、费祎、董允等,此皆良实,志虑忠纯,是以先帝简拔以遗陛下:愚以为宫中之事,事无大小,悉以咨之,然后施行,必能裨补阙漏,有所广益。
将军向宠,性行淑均,晓畅军事,试用于昔日,先帝称之曰“能”,是以众议举宠为督:愚以为营中之事,悉以咨之,必能使行阵和睦,优劣得所。
亲贤臣,远小人,此先汉所以兴隆也;亲小人,远贤臣,此后汉所以倾颓也。
先帝在时,每与臣论此事,未尝不叹息痛恨于桓、灵也。
侍中、尚书、长史、参军,此悉贞良死节之臣,愿陛下亲之、信之,则汉室之隆,可计日而待也。
臣本布衣,躬耕于南阳,苟全性命于乱世,不求闻达于诸侯。
先帝不以臣卑鄙,猥自枉屈,三顾臣于草庐之中,咨臣以当世之事,由是感激,遂许先帝以驱驰。
后值倾覆,受任于败军之际,奉命于危难之间,尔来二十有一年矣。
先帝知臣谨慎,故临崩寄臣以大事也。
受命以来,夙夜忧叹,恐托付不效,以伤先帝之明;故五月渡泸,深入不毛。
今南方已定,兵甲已足,当奖率三军,北定中原,庶竭驽钝,攘除奸凶,兴复汉室,还于旧都。
此臣所以报先帝而忠陛下之职分也。
至于斟酌损益,进尽忠言,则攸之、祎、允之任也.愿陛下托臣以讨贼兴复之效,不效,则治臣之罪,以告先帝之灵。
若无兴德之言,则责攸之、祎、允等之慢,以彰其咎;陛下亦宜自谋,以咨诹善道,察纳雅言,深追先帝遗诏。
臣不胜受恩感激.今当远离,临表涕零,不知所言.。
医疗器械质量方针和质量目标情况检查表1. 简介医疗器械质量方针和质量目标是医疗器械行业中非常重要的文件,它们对于保障医疗器械的安全性、有效性和可靠性具有至关重要的作用。
本文将围绕医疗器械质量方针和质量目标情况检查表展开讨论,分析其内容和应用。
2. 医疗器械质量方针医疗器械质量方针是企业制定的对于医疗器械质量管理的总体要求和指导原则。
它体现了企业对于产品质量的追求和承诺,为企业提供了一个明确的发展方向。
2.1 质量方针内容一份好的医疗器械质量方针应该具备以下几个要素:2.1.1 安全性安全性是医疗器械最基本的要求之一。
在制定质量方针时,企业应明确强调产品安全性,并承诺不会以任何方式妥协产品的安全性。
2.1.2 有效性医疗器械的有效性直接关系到产品是否能够发挥预期的治疗效果。
质量方针应明确要求企业在设计、生产和销售过程中要保证产品具备良好的有效性。
2.1.3 可靠性可靠性是医疗器械质量的重要指标之一,它体现了产品在正常使用情况下的稳定性和可信赖程度。
质量方针应强调企业对于可靠性的追求,并承诺不断提升产品可靠性。
2.1.4 合规性医疗器械行业有着严格的法律法规和标准要求,企业必须确保其产品符合相关规定。
质量方针应明确要求企业遵守法律法规,并建立健全的合规体系。
2.2 质量方针制定过程制定医疗器械质量方针需要经过以下几个步骤:2.2.1 确定参与者确定参与制定质量方针的各个相关方,包括高层管理人员、技术人员、市场人员等。
他们应具备相关的专业知识和经验,以确保质量方针的全面性和可行性。
2.2.2 审查现状对企业现有的质量管理体系进行审查,了解企业目前的优势和不足之处。
这将为制定质量方针提供重要的参考依据。
2.2.3 制定草案根据参与者的意见和审查结果,制定医疗器械质量方针的草案。
草案应包括对安全性、有效性、可靠性和合规性等要素的明确表述。
2.2.4 内外部沟通将制定好的草案与内外部相关方进行沟通,并征求他们的意见和建议。
质量管理体系检查表质量管理体系检查表1.质量方针和目标1.1 质量方针1.1.1 描述组织质量方针的内容和原则1.1.2 说明方针的制定和更新过程1.2 质量目标1.2.1 确定组织的质量目标及其相关性1.2.2 制定具体的目标细化方案1.3 质量目标的落实情况1.3.1 说明如何跟踪和评估目标的达成情况1.3.2 反馈结果并采取必要的改进措施2.质量手册2.1 质量手册的编制和维护2.1.1 描述如何编制和维护质量手册2.1.2 说明质量手册的内容和使用方法2.2 质量手册的变更控制2.2.1 确定质量手册变更的控制流程2.2.2 记录质量手册变更的信息及其审批过程3.质量目标的跟踪与分析3.1 测量数据的收集3.1.1 确定合适的测量指标和方法3.1.2 描述数据收集的过程和频率3.2 数据分析与演示3.2.1 说明如何进行数据分析和演示3.2.2 利用结果进行质量目标的跟踪和评估4.过程管理4.1 过程控制4.1.1 描述过程控制的目的和原则4.1.2 说明过程控制的方法和流程4.2 过程监测和测量4.2.1 确定过程监测和测量的指标和方法4.2.2 记录和分析结果,并提出改进措施5.内部审核5.1 内部审核计划5.1.1 制定内部审核计划5.1.2 描述审核的范围和目标5.2 内部审核的进行5.2.1 说明内部审核的步骤和方法5.2.2 记录审核的结果和发现的问题5.3 审核结果的跟踪和处理5.3.1 跟踪和记录审核结果的处理情况5.3.2 确定改进措施和纠正措施6.领导的参与6.1 领导的参与和承诺6.1.1 确定领导参与质量管理的方式和内容 6.1.2 记录领导的承诺和参与情况6.2 领导的指导和实施6.2.1 领导的角色和职责6.2.2 说明领导如何指导和实施质量管理7.附件附件1、质量方针和目标记录表附件2、质量手册附件3、测量数据收集表8.法律名词及注释8.1 法律名词8.1.1 定义法律名词的含义和涵义8.1.2 描述法律名词在质量管理中的应用和作用 8.2 注释8.2.1 为法律名词提供其他解释或补充说明。