盐酸小檗碱片一致性评价项目报价及方案
- 格式:doc
- 大小:769.50 KB
- 文档页数:11

盐酸小檗碱片产品工艺规程1.产品名称及剂型: (2)1.1产品名称:盐酸小檗碱片 (2)1.2汉语拼音:Yansuan Xiaobojian Pian (2)1.3剂型:片剂 (2)1.4批准文号:国药准字【2000】H37022076 (2)2.产品概述: (2)2.1性状:本品为黄色素片。
(2)2.2功能与主治:抗菌药,用于痢疾杆菌引起的肠道感染等症。
(2)2.3用法与用量:口服成人—次01~3片,—日3次。
(2)2.4规格:0.1g。
(2)2.5包装规格:24片/板×1板/盒×200盒/箱。
(2)2.6有效期:三年。
(2)2.7贮藏:遮光、密封保存。
(2)3.制剂操作过程和工艺条件 (2)3.1取工艺处方中盐酸小檗碱粉碎,过100目筛,加淀粉44 g,混匀,用聚山梨酯80的80%乙醇制粒,干燥,整粒,加入羧甲基淀粉钠,硬脂酸镁,混匀,压片,制成1000片,即得。
(2)3.2 批量 (2)3.3 每批:30万片。
(2)4.生产工艺及操作要求 (2)4.1.原辅料的处理: (2)4.2备料:按批生产指令批用料量进行备料,准确称取盐酸小檗碱30.0 kg、聚山梨酯80 450ml、淀粉13.2 kg 、羧甲基淀粉钠0.42kg 、95%乙醇7.8 kg、硬脂酸镁0.3 kg,结余料退料,贴上状态标志,并作好记录。
(2)4.3 混合与制粒 (2)4.4沸腾干燥 (3)4.5 整粒、总混 (3)4.6 压片 (3)4.7 铝塑包装 (4)4.8 外包装 (4)4.9入库: (4)5..工艺流程图 (4)6. 原辅材料、中间产品、成品质量标准和技术参数及贮存条件。
(6)6.1、原辅料质量标准、贮存条件及复检前最长储存期 (6)6.2、半成品质量标准、成品法定标准、企业内控标准及依据: (6)7、质量监控 (7)8.设备一览表及生产能力 (8)9. 技术安全及劳动保护 (8)9.1设备安全 (8)9.2安全用电 (9)9.3.防火防爆 (9)10.劳动组织与岗位定员、标准生产周期 (9)11、环境保护 (10)11.1生产中产生的废水进入本厂总废水管道,经处理后排放。
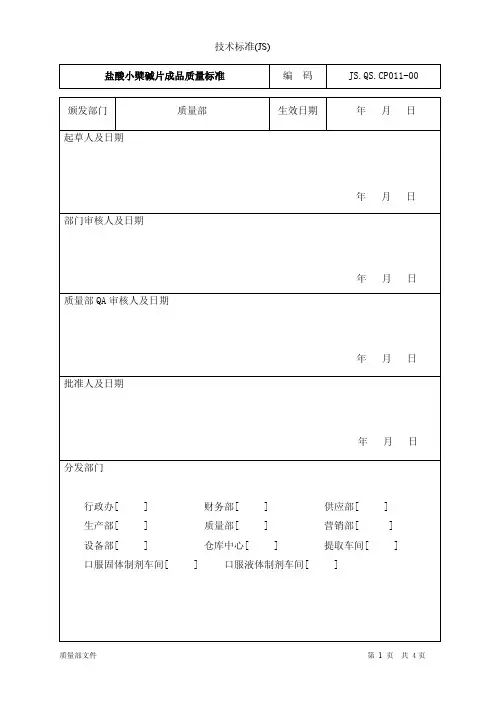
盐酸小檗碱片成品质量标准编码JS.QS.CP011-00颁发部门质量部生效日期年月日起草人及日期年月日部门审核人及日期年月日质量部QA审核人及日期年月日批准人及日期年月日分发部门行政办[ ] 财务部[ ] 供应部[ ] 生产部[ ] 质量部[ ] 营销部[ ] 设备部[ ] 仓库中心[ ] 提取车间[ ] 口服固体制剂车间[ ] 口服液体制剂车间[ ]盐酸小檗碱片成品质量标准编 码 JS.QS.CP011-00目 的:明确盐酸小檗碱片的质量标准。
范 围:适用于盐酸小檗碱片的检验。
责任人:质量部负责人、质检员。
内 容:1 物料的基本信息:产品名称:盐酸小檗碱片 产品代码:CPYS 2 处方:无3 产品规格和包装形式:(见下表) 品 名 规 格 包 装 规 格 批 准 文 号盐酸小檗碱片每片0.1g40片/瓶*1瓶/盒*100盒/箱国药准字H36021622 100片/瓶*1瓶/盒*400盒/箱4 质量标准的依据:《中国药典》(2010)版二部 P6405 取样方法:依据《半成品、成品取样操作规程》SOP.QS.QA004-00操作。
6 检验方法操作规程: 6.1 性状:本品应为黄色片。
6.2 检查6.2.1 重量差异:依据片剂项下《重量差异检查法检验操作规程》SOP.QC.TZ013-00测定,重量差异限度为±7.5%,超出重量差异限度的不得多于2片,并不得有1片超出限度1倍。
6.2.2 微生物限度:依据《微生物限度检查法检验操作规程》SOP.QC.TZ018-00测定,细菌数应不得过800cfu/g ;霉菌和酵母菌数应不得过80cfu/g ;大肠埃希菌不得检出; 6.2.3 含量均匀度(0.025g 规格)取本品1片,如为糖衣片,除去糖衣,置乳钵中,研细,加沸水适量使盐酸小檗碱溶解,并分次转移至100ml 量瓶中,放冷,用水稀释至刻度,摇匀;滤过,弃去初滤液约8ml,精密量取续滤液适量,用水定量稀释制成每1ml 中约含盐酸小檗碱40ug 的溶液,作为供试品溶液。

医药行业投资研究报告:一致性评价再添新品罕见病用
药审评加速
行业动态跟踪
第四批通过一致性评价的品种品规公布,包括华海药业、京新药业、石药
集团以及正大天晴等皆有品种通过,建议关注。
CFDA 和卫健委发布关于优化药
品注册审评审批有关事宜的公告,主要针对国内罕见病用药和进口药品的注册事项,相关药物的上市进程将加快,建议积极关注。
本周原料药价格跟踪
抗感染药类价格方面,青霉素工业盐、阿莫西林和头孢曲松钠维持4 月份报价分别为75 元/kg、195 元/kg 和665 元/kg。
6-APA 于5 月21 日报价为260 元/kg,与之前价格相同。
维生素方面,本周维生素A、维生素E 价格下滑,截至5 月25 日维生素A 和维生素E 分别报价为565 元/kg 和38 元/kg,与上周末相比分别下降110 元/kg、4.5 元/kg;维生素C、泛酸钙(鑫富/新发)本周报价与上周持平, 即分别为43.5 元/kg 和64.5 元/kg。
本周医药行业估值跟踪
截止到2018 年5 月25 日我们采用一年滚动市盈率(TTM,整体法),医药生物整体市盈率处在38.5 倍,维持上升趋势,低于历史估值均值(40.41 倍)。
截止到2018 年5 月25 日,医药行业相对于全部A 股的溢价比例为2.32 倍,比上周有所提升。
本周所有子板块均呈现不同幅度的上涨,其中化学制剂和生物制品涨幅较
大。
周策略建议
本周生物医药板块持续表现优异,特色化学制剂标的如海辰药业、恩华药。
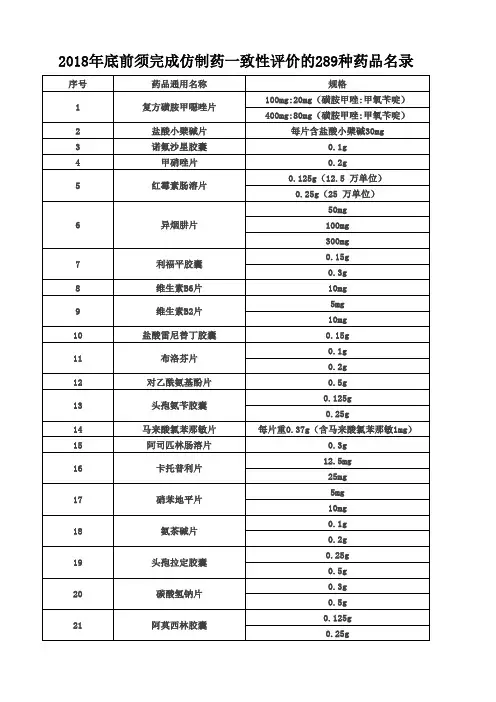

GMP质量体系盐酸小檗碱片中间产品检验操作规程一、目的为确保盐酸小檗碱片中间产品的质量,保证产品符合标准要求,制定本操作规程。
二、适用范围本操作规程适用于盐酸小檗碱片中间产品的检验过程。
三、检验设备1.电子天平;2.pH计;3.紫外可见分光光度计;4.高效液相色谱仪;5.纸质过滤器;6.温度计;7.玻璃容器。
四、检验项目1.外观检验:将物料取样,在光线充足的环境下进行外观检验,检查是否有异物、色差、沉淀等情况;2.pH检验:将适量样品溶于水中,用pH计测定其pH值,标准要求为5.0~7.0;3. 含量测定:取一定量样品,用高效液相色谱仪检测其中小檗碱的含量,标准要求为50~100mg/g;4.溶解性检验:将一定量样品置于水中,搅拌溶解,观察溶解情况并测定其透明度;5.紫外可见光谱:将一定量样品溶于适宜的溶剂中,用紫外可见分光光度计测定其紫外吸收光谱,检查是否符合标准范围。
五、操作流程1.外观检验(1)取样品,放置在光线充足的工作台上;(2)观察样品有无异物,如异物存在,则进行分离并记录;(3)观察样品颜色是否符合要求,如有色差,则记录。
2.pH检验(1)取一定量样品溶于适量水中;(2)使用pH计测定水溶液的pH值;(3)如pH值不在标准范围内,则记录。
3.含量测定(1)取一定量样品,加入适量溶剂中,充分溶解;(2)使用高效液相色谱仪测定样品中小檗碱的含量;(3)记录测定结果。
4.溶解性检验(1)取一定量样品加入适量水中;(2)使用温度计测定水中溶液的温度;(3)进行搅拌溶解,观察溶解情况;(4)使用纸质过滤器过滤溶液,观察滤液透明度;(5)记录结果。
5.紫外可见光谱(1)取一定量样品溶于适宜的溶剂中;(2)使用紫外可见分光光度计测定其紫外吸收光谱;(3)检查吸收峰位置和强度是否符合标准要求;(4)记录结果。
六、记录与报告1.检验记录(1)检验员按照操作规程进行检验,实验过程中详细记录操作步骤和观察结果;(2)检验结果记录需签字确认,确保数据的准确性。

仿制药一致性评价一:背景信息1) 2016年2月6日,国务院颁布了国办发【2016】8号文件“国务院办公厅关于开展仿制药质量和疗效一致性评价的意见”,随后国家又在短时间内连续颁布了一系列关于仿制药一致性评价工作的相关文件和指南,真正拉开了仿制药产品质量和疗效一致性评价工作的序幕。
2) 根据国家仿制药一致性评价政策和时限要求,289种基本药物要求在2018年底完成评价,其他仿制药产品若能成为“首名”或“前三名”,对市场和经济意义重大。
否则,则存在较大风险失去市场甚至文号不保。
二:认识与建议虽然国家提出了明确的时间要求和评价原则,但当前的法规并不具体,企业左右为难。
公司基于长期从事药政法规研究的工作经验,我们对本轮要求的认识如下:1) 不等不靠、主动研究。
2) 要充分重视对产品的信息回顾与整理,重视仿制药评价的整体策划,为开展研究工作打基础。
3) 重视药学研究。
仿制药研究的重点是药学部分,也是国家评价仿制药质量的重要内容,CMC是重中之重,必须先行。
4) 时间紧迫仿制药一致性评价,尤其是基本药物的评价看起来还有2年多时间,实际分解后留给企业的时间已经非常紧张,即使一切顺利也需要20-25个月。
5) 逐步开展,分段进行。
仿制药一致性评价是一个综合工程,链条长,费用高。
尤其是早年完成注册的产品,注册研究与申报资料更加薄弱,适合先初步摸索产品质量现状再进行系统深入的研究。
6) 仿制药一致性评价应分为四个阶段开展三:优势与业绩仿制药一致性评价工作是一个系统工程,需要完整的服务链条和资源配置,包括CMC研发实验室、动物GLP实验室、BE临床实验基地、生化分析实验室和注册服务团队,以及良好的公共资源,并且各个环节都要有经验丰富的技术团队与完善的质量管理体系,要经得起注册现场核查与临床现场核查。
1) 咨询拥有的优势包括以下几方面:✔建立了高水平配置的国家级CMC研发实验室,拥有专业的研发人员和十多年药品研发经验,为中国三大医药技术研究成果转化平台之一,国家基本药物标准溶出度曲线制作承担单位之一;✔合作动物GLP实验室,比格犬等大动物试验不是问题;✔集团内拥有BE临床试验基地与通过FDA审计的生化分析实验室(海口、长春、南京3个BE基地),BE试验优先快速安排;✔18年丰富经验的注册团队,轻松化解技术难题。

90批盐酸小檗碱片溶出度的测定和评价
曹俊涵;施颖;张亿;陈红
【期刊名称】《中国药物评价》
【年(卷),期】2018(35)2
【摘要】目的:建立盐酸小檗碱片溶出度的高效液相色谱的测定方法,考察市售盐酸小檗碱片的溶出度情况.方法:比较紫外可见分光光度法与高效液相色谱法对90批盐酸小檗碱片的溶出度的测定结果.结果:两种测定方法对黄色糖衣片样品测定结果有差异(偏差>10%).同厂家同批次批间溶出度差异较大.结论:高效液相色谱法能更加准确地测定盐酸小檗碱片的溶出量.各厂家应更加注重生产工艺稳定性,严格控制药品质量.
【总页数】3页(P91-93)
【作者】曹俊涵;施颖;张亿;陈红
【作者单位】成都市食品药品检验研究院,四川成都610041;成都市食品药品检验研究院,四川成都610041;成都市食品药品检验研究院,四川成都610041;成都市食品药品检验研究院,四川成都610041
【正文语种】中文
【中图分类】R927.11;R916.68
【相关文献】
1.盐酸小檗碱片溶出度测定Z比分数的统计分析 [J], 汪民海;朱玲
2.盐酸小檗碱片剂与胶囊剂体外溶出度考察 [J], 顾新;刁雨辉
3.关于盐酸小檗碱片溶出度检查的商榷 [J], 惠白;刘玲珠;王淑华
4.用EXCEL考察不同厂家盐酸小檗碱片的溶出度 [J], 卢鹏伟;王梅香;牛艳阳
5.L-HPC对提高盐酸小檗碱片溶出度的影响 [J], 张尧生;丁科平;任荣生
因版权原因,仅展示原文概要,查看原文内容请购买。

盐酸小檗碱片国内外质量现状分析摘要:盐酸小檗碱片作为一种广谱抗菌药,其抗菌谱广,临床上用于治疗消化道感染引起的腹泻,是治疗腹泻的传统用药,属于国家基本药物。
本文通过对盐酸小檗碱片的基本信息、国内外上市情况及参比制剂信息的梳理,在处方工艺、质量标准进行对比,探讨了该制剂在仿制过程中质量控制的关键点,为国内开展该品种的质量与疗效一致性评价提供参考。
关键词:盐酸小檗碱片;国内外现状比较;一致性评价盐酸小檗碱是一种临床上广泛使用的抗菌药物,又名盐酸黄连素。
临床主要用于痢疾杆菌、大肠杆菌等导致的肠道感染[1]。
盐酸小檗碱片已被列入国家基本药物目录,根据国家对仿制药一致性评价要求,该品起初规定须在2018年底前完成仿制药质量与疗效一致性评价,后来国家又发文,国家基本药物的评价工作不做要求,在政策上鼓励企业提高产品质量,这充分体现了国家对基本药物的重视,保供的同时,逐步开展评价研究,因此做好该品全面的评价前调研与研究,为该品的一致性评价奠定良好的基础十分必要。
1 上市情况本品化合物日本于1969年合成成功,1978年大峰堂薬品工業株式会社生产的ベルベリン塩化物水和物(Berberine Chloride Hydrate)在日本上市。
本品片剂最早于1981年在国内上市,其规格为25mg。
2016年8月17日,国家局公布的“2018年底前须完成仿制药质量和疗效一致性评价品种的批准文号”一文中,盐酸小檗碱片批文数773个,但该品的实际生产企业不过4家。
2 处方工艺2.1 国外制剂处方工艺日本大峰堂生产的盐酸小檗碱片辅料组成为乳糖、玉米淀粉、羧甲基纤维素钙、二氧化硅、硬脂酸镁和胃溶型薄膜包衣预混剂。
其制备工艺为湿法制粒、压片和包胃溶衣。
2.2 国内制剂处方工艺国内盐酸小檗碱片目前有薄膜衣片和糖衣片两种。
制剂处方辅料均由崩解剂、填充剂、润湿剂、润滑剂、助溶剂、助流剂和包衣材料组成。
崩解剂多数企业使用普通崩解剂,即单独用羧甲淀粉钠或同时用低取代羟丙纤维素,少数企业使用到超级崩解剂交联羧甲基淀粉钠,交联聚维酮等;填充剂多数企业使用玉米淀粉类,少数几家使用可压型较好的微晶纤维素或乳糖等;润湿剂多数企业使用水。

20XX年盐酸小聚碱片稳定性试验方案为了进一步确认销售的盐酸小豪碱片能够在标示的贮存条件下,产品有效期内符合质量标准的各项要求,按照有关规定进行在温度25C±2C∖相对湿度60%±5%条件下24个月的长期稳定性考察。
1产品的包装、规格、生产批量、考察批次数:(1)包装:铝箔和PVC硬片包装、聚乙烯瓶包装(2)规格:O.Ig(3)生产批量:600万片(4)考察批次:①包装规格为12片/板X2板/盒的每年考察一批次。
②包装规格为100片/瓶的每年考察一批次。
2 .产品介绍:盐酸小聚碱片执行标准为《中国药典》2023年版二部;批准文号为国药准字HXXXXXXX;包装形式为PVC硬片和铝箔包装、聚乙烯瓶包装,贮存条件为遮光,密封;有效期为24个月。
3 .相关的稳定性检验方法:包装容器的密封性一目测、感观;性状一目测;外观一目测;崩解时限一一崩解时限检查法;含量测定一一高效液相色谱法。
4 .检验方法依据:(1)《中国药典》2023年版二部第1054页盐酸小聚碱片。
(2)《中国药典》(2023版)四部“片剂”通则。
5 .合格标准:根据《中国药典》2023年版二部盐酸小豪碱片项下质量标准进行包装容器的密封性、性状、外观、崩解时限、含量测定的检查,结果符合内控标准规定。
6 .容器密封系统的描述:盐酸小篆碱片所用包装规格12片/板X2板/盒为药用包装PVC硬片和铝箔;所用包装规格IOO片/瓶为聚乙烯瓶包装,包装严密防潮,能保证产品质量。
7 .试验间隔时间(测试时间点):每批样品自贮存开始时(0月)检测一次,随后每3个月、6个月、9个月、12个月、18个月、24个月分别检测一次。
8 .贮存条件:密封,遮光,在温度25±2C,相对湿度60%±5%的条件下放置。
(BSCTOO型恒温恒湿箱)9 .检查项目:根据《中国药典》2023年版四部原料药与药物制剂稳定性试验指导原则项下中稳定性重点考察项目参考表制定该品种检查项目为:包装容器的密封性、性状、外观、崩解时限、含量测定。
盐酸小檗碱片一致性评价项目报价及方案
一致性评价方案如下:
我单位负责一致性评价过程中,全面贯彻国家局质量源于设计(QbD)理念,首先进行原研药国家局备案,购买国家局认可的原研药,对原研药进行质量剖析,建立原研药产品质量概况(QTPP),作为自制样品的研发目标,并根据本品种确定关键质量属性(CQAs),充分理解的基础上,对于关键工艺参数及其与CQAs间的关联以及潜在的高风险变量进行充分研究和筛选,对自制样品与原研药进行全面质量对比,如自制原处方样品体外释放与原研药不一致,按照原研处方工艺进行改进,处方工艺确定后进行小试三批及中试三批的工艺交接,按照国外药典标准或进口标准与原研药进行质量一致性的质量研究工作,做到体外释放及杂质与原研药一致,新建立的标准按照国家要求进行方法学研究,自制样品与原研药进行稳定性研究比较,稳定性3个月后开展体内BE实验,如在开展BE过程中出现不一致现象,我公司按照体内释放曲线进行处方调整,直至达到体内释放与原研药一致,整理申报资料上报,获得一致性评价许可。
一致性评价研究路线图如下:
项目调研资料如下:
一、原研药:
盐酸小檗碱片仅在中国及日本上市,十九世纪60年代由日本大峰堂薬品工業株式会社合成该药物,并于1972年在日本上市,商品名“キョウベリン錠100”。
应以该药品作为参比药物。
二、BCS分类:
暂未查到相关文献支持,参照盐酸小檗碱溶解性“本品在热水中溶解,在水或乙醇中微溶,在三氯甲烷中极微溶解,在乙醚中不溶”,本品应为BCSⅡ类或Ⅳ类,应当根据相关法规开展实验证明盐酸小檗碱的BCS分类。
三、对照品
盐酸小檗碱对照品:
杂质对照品:
加拿大TLC公司杂质对照品供应:
四、质量标准及处方工艺质量标准见附件
5
6
7
处方工艺:
对照药物辅料:一水乳糖、玉米淀粉、羟丙级纤维素、羧甲基纤维素钙、硬脂酸镁、羟丙基甲基纤维素、乙基纤维素、甘油脂肪酸酯、无水二氧化硅、二氧化钛、黄色色淀。
片芯:一水乳糖、玉米淀粉、羟丙级纤维素、羧甲基纤维素钙、硬脂酸镁、无水二氧化硅。
包衣层:羟丙基甲基纤维素、乙基纤维素、甘油脂肪酸酯、二氧化钛、黄色色淀。
参照日本对照药物辅料可知,本品生产工艺为原辅料预混,湿法制粒,压片,包衣。
五、日本橙皮书资料
主药理化性质:
溶出曲线:
方法:
六、BE实验方案
因为本品主药为BCSⅡ类或Ⅳ类,因此本品需要进行生物等效性实验的一致性评价。
参照日本橙皮书,本品种的BE实验可设计为双周期两制剂单次给药交叉试验设计方案,将经
济南永康医药科技有限公司一致性评价项目资料
健康检查合格健康男性受试者,随机分为两组,一组先口服受试制剂,后口服参比制剂,另一组先口服参比制剂,后口服受试制剂。
两个试验周期之间为洗脱期,洗脱期待定。
11。