卡托普利片一致性评价项目报价及评价方案(网站)讲解
- 格式:doc
- 大小:994.00 KB
- 文档页数:13



卡托普利片市场分析报告1.引言1.1 概述卡托普利片是一种常用的降压药物,市场需求量巨大,是全球医药市场的重要组成部分。
本篇报告将对卡托普利片市场进行深入分析,包括市场现状、竞争分析以及未来趋势。
通过对市场进行全面了解,可以更好地指导相关企业制定市场策略,把握市场机遇。
1.2 文章结构文章结构部分内容如下:文章结构分为引言、正文和结论三部分。
在引言部分,我们将概述文章的内容和目的,并对整篇报告进行总结。
在正文部分,将详细分析卡托普利片市场的现状、竞争情况和未来趋势。
最后,在结论部分,将对市场分析报告进行总结,提出建议和展望,并以结语结束整篇文章。
1.3 目的目的部分的内容应该涵盖撰写此报告的原因和目的。
在这一部分,可以阐述为何进行对卡托普利片市场的分析,以及预期的目标和效果。
可以提及对市场趋势、竞争环境和未来预测的研究,以及为读者提供有关卡托普利片市场的全面和准确的信息。
同时,也可以指出本报告的目的是帮助读者更好地了解当前市场情况,并为相关利益相关者提供决策参考。
1.4 总结总结部分:本报告对卡托普利片市场进行了全面的分析,包括市场现状、竞争分析和未来趋势。
通过对市场的深入研究,我们发现卡托普利片市场存在着潜在的增长机会,但同时也面临着激烈的竞争挑战。
随着消费者对健康和生活质量的关注日益增强,卡托普利片市场仍然具有较大的潜力和发展空间。
在未来,我们建议相关企业要加强产品创新和品牌建设,不断提高产品质量和服务水平,以满足消费者的不断增长的需求。
同时,企业需要注重市场营销和宣传,提升品牌知名度和竞争力。
通过持续的努力和创新,可以更好地抓住市场机遇,实现长期稳定的发展。
总的来说,卡托普利片市场具有广阔的发展前景,但也需要企业不断努力和创新来应对激烈的市场竞争。
希望本报告能为相关企业在市场决策和战略规划上提供一定的参考和指导,促进行业的健康发展。
2.正文2.1 卡托普利片市场现状卡托普利片(Captopril)是一种被广泛使用的降压药物,属于血管紧张素转化酶抑制剂。

2023年卡托普利片行业市场分析现状卡托普利(Captopril)片是一种常用的抗高血压药物,属于血管紧张素转化酶抑制剂(ACEI)。
它通过抑制血管紧张素转化酶的活性,降低血管紧张素Ⅱ的生成,从而扩张血管,降低血压。
卡托普利片是世界卫生组织基本药物之一,是高血压患者的常用药物之一。
卡托普利片的市场需求主要来自两个方面:一方面是高血压患者的治疗需求,另一方面是心血管疾病患者的辅助治疗需求。
根据世界卫生组织的统计数据,全球高血压患者数量不断增长,特别是在发展中国家,高血压患者的比例不断上升。
同时,心血管疾病患者的数量也在逐年增加。
这两个因素使得卡托普利片的市场需求持续增长。
然而,卡托普利片市场也面临一些挑战。
首先,卡托普利片已经面临了很多仿制药的竞争。
由于卡托普利片是过去几十年来的老药物,许多制药公司都能生产仿制品。
这使得市场上出现了许多价格低廉的仿制药,给品牌卡托普利片带来了竞争压力。
其次,卡托普利片的潜在副作用也是市场发展的限制因素之一。
卡托普利片可能引起低血压、咳嗽、头晕等副作用,严重时还会引起肝功能损害和血液问题。
这使得一些患者在使用卡托普利片时产生抵触情绪,选择其他药物。
此外,卡托普利片市场还面临着管理政策的改变和医疗体系的差异等因素的影响。
不同国家和地区的药品监管机构对药物的准入要求和管理政策各不相同,这给跨国制药公司的进入带来了一定的障碍。
尽管面临这些挑战,卡托普利片市场仍然具有较大的潜力。
随着人们对高血压和心血管疾病的认识不断提高,卡托普利片作为一种有效的药物治疗手段将继续受到关注。
而且,新技术的应用也为卡托普利片的发展带来了机遇,比如微型化技术的发展可以提高制药过程的效率和药物的可控性。
综上所述,卡托普利片市场虽然面临着一些挑战,但仍然具有较大的潜力。
随着高血压和心血管疾病患者数量的增加,卡托普利片的市场需求将持续增长。
但制药公司需要面对竞争的挑战,拓展市场份额,同时还要关注药物的安全性和患者的需求,以提高产品竞争力。

2024年卡托普利片市场分析现状引言卡托普利片是一种常用的降压药物,主要用于治疗高血压疾病。
随着人们对健康意识的提高和生活水平的改善,高血压患者的数量不断增加,进而推动了卡托普利片市场的发展。
本文将对卡托普利片市场的现状进行分析,并对未来的发展趋势进行展望。
市场规模目前,卡托普利片市场规模已经达到了一个较高的水平。
据统计数据显示,卡托普利片市场的年销售额超过了XX亿元,预计未来还会继续增长。
市场需求的增加主要源于以下几个方面的因素:•高血压患者数量的增加:随着人口老龄化趋势的加剧以及生活方式的不健康,高血压患者的数量不断增加,进而带动了卡托普利片市场的发展。
•医疗水平提高:随着医疗技术的不断进步和医疗条件的改善,越来越多的患者被准确诊断为高血压,并开始接受符合规范的治疗,其中卡托普利片作为一种常用的降压药物得到了广泛应用。
•药物疗效优势:卡托普利片具有良好的降压效果,且副作用较小,这使得它成为许多医生和患者的首选药物之一。
市场竞争态势卡托普利片市场竞争激烈,主要有以下几个方面的原因:1.市场参与者众多:目前已经有多个厂家生产和销售卡托普利片,市场上的竞争非常激烈。
这些厂家不仅来自国内,还有一些外资企业也加入了竞争。
2.品牌竞争:由于市场需求旺盛,许多品牌卡托普利片涌入市场。
各大药企通过品牌推广、广告宣传等手段来提高产品知名度和市场份额。
3.价格竞争:由于市场竞争激烈,一些药企通过降低产品价格来争夺市场份额。
这种价格竞争对于一些规模较小的企业来说,往往是一种压力和挑战。
市场发展趋势在未来,卡托普利片市场有望继续保持稳定增长。
以下是未来发展趋势的几个方面:1.市场规模扩大:随着高血压患者数量的不断增加和医疗水平的提高,卡托普利片市场的规模将进一步扩大。
2.技术创新:在卡托普利片的研发领域,技术创新是推动市场发展的重要因素。
未来,随着科技的进步和医学研究的深入,有望出现更加安全、有效的卡托普利片产品。

卡托普利片市场调查报告1. 引言本文档是针对卡托普利片市场进行的调查报告。
卡托普利片是一种常用的高血压治疗药物,市场需求量大。
本调查报告旨在对卡托普利片市场进行深入的分析和评估,以提供相关决策的依据。
2. 调查方法为了获得准确的市场信息,我们采用了多种调查方法。
首先,我们进行了一系列的市场调研,包括问卷调查、访谈和观察等。
此外,我们还收集了相关的市场数据和资料,对市场趋势进行了分析和预测。
3. 市场概况卡托普利片市场是一个庞大的市场,具有广阔的发展前景。
目前,卡托普利片在高血压患者中的应用非常广泛,且市场需求量稳定增长。
随着人们健康意识的提高和高血压患病率的增加,预计卡托普利片市场将继续保持良好的发展态势。
4. 市场竞争分析卡托普利片市场存在较强的竞争压力。
现有市场上已有多个品牌的卡托普利片产品,竞争激烈。
不同品牌的产品在价格、质量、品牌知名度等方面存在差异,消费者对产品的选择有较大的自由度。
此外,一些药企还通过广告和促销活动来提升产品的市场占有率。
5. 市场机会和挑战卡托普利片市场具有很好的发展机会。
随着高血压患病率的增加,卡托普利片的需求量将继续增加。
此外,随着人们健康意识的提高,对高血压治疗药物的需求也将增加。
市场需求的增长为卡托普利片的销售提供了良好的机会。
然而,市场上也存在一些挑战。
首先,卡托普利片市场竞争激烈,产品同质化现象比较突出,价格战也比较频繁。
此外,一些新型治疗药物的出现可能对卡托普利片市场造成冲击。
药企需要加强研发创新,提高产品的竞争力。
6. 市场推广策略在市场推广方面,药企可以采取以下策略来提高卡托普利片的市场占有率。
首先,注重产品的品质和疗效,提高产品的竞争力。
其次,加大市场宣传和广告投入,提高品牌知名度和产品曝光度。
此外,与医疗机构合作,开展宣传推广活动,提高医生和患者对产品的认可度。
7. 结论通过对卡托普利片市场的调查,我们可以得出以下结论: - 卡托普利片市场具有良好的发展前景,市场需求量稳定增长; - 市场竞争激烈,药企需要加强研发创新,提高产品竞争力; - 各种市场机会存在,药企可以通过提高产品品质和加大市场推广力度来提高市场占有率。

•临床药学窑中国当代医药2021年3月第28卷第9期空腹条件下卡托普利片生物等效性研究聂昌盛1赵翔2崔靖2陈仁燕21.仁和堂药业有限公司,山东临沂276600;2.翔宇药业股份有限公司,山东临沂276023[摘要]目的评价仁和堂药业有限公司生产的卡托普利片受试制剂与Bristol-Myers Squibb S.r.l.生产的参比制剂的生物等效性,旨在为临床合理用药提供依据。
方法2019年9~11月纳入24名中国成年健康受试者于郑州市中心医院进行卡托普利片受试制剂和参比制剂的生物等效性研究。
采用随机、单剂量、两制剂、两周期、交叉试验设计,按照随机数字表法分为R-T组和T-R组,每组各12名°于空腹状态下,R-T组口服单剂量卡托普利片受试制剂、参比制剂,T-R组口服单剂量卡托普利片参比制剂、受试制剂,两周期交叉用药,制得受试制剂、参比制剂样本各24份。
所有数据均采用SAS9.4软件进行分析,并对两种制剂进行生物等效性评价。
结果受试制剂和参比制剂的CgAUCg和AUC0-肄个体内变异(CV%・)均<30%、受试制剂的CgAUC。
-,和AUC。
-”几何均值与参比制剂的比值90%CI分别为87.82%~100.74%、91.37%~101.35%・和91.47%~101.33%、均在80.00%~125.00%・范围内,符合生物等效性的判断标准。
结论卡托普利片的受试制剂和参比制剂具有生物等效性。
[关键词]卡托普利片;生物等效性;空腹条件[中图分类号]R971.9[文献标识码]A[文章编号]1674-4721(2021)3(C)-0128-03Study on bioequivalence of Captopril Tablets under fasting conditionNIE Chang-sheng ZHAO Xiang CUI Jing2CHEN Ren-yan21.Renhetang Pharmaceutical Co.,Ltd.,Shandong Province,Linyi276600,China;2.Xiangyu Pharmaceutical Co.,Ltd.,Shandong Province,Linyi276023,China[Abstract]Objective To evaluate the bioequivalence between the test preparation of Captopril Tablets produced by Renhetang Pharmaceutical Co.,Ltd.and the reference preparation produced by Bristol-Myers Squibb S.r.l.To provide basis for rational drug use in clinic.Methods A total of24healthy adult Chinese subjects enrolled in Zhengzhou Central Hospital from September to November2019to study the bioequivalence of the test preparation and reference preparation of Captopril Tablets.A randomized,single-dose,two-preparation,two-period,crossover experiment design was used,and they were divided into the R-T group and T-R group according to random number table method,with12 subjects in each group.Under fasting condition,R-T group was given single dose of test preparation and reference preparation of Captopril Tablets orally,and T-R group was given single dose of reference preparation and test preparation of Captopril Tablets orally.Two cycles of cross-medication were conducted to obtain24samples of test preparation and reference preparation respectively.The test preparation and reference preparation of single dose Captopril Tablets were taken orally under fasting condition.All the data were analyzed by SAS9.4software,and the bioequivalence of the two preparations was evaluated.Results The intraspecific variation(CV%J for C mx,AUC°_t and AUC0-肄of test preparation and reference preparation were below30%、90%'CI of geometric mean point estimate for C mx,AUC°_t and AUC0-肄of test preparation and reference preparation were87.82%-100.74%',91.37%—101.35%,and91.47%—101.33%,, respectively.All of them were in the range of80.00%—125.00%、which met the criteria of bioequivalence.Conclusion The test preparation and reference preparation of Captopril Tablets are bioequivalent.[Key words]Captopril Tablets;Bioequivalence;Fasting condition高血压为临床上常见的慢性疾病,多选用药物进行血压控制,卡托普利吸收迅速,吸收率在75%以上,大部分经肾脏排泄,其中约50%以原形排出[1],剩余为代谢物,血液透析时可将其清除,在体内很少蓄积,广泛用于治疗高血压。
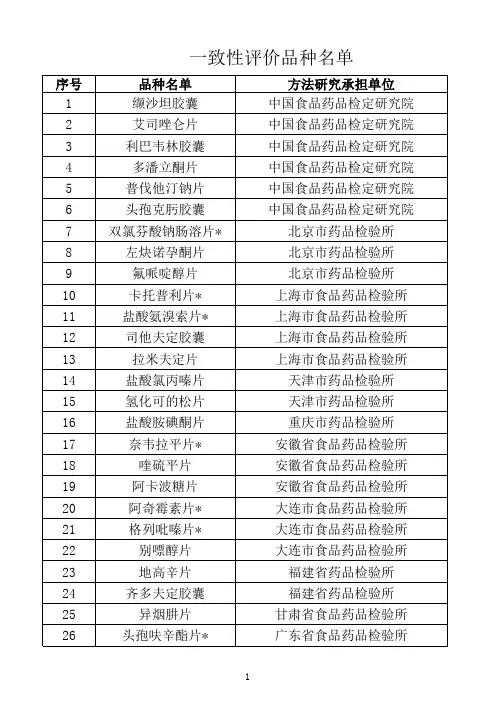

卡托普利片验证方案问题描述卡托普利片是常用的一种降压药物,而且在一些临床研究中被使用。
但是,在大规模生产过程中,常常会面临着片剂质量一致性的问题。
为了保证卡托普利片的药效与质量稳定,需要建立一种有效的验证方案。
目标本文档的目标是提供一种卡托普利片的验证方案,以确保其质量稳定性。
验证方案1. 理论依据首先,我们需要了解卡托普利片的主要成分和药效。
卡托普利片的主要成分是卡托普利,它属于血管紧张素转换酶抑制剂。
它通过抑制血管紧张素转换酶的活性,从而降低血管紧张素Ⅱ的生成,扩张血管,降低血压。
2. 主要验证项为了确保卡托普利片的质量稳定性,我们需要验证以下几项主要指标:•药物含量一致性:每片卡托普利片中的卡托普利含量应在一定的范围内,以确保其药效的稳定性。
•片剂外观:卡托普利片的外观应该符合相应的标准,如色泽均匀、无明显杂质等。
•可分辨性和可溶性:卡托普利片应能够在人体内迅速分解和溶解,以确保药物的快速吸收。
3. 验证方法3.1 药物含量验证药物含量验证是卡托普利片验证的关键环节,可以通过以下步骤进行:1.选取一定数量的卡托普利片样品进行检测。
2.使用高效液相色谱仪(HPLC)等仪器,对样品进行测定。
3.将测得的卡托普利含量与标准要求进行比对,判断是否符合标准。
3.2 片剂外观验证片剂外观验证的目的是检查卡托普利片的外观是否符合标准要求,可以通过以下步骤进行:1.对样品进行外观检查,包括颜色、形状、表面光洁度等方面。
2.将检测结果与标准要求进行比对,判断是否符合标准。
3.3 可分辨性和可溶性验证可分辨性和可溶性验证的目的是确保卡托普利片能够在人体内迅速分解和溶解,以保证药物的快速吸收。
具体步骤如下:1.将一定数量的卡托普利片样品放入不同pH值的溶液中。
2.测定不同时间点的溶解度。
3.将测得的溶解度结果与标准要求进行比对,判断是否符合标准。
4. 结果分析根据以上验证方法得到的结果,我们可以对卡托普利片的质量稳定性进行评估。

两个品牌的卡托普利治疗高血压的成本-效果分析目的:评价两个品牌的卡托普利治疗原发性高血压的经济效果。
方法:83例轻、中度原发性高血压患者随机分成A、B两组,分别采用国产和合资生产两个品牌的卡托普利治疗8周,观察两组的疗效、不良反应,并进行成本-效果分析。
结果:A、B两组的有效率分别为86.26%、86.35%,不良反应发生率分别为5.0%、4.7%,差异无统计学意义(P>0.05);药品成本分别为3.02元、750.60元,有显著性差异(P<0.05)。
结论:两种卡托普利治疗轻、中度原发性高血压疗效和不良反应发生率无显著性差异(P>0.05),但药品成本有显著性差异(P<0.01),国产卡托普利治疗高血压经济性较佳。
[Abstract] Objective:To evaluate the economic benefits of Captopril of the twobrands for treatment of hypertension.Methods: A total of 83 patients with hypertension were enrolled into 2 groups which were randomly assigned to receive Captopril of the two:group A to receive Captopril (made in China),and group B to receive Captopril(made in a Chinese-foreign joint venture). The medication duration was 8 weeks for all the 2 groups. The curative effects and adverse drug reactions of the 2 groups were monitored and evaluated by the cost-effectiveness analysis.Results:The tolal effective rates of groupA,B were 88.26%,86.35%, adverse drug reactions were 5% and 4.7%, respectively,showed no significant differences(P>0.05);the cost of the 2 groups drug were 3.02 yuan, 750.6 yuan, respectively,showet significant difference in costs(P<0.05).Conclusion: Group Ais more preferable than that of group B for treatment of hypertension in pharmacoeconomics.[Key words] Hypertension;Captopril;Cost-effectiveness analysis高血压是一种常见的心血管疾病,我国患病率已达11%,严重威胁着人类的健康。

对乙酰氨基酚片一致性评价项目报价及评价方案一致性评价方案如下:
我单位负责一致性评价过程中,全面贯彻国家局质量源于设计(QbD)理念,首先进行原研药国家局备案,购买国家局认可的原研药,对原研药进行质量剖析,建立原研药产品质量概况(QTPP),作为自制样品的研发目标,并根据本品种确定关键质量属性(CQAs),充分理解的基础上,对于关键工艺参数及其与CQAs间的关联以及潜在的高风险变量进行充分研究和筛选,对自制样品与原研药进行全面质量对比,如自制原处方样品体外释放与原研药不一致,按照原研处方工艺进行改进,处方工艺确定后进行小试三批及中试三批的工艺交接,按照国外药典标准或进口标准与原研药进行质量一致性的质量研究工作,做到体外释放及杂质与原研药一致,新建立的标准按照国家要求进行方法学研究,自制样品与原研药进行稳定性研究比较,稳定性3个月后开展体内BE实验,如在开展BE过程中出现不一致现象,我公司按照体内释放曲线进行处方调整,直至达到体内释放与原研药一致,整理申报资料上报,获得一致性评价许可。
一致性评价研究路线图如下:
项目调研资料如下:
一、原研药
对乙酰氨基酚片在英国最早上市时间为1984年,商品名为“Panadol”,生产商为:GlaxoSmithKline Consumer Healthcare,2004年,GSK下属中美史克天津公司上市Panado
国产化品种,商品名“必理通”。
日本PMDA公布的参比制剂商品名为“カロナール錠”,生产商为あゆみ製薬株式会社,1996年首次上市。
二、BCS分类:
三、对照品
对乙酰氨基酚对照品:。
仿制药一致性评价一:背景信息1) 2016年2月6日,国务院颁布了国办发【2016】8号文件“国务院办公厅关于开展仿制药质量和疗效一致性评价的意见”,随后国家又在短时间内连续颁布了一系列关于仿制药一致性评价工作的相关文件和指南,真正拉开了仿制药产品质量和疗效一致性评价工作的序幕。
2) 根据国家仿制药一致性评价政策和时限要求,289种基本药物要求在2018年底完成评价,其他仿制药产品若能成为“首名”或“前三名”,对市场和经济意义重大。
否则,则存在较大风险失去市场甚至文号不保。
二:认识与建议虽然国家提出了明确的时间要求和评价原则,但当前的法规并不具体,企业左右为难。
公司基于长期从事药政法规研究的工作经验,我们对本轮要求的认识如下:1) 不等不靠、主动研究。
2) 要充分重视对产品的信息回顾与整理,重视仿制药评价的整体策划,为开展研究工作打基础。
3) 重视药学研究。
仿制药研究的重点是药学部分,也是国家评价仿制药质量的重要内容,CMC是重中之重,必须先行。
4) 时间紧迫仿制药一致性评价,尤其是基本药物的评价看起来还有2年多时间,实际分解后留给企业的时间已经非常紧张,即使一切顺利也需要20-25个月。
5) 逐步开展,分段进行。
仿制药一致性评价是一个综合工程,链条长,费用高。
尤其是早年完成注册的产品,注册研究与申报资料更加薄弱,适合先初步摸索产品质量现状再进行系统深入的研究。
6) 仿制药一致性评价应分为四个阶段开展三:优势与业绩仿制药一致性评价工作是一个系统工程,需要完整的服务链条和资源配置,包括CMC研发实验室、动物GLP实验室、BE临床实验基地、生化分析实验室和注册服务团队,以及良好的公共资源,并且各个环节都要有经验丰富的技术团队与完善的质量管理体系,要经得起注册现场核查与临床现场核查。
1) 咨询拥有的优势包括以下几方面:✔建立了高水平配置的国家级CMC研发实验室,拥有专业的研发人员和十多年药品研发经验,为中国三大医药技术研究成果转化平台之一,国家基本药物标准溶出度曲线制作承担单位之一;✔合作动物GLP实验室,比格犬等大动物试验不是问题;✔集团内拥有BE临床试验基地与通过FDA审计的生化分析实验室(海口、长春、南京3个BE基地),BE试验优先快速安排;✔18年丰富经验的注册团队,轻松化解技术难题。
制药工程课程设计任务书年产1亿片卡托普利片剂(25mg/片)生产工艺设计班级:组员:指导教师:时间:目录第一章概述...........................................1•卡托普利片介绍 (3)第二章工艺流程 (6)设计概述 (6)生产流程图 (11)第三章物料衡算....................................................... 11 .物料衡算的基础.. (12).物料衡算的基准 (12)•物料衡算条件 (12)物料衡算的范围 (12)•原辅料的物料衡算 (13)•包装材料的消耗 (15)第四章设备选型 (15)•工艺设备的设计与选型 (15)粉碎筛分设备 (16)混合,制粒设备 (18)整粒、总混设备 (22)压片 (23)包装.............................................................. 25第五章车间布置简述. (28)第一章概述卡托普利片简介【通用名】卡托普利片、开博通%【英文名】Captopril Tablets【化学名】1- [(2S) -2-中基-3观基亠氧代丙基]脯氨酸【结构】【分子式】C9H15NO3S【分子量】【性状】本品为糖衣片,除去糖衣后显白色或类白色。
【药理毒理】本品为竞争性血管紧张素转换酶抑制剂,使血管紧张素I不能转化为血管紧张素1【,从而降低外周血管阻力,并通过抑制醛固酮分泌,减少水钠潴留。
本品还可通过干扰缓激肽的降解扩张外周血管。
对心力衰竭患者,本品也可降低肺毛细血管楔压及肺血管阻力,增加心输出量及运动耐受时间。
【药代动力学】本品口服后吸收迅速,吸收率在75%以上。
口服后15分钟起效,1〜小时达血药峰浓度。
持续6〜12小时。
血循环中本品的25%〜30%与蛋白结合。
半衰期短于3小时,肾功能损害时会产生药物潴留。
降压作用为进行性,约数周达最大治疗作用。
卡托普利片一致性评价方案一致性评价方案如下:我单位负责一致性评价过程中,全面贯彻国家局质量源于设计(QbD)理念,首先进行原研药国家局备案,购买国家局认可的原研药,对原研药进行质量剖析,建立原研药产品质量概况(QTPP),作为自制样品的研发目标,并根据本品种确定关键质量属性(CQAs),充分理解的基础上,对于关键工艺参数及其与CQAs间的关联以及潜在的高风险变量进行充分研究和筛选,对自制样品与原研药进行全面质量对比,如自制原处方样品体外释放与原研药不一致,按照原研处方工艺进行改进,处方工艺确定后进行小试三批及中试三批的工艺交接,按照国外药典标准或进口标准与原研药进行质量一致性的质量研究工作,做到体外释放及杂质与原研药一致,新建立的标准按照国家要求进行方法学研究,自制样品与原研药进行稳定性研究比较,按照《生物等效豁免指导原则》对本品的溶解性及渗透性进行研究,提供BE 豁免资料,整理申报资料上报,获得一致性评价许可。
一致性评价研究路线图如下:购买原研药,贵公司提供原处方自制样品项目调研资料如下:一、原研药:卡托普利(开博通)于1981年由百时美施贵宝公司首先开发上市。
百时美施贵宝公司为原研单位,在美国因其安全性和有效性原因被召回停止生产,不能作为参比制剂,参比制剂厂家为美兰实验室有限公司,在美国该公司产品为RLD药物,规格为100mg。
但百时美施贵宝公司在中国生产的卡托普利片仍在销售,商品名为开博通,规格为12.5mg,日本PMDA 确定的参比制剂为第一三共株式会社生产的产品,规格为12.5mg。
建议将三种药物都购买后进行质量比较后确定参比药物。
开博通在美国已退市二、主药理化性质及BCS分类:三、对照品卡托普利对照品:杂质对照品:加拿大TLC公司杂质对照品供应:四、质量标准及处方工艺 质量标准见附件78处方工艺开博通处方:Captopril is a white to off-white crystalline powder that may have a slight sulfurous odor; it is soluble in water (approx. 160 mg/mL), methanol, and ethanol and sparingly soluble in chloroform and ethyl acetate.CAPOTEN is available in potencies of 12.5 mg, 25 mg, 50 mg, and 100 mg as scored tablets for oral administration.Inactive ingredients: microcrystalline cellulose, corn starch, lactose, and stearic acid.辅料为:微晶纤维素,玉米淀粉,乳糖和硬脂酸根据辅料,推测本品片剂生产工艺为湿法制粒工艺。
卡托普利联合非洛地平缓释片治疗原发性老年高血压患者血压变异性的效果评价周晶晶;马小春【摘要】Objective To investigate the curative effects of captopril combined with felodipine sustained-release tablets on essential hypertension in the eldrly,and to observe its efffects on blood pressure variability(BPV).Methods One hundred and forty-four elderly patients with essential hypertension who were treated in our hospital from June 2015 to December 2016 were enrolled in the study. According to the order of hospitalization,these patients were randomly divided into observation group and control group,with 72 patients in each group. The patients in control group were treated by captopril combined with hydrochlorothiazide,however,the patients in observation group were treated by captopril combined with felodipine sustained release tablets.The ambulatory blood pressure in 24 hours,and the changes of BPV before treatment and on 6w,12w after treatment, the therapeutic effects and the changes of glucose and lipid metabolism, indexes of liver and kidney function before and after treatment,the adverse reactions during treatment were statistically analyzed and compared between two groups.Results At 6 weeks and 12 weeks after treatment,the 24 hours mean systolic blood pressure (SBP),d SBP,n SBP,morning peak SBP, 24h systolic blood pressure variability (SBPV), 24h DBPV, d SBPV and d DBPV were significantly decreased in both groups,as compared with thosebefore treatment(P<0.01). The 24h DBP and the d DBP after 12-week treatment in observation group were significant lower than those before treatment (P<0.05). As compared with those in control group,the 24h SBP,d SBP,n SBP,morning peak SBP and DBP were significantly decreasedin observation group on 6w,12w after treatment(P<0.05). On 12w after treatment,the 24h SBPV,24h DBPV,d SBPV and d DBPV were significantly decreased in observation group,as compared with those in control group (P <0.05 or P <0.01). The total effective rates in observation group and control group were 86. 11% and 93. 06% respectively, there was a significant difference between two groups(χ2= 1.860,P>0.05). However there were no significant differences in blood glucose,blood lipid,liver and kidney functions before and after treatment between twogroups,moreover,there was no significant difference in incidence rate of adverse reactions between two groups(χ2=0.067,P>0.05).Conclusion The felodipine sustained - release tablets combined with captopril can effectively reduce the blood pressure in elderly patients with essential hypertension,moreover, which can control BPV,without affecting glycolipid metabolism,liver and kidney functions,therefor,which is a safe and effective treatment scheme.%目的评价非洛地平缓释片联合卡托普利治疗原发性老年高血压患者血压变异性(blood pressure variability,BPV)的临床效果.方法收集2015年6月至2016年12月收治的144例原发性老年高血压患者,按入院顺序随机分为观察组和对照组,每组72例.对照组予以卡托普利联合氢氯噻嗪治疗,观察组采用卡托普利联合非洛地平缓释片治疗.监测2组患者24 h动态血压,观察治疗前、治疗第6周和第12周2组患者BPV的变化,统计治疗效果,分析治疗前、后糖脂代谢及肝肾功能指标的变化,并记录治疗过程中出现的不良反应.结果 2组患者治疗6周和12周后,24 h平均收缩压(SBP)、d SBP、n SBP、晨峰SBP、24 h收缩压变异性(SBPV)、24 h DBPV、d SBPV和d DBPV显著降低,与治疗前比较,差异有统计学意义(P<0.01);24 h DBP和d DBP仅在观察组治疗12周后明显低于治疗前,差异有统计学意义(P<0.05).与对照组比较,观察组治疗6周和12周后,24 h SBP、d SBP、n SBP、晨峰SBP和晨峰DBP明显降低,差异有统计学意义(P<0.05);观察组患者治疗12周后,24 h SBPV、24 h DBPV、d SBPV和d DBPV明显降低,差异有统计学意义(P<0.05或P<0.01).观察组治疗12周后,与治疗6周时比较,24 h SBPV、24 h DBPV、d SBPV和d DBPV明显降低,差异有统计学意义(P<0.05或P<0.01).观察组和对照组治疗总有效率分别为86.11%和93.06%,差异无统计学意义(χ2=1.860,P>0.05).治疗前后2组血糖、血脂及肝肾功能指标均无明显变化,不良反应发生率差异均无统计学意义(χ2=0.067,P=1.000).结论非洛地平缓释片联合卡托普利可有效降低老年高血压,特别是可以控制BPV,且不影响糖脂代谢及肝肾功能,是一种安全有效的治疗方案.【期刊名称】《河北医药》【年(卷),期】2018(040)004【总页数】4页(P502-505)【关键词】老年高血压;血压变异性;非洛地平缓释片;卡托普利【作者】周晶晶;马小春【作者单位】830001 乌鲁木齐市,新疆维吾尔自治区人民医院药学部;830001 乌鲁木齐市,新疆维吾尔自治区人民医院药学部【正文语种】中文【中图分类】R544.1高血压严重影响人们身体健康,特别是对于老年人,高血压的患病率明显增高,在大于80岁的人群中甚至可高达90%[1]。
卡托普利片一致性评价方案
一致性评价方案如下:
我单位负责一致性评价过程中,全面贯彻国家局质量源于设计(QbD)理念,首先进行原研药国家局备案,购买国家局认可的原研药,对原研药进行质量剖析,建立原研药产品质量概况(QTPP),作为自制样品的研发目标,并根据本品种确定关键质量属性(CQAs),充分理解的基础上,对于关键工艺参数及其与CQAs间的关联以及潜在的高风险变量进行充分研究和筛选,对自制样品与原研药进行全面质量对比,如自制原处方样品体外释放与原研药不一致,按照原研处方工艺进行改进,处方工艺确定后进行小试三批及中试三批的工艺交接,按照国外药典标准或进口标准与原研药进行质量一致性的质量研究工作,做到体外释放及杂质与原研药一致,新建立的标准按照国家要求进行方法学研究,自制样品与原研药进行稳定性研究比较,按照《生物等效豁免指导原则》对本品的溶解性及渗透性进行研究,提供BE 豁免资料,整理申报资料上报,获得一致性评价许可。
一致性评价研究路线图如下:
项目调研资料如下:
一、原研药:
卡托普利(开博通)于1981年由百时美施贵宝公司首先开发上市。
百时美施贵宝公司为原研单位,在美国因其安全性和有效性原因被召回停止生产,不能作为参比制剂,参比制剂厂家为美兰实验室有限公司,在美国该公司产品为RLD药物,规格为100mg。
但百时美施贵宝公司在中国生产的卡托普利片仍在销售,商品名为开博通,规格为12.5mg,日本PMDA 确定的参比制剂为第一三共株式会社生产的产品,规格为12.5mg。
建议将三种药物都购买后进行质量比较后确定参比药物。
开博通在美国已退市
二、主药理化性质及BCS分类:
通用名称卡托普利
汉语拼音Captopril
英文名称Katuopuli
BCS分类Ⅲ类
CAS号62571-86-2
化学名称1-[(2S)-2-甲基-3-巯基-1-氧代丙基]-L-脯氨酸
分子式C9H15NO3S
分子量217.28
性状本品为白色或类白色结晶性粉末;有类似蒜的特臭。
熔点:104 〜110℃。
易溶于水,易溶于甲醇和二甲基氯化铵。
它溶解于稀碱金属氢氧化物溶
液。
结构式
三、对照品
卡托普利对照品:
杂质对照品:
加拿大TLC公司杂质对照品供应:
四、质量标准及处方工艺质量标准见附件
1
1
处方工艺
开博通处方:
Captopril is a white to off-white crystalline powder that may have a slight sulfurous odor; it is soluble in water (approx. 160 mg/mL), methanol, and ethanol and sparingly soluble in chloroform and ethyl acetate.
CAPOTEN is available in potencies of 12.5 mg, 25 mg, 50 mg, and 100 mg as scored tablets for oral administration.
Inactive ingredients: microcrystalline cellulose, corn starch, lactose, and stearic acid.
辅料为:微晶纤维素,玉米淀粉,乳糖和硬脂酸
根据辅料,推测本品片剂生产工艺为湿法制粒工艺。
1
济南永康医药科技有限公司一致性评价项目资料五、日本橙皮书资料
主药理化性质:
溶出曲线:
方法:
六、BE实验方案
因为本品主药为BCSⅢ类,因此本品可申请生物等效性实验的豁免。
参照《人体生物等效性试验豁免指导原则》,需提供以下资料支持豁免:
1.药物具有高溶解性;
2.仿制和参比制剂均具有非常快速的溶出;
3.仿制制剂和参比制剂应处方完全相同,各组成用量相似。