1-3-1电离能及其变化规律(第1课时)
- 格式:doc
- 大小:394.50 KB
- 文档页数:4



1-3-1电离能及其变化规律(第1课时)第3节原⼦结构与元素性质(第⼀课时)【学习⽬标】1、以第三周期和第ⅤA族元素为例,写出其元素价电⼦排布、分析原⼦半径变化规律,说出同⼀周期和同⼀主族元素原⼦得失电⼦能⼒变化规律。
2、通过表1-3-2和1-3-3中写出的某些元素第⼀电离能数值,推测第⼀电离能与元素的哪种性质相关。
能通过电离能的定义知道电离能是元素的⼀种性质,能根据第⼀电离能第⼆电离能的定义,分析同⼀元素电离能数据代表的意义,并能通过电离能数据判断元素所在的族序数。
3、以Mg、Al为例分析两种元素得失电⼦能⼒与⾦属活动顺序的区别。
4、通过观察图1-3-4和1-3-5分析元素原⼦第⼀电离能随着元素原⼦序数递增呈现怎样的变化,能总结同⼀周期和同⼀主族变化规律。
能运⽤核外电⼦排布及洪特规则解释第ⅡA族、第ⅤA族和0族元素原⼦第⼀电离能较⼤的原因。
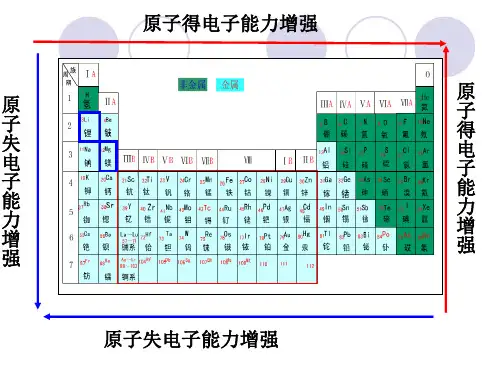
【教学重、难点】第⼀电离能的意义,同⼀周期第⼀电离能变化规律,同⼀主族电离能变化规律【课前预习案】1请同学们写出第3周期及VA族元素原⼦的价电⼦排布;2、请同学们根据写出的价电⼦排布分析元素周期表中元素原⼦得失电⼦能⼒的变化规律。
【课堂探究案】问题探究⼀电离能是元素的⼀种性质。
表1-3-2和表1-3-3种写出了某些元素的第⼀电离能数值。
从已经学过的知识出发,你能推测出电离能描述的是元素的哪种性质吗?你能分析第⼀电离能的数值和性质的关系吗?1、电离能:2、符号和表⽰⽅法:3、电离能的意义:【学以致⽤】1、通过表1-3-2中的数据⽐较Mg和Al的第⼀电离能,的⼤,所以更易失电⼦,但我们以前学习的⾦属失电⼦顺序中,更易失电⼦,与酸反应时更剧烈。
那么这两个顺序为什么是不同的呢?2、你能从Mg、Al的核外电⼦排布出发,解释为什么Mg的第⼀电离能更⼤。
3、那么P和S⽐较,谁的第⼀电离能更⼤呢?为什么?跟踪练习1、从元素原⼦的第⼀电离能数据的⼤⼩可以判断出()A、元素原⼦得电⼦的难易B、元素的主要化合价C、元素原⼦失电⼦的难易D、核外电⼦是分层排布的问题探究⼆观察图1-3-5和1-3-6,请你说明原⼦的第⼀电离能随着元素原⼦序数的递增呈现怎样的变化,并从原⼦结构的⾓度加以解释。

第1课时电离能及其变化规律[学习目标定位] 1.知道原子结构与元素性质间的关系规律。
2.正确理解元素电离能的含义及其变化规律,会用电离能的概念分析解释元素的某些性质。
一、元素的电离能及其变化规律1.元素第一电离能的概念与意义(1)概念:①电离能:气态原子或气态离子失去一个电子所需的最小能量。
符号:I,单位:kJ·mol-1。
②逐级电离能:第一电离能:处于基态的气态原子失去一个电子转化为正一价气态离子所需要的能量叫做第一电离能。
元素第一电离能符号:I1。
第二电离能:气态正一价离子再失去一个电子成为气态正二价离子所需的能量叫做第二电离能;第三电离能和第四、第五电离能依此类推。
通常情况下,第一电离能小于第二电离能小于第三电离能……(2)意义:可以衡量元素的原子失去一个电子的难易程度。
第一电离能数值越小,原子越容易失去一个电子;第一电离能数值越大,原子越难失去一个电子。
2.元素第一电离能变化规律(1)每个周期的第一种元素的第一电离能最小,最后一种元素的第一电离能最大,即一般来说,随着核电荷数的递增,元素的第一电离能呈增大趋势。
(2)同一族,从上到下第一电离能逐渐减小。
1.电离能数值的大小主要取决于原子的核电荷数、原子半径及原子的核外电子排布。
(1)核电荷数、原子半径对电离能的影响①同周期元素具有相同的电子层数,从左到右核电荷数增大,原子半径减小,I1总体上有增大的趋势。
碱金属元素的I1最小,稀有气体元素的I1最大。
②同主族元素从上到下,原子半径增大起主要作用,元素的I1逐渐减小。
(2)核外电子排布对电离能的影响某原子或离子具有全充满、半充满或全空时的电子排布时,电离能较大。
如第ⅡA族元素、第ⅤA族元素比同周期左右相邻元素的I1都大,原因是第ⅡA族元素最外层n s2全充满,第ⅤA族元素最外层n p3半充满,比较稳定。
各周期稀有气体元素的I1最大,原因是稀有气体元素的原子各轨道具有全充满的稳定结构。

第一电离能同主族的变化规律说到化学,很多人可能会觉得有些枯燥。
但其实,化学里的很多规律和变化,跟我们日常生活中的许多事情都息息相关。
今天,我们来聊聊第一电离能(也就是把一个电子从原子里搞出来所需要的能量)在同一主族元素中的变化规律。
这可是个既有趣又实用的知识点哦!1. 认识第一电离能先来个小科普吧。
第一电离能,顾名思义,就是把一个原子中的一个电子给“驱逐”出去时所需要的能量。
这个能量的大小和很多因素有关,比如原子内部的电子排布、原子的核电荷等等。
简单来说,电离能越大,说明原子的“护卫”越严,那个电子就越难被挤走。
2. 同主族元素的电离能变化规律好啦,进入正题了。
我们主要讲讲同一主族的元素第一电离能是怎么变化的。
说到主族,大家可以把它理解成周期表上竖着一列的元素。
这些元素有很多共同的性质,比如化学反应的特点,当然,第一电离能也是一样的。
2.1 由上而下逐渐减小如果你看周期表的那一列,应该会发现,从上往下的元素,第一电离能是逐渐降低的。
这是为什么呢?比如说,周期表的第一主族(就是那一列的最左边,氢、锂、钠、钾什么的),你会发现,氢的第一电离能非常高,而钾的则相对较低。
为啥?因为原子从上往下逐渐变大,电子离原子核越来越远,这样就需要的电离能就减少了。
就像你在沙发上躺着,离电视遥控器远了,自然就不想动了;电离能低了,电子自然也更容易被“抛弃”。
2.2 原子半径与电离能除了原子离核远,另一个原因就是原子半径增大。
原子半径的增大,导致核对外层电子的吸引力减小,电子就更容易被剥离。
这就好比你在宽敞的客厅里,你的狗狗跑来跑去,你自然不容易抓住它;但如果在狭小的房间里,你就容易把它抓住。
原子半径大,电子就“跑”得更远,抓住它们的难度也就小了。
3. 具体例子为了让大家更容易理解,我们可以举几个实际的例子。
比如,我们在主族元素中,氢、锂、钠、钾这些元素的电离能是逐渐降低的。
具体来说:3.1 氢元素氢元素只有一个电子,原子核对这个电子的吸引力非常强,因此它的第一电离能很高。




第1章第3节原子结构与元素性质第1课时电离能及其变化规律编写人:王伟穆玉鹏审核人:白素芳批准人_______________【学习目标】1. 能说出元素电离能的涵义,能应用元素的电离能说明元素的某些性质;2. 认识主族元素电离能的变化规律;3. 体会原子结构与元素周期性的关系。
重点与难点:电离能的含义与一般变化规律,元素的电离能与化合价的关系。
【课前预习案】(20分钟)一、复习回顾(1)请写出第3周期及VA族元素原子的价电子排布。
(2)请根据写出的价电子排布分析元素周期表中元素原子得失电子能力的变化规律二、电离能及其变化规律1. 定义:叫电离能,符号为,单位为。
第一电离能I1:个电子,生成所需要的能量叫做第一电离能。
同一元素的第二电离能第一电离能。
2.意义:运用电离能数值可以判断_________________________________________。
电离能越小,表示;电离能越大,表示。
3. 递变规律:原子的第一电离能随着元素原子序数的递增呈现的关系(1)同一周期从左到右,元素的第一电离能总体上具有的趋势,表示_____________________ _,原因是___________________________;(2)同一主族从上到下,第一电离能,表明____________ _,原因是_____________________________。
(3)过渡元素的第一电离能的变化_____________,随元素原子序数的增加第一电离能从左到右___________ ,原因是___________________________。
【总结】同周期、同主族元素原子第一电离能的变化规律4、实质总之,第一电离能的周期性递变规律是_______________________周期性变化的结果【课堂探究案】探究一、电离能的基本概念阅读课本P22思考以下问题:1.什么是电离能(第一、第二、第三电离能等)2.电离能的符号、单位和表示方法3.观察图1-3-2,图1-3-3,总结电离能的意义[练习]已知M(g)-e- →M +(g)时所需最低能量为502KJ,则M元素的I1=探究二、电离能的变化规律阅读课本P23结合已有知识推测下列问题:1、同周期从左往右第一电离能有何变化趋势?为什么?每一周期第一电离能最大和最小的是哪种元素?2、同主族从上到下第一电离能应如何变化?为什么?3、观察铍原子的各级电离能(图1-3-4),发现同一元素的I1、I2、I3等之间的大小关系?为什么?[交流与讨论]仔细观察第3周期各元素的第一电离能变化趋势,你发现反常现象了吗?可能的原因是什么?写出相应元素的电子排布式进行分析。

第3节元素性质及其变化规律第1课时原子半径及其变化规律元素的电离能及其变化规律发展目标体系构建1.认识元素的原子半径、第一电离能等元素性质的周期性变化。
2.知道原子核外电子排布呈现周期性变化是导致原子半径、第一电离能周期性变化的原因。
3.了解元素周期律的应用价值。
1.影响因素2.变化规律规律原因同周期元素(从左到右) 原子半径逐渐减小(除稀有气体元素外)增加的电子产生的电子间的排斥作用小于核电荷增加导致的核对外层电子的吸引作用同主族元素(自上而下) 原子半径逐渐增大电子层数的影响大于核电荷增加的影响同周期过渡元素(从左到右) 原子半径逐渐减小,但变化幅度不大增加的电子都排布在(n-1)d轨道上,不同元素原子的外层电子(n s)受到原子核吸引作用及内层电子排斥作用的总体效果差别不大利用原子半径和价电子数,可以定性解释元素周期表中元素原子得失电子能力所呈现的递变规律。
(1)同周期元素(从左到右)⎩⎨⎧ 电子层数相同核电荷数增大―→原子半径减小→原子核对外层电子的吸引作用增强―→元素原子失去电子的能力越来越弱,获得电子的能力越来越强(除稀有气体元素外)。
(2)同主族元素(自上而下)⎩⎨⎧ 价电子数相同电子层数增多―→原子半径增大―→原子核对外层电子的吸引作用减弱―→元素原子失去电子的能力越来越强,获得电子的能力越来越弱。
(3)同周期元素和同主族元素原子结构递变的综合结果是:位于元素周期表中金属元素与非金属元素分界线周围元素的原子获得或失去电子的能力都不强。
二、元素的电离能及其变化规律1.电离能(1)概念:气态基态原子或气态基态离子失去一个电子所需要的最小能量。
(2)符号:I ,单位:kJ·mol -1。
2.电离能的分类M(g)――――――→第一电离能(I 1)失去1个e -M +(g)――――――→第二电离能(I 2)失去1个e -M 2+(g)――――――→第三电离能(I 3)失去1个e -M 3+(g)…且I 1<I 2<I 3。
---------------------------------------------------------------最新资料推荐------------------------------------------------------1.3.1电离能及其变化规律电离能及其变化规律 [基础过关] 一、电离能及其变化规律1.下列有关电离能的说法中,正确的是( ) A.第一电离能越大的原子失电子的能力越强 B.第一电离能是元素的原子失去核外第一个电子需要的能量 C.同一周期中,主族元素原子第一电离能从左到右越来越大 D.可通过一种元素各级电离能的数值,判断元素可能的化合价2.下列叙述中正确的是( ) A.同周期元素中,ⅦA 族元素的原子半径最大 B.ⅥA 族元素的原子,其半径越大,越容易得到电子 C.同一元素的电离能 I 1 I 2 I 3 I 4 D.同一周期中,碱金属元素的第一电离能最小 3.下列电子构型的原子中,第一电离能最小的是 ( ) A.ns 2 np 3 B.ns 2 np 4 C.ns 2 np 5 D.ns 2 np 6 4.同周期的第ⅡA、ⅤA 族的元素的第一电离能作为特例比相邻两元素的都高。
在(1)P 和 S,(2)Mg 和 Al,(3)F 和 Ne 三组原子中,分别找出第一电离能较高的原子,这三种原子的原子序数之和是( ) A.35 B.36 C.37 D.38 二、电离能数据的分析及应用 5.元素 X 的各级电离能数据如下:I 1 I 2 I 3 I 4 I 5 I 6 I/(kJmol- 1 ) 578 1 817 2 745 11 578 14 831 18 378 则元素 X 的常见价态是 ( ) A.+1 B.+2 C.+3 D.+6 6.某元素的逐级电离能(kJmol- 1 )分别为 740、1 500、7 700、10 500、13 600、18 000、21 700,1 / 6当它与氯反应时最可能生成的阳离子是 ( ) A.X+B.X 2+ C.X 3+ D.X 4+ 7.在下列各组元素中,有一组原子的第一电离能分别是 1 086 kJmol- 1 、1 402 kJmol -1 、 1 313 kJmol- 1 。
第3节元素性质及其变化规律第1课时原子半径、电离能及其变化规律【学习目标】1.了解原子半径的周期性变化,能用原子结构的知识解释主族元素原子半径周期性变化的原因。
2.能够比较原子半径或离子半径的大小3.了解电离能的概念及其内涵,认识主族元素电离能的变化规律,知道电离能与元素化合价的关系。
知识点1 原子半径及其变化规律【必备知识】1.影响原子半径的因素2.变化规律(1)主族元素同一周期从左到右,增加电子产生的电子间的排斥作用小于核电荷数增加导致的核对外层电子的吸引作用,使原子半径逐渐。
同一主族自上到下,核电荷数增加对外层电子的吸引作用小于增加电子产生的电子间的排斥作用,使原子半径逐渐。
(2)过渡元素同一周期自左至右原子半径逐渐减小,但变化幅度不大。
原因是同一周期过渡元素增加的电子都分布在(n-1)d轨道上,电子间的排斥作用与核对电子的吸引作用大致相当。
[问题探讨]1.影响原子半径大小的因素是什么?2.同一周期原子半径自左至右逐渐减小,同一周期(如第3周期)离子半径是否逐渐减小?3.“对于元素周期表中的一切元素,均满足同周期从左到右原子半径逐渐减小,同族元素从上到下原子半径逐渐增大”这句话是否正确?为什么?【归纳总结】微粒半径大小的比较方法(1)同周期元素的原子半径、最高化合价阳离子半径、最低化合价阴离子半径:随着核电荷数增多,都依次减小(稀有气体除外)。
如第3周期元素微粒的半径:①Na>Mg>Al>Si>P>S>Cl。
②Na+>Mg2+>Al3+。
③P3->S2->Cl-。
(2)同主族元素的原子半径、相同价态阳离子半径和阴离子半径:随着核电荷数增多,依次增大。
如:①第ⅠA族元素原子半径:Li<Na<K<Rb<Cs。
②第ⅠA族阳离子半径:Li+<Na+<K+<Rb+<Cs+。
③第ⅦA族阴离子半径:F-<Cl-<Br-<I-。
(3)核外电子排布(即电子层结构)相同的离子半径:随核电荷数增多,依次减小。
如半径:O2->F->Na+>Mg2+>Al3+,P3->S2->Cl->K+>Ca2+。
第3节原子结构与元素性质(第一课时)
【学习目标】
1、以第三周期和第ⅤA族元素为例,写出其元素价电子排布、分析原子半径变化规律,说出同一周期和同一主族元素原子得失电子能力变化规律。
2、通过表1-3-2和1-3-3中写出的某些元素第一电离能数值,推测第一电离能与元素的哪种性质相关。
能通过电离能的定义知道电离能是元素的一种性质,能根据第一电离能第二电离能的定义,分析同一元素电离能数据代表的意义,并能通过电离能数据判断元素所在的族序数。
3、以Mg、Al为例分析两种元素得失电子能力与金属活动顺序的区别。
4、通过观察图1-3-4和1-3-5分析元素原子第一电离能随着元素原子序数递增呈现怎样的变化,能总结同一周期和同一主族变化规律。
能运用核外电子排布及洪特规则解释第ⅡA族、第ⅤA族和0族元素原子第一电离能较大的原因。
【教学重、难点】
第一电离能的意义,同一周期第一电离能变化规律,同一主族电离能变化规律
【课前预习案】
1请同学们写出第3周期及VA族元素原子的价电子排布;
2、请同学们根据写出的价电子排布分析元素周期表中元素原子得失电子能力的变化规律。
【课堂探究案】
问题探究一
电离能是元素的一种性质。
表1-3-2和表1-3-3种写出了某些元素的第一电离能数值。
从已经学过的知识出发,你能推测出电离能描述的是元素的哪种性质吗?你能分析第一电离能的数值和性质的关系吗?
1、电离能:
2、符号和表示方法:
3、电离能的意义:
【学以致用】
1、通过表1-3-2中的数据比较Mg和Al的第一电离能,的大,所以更易失电子,但我们以前学习的金属失电子顺序中,更易失电子,与酸反应时更剧烈。
那么这两个顺序为什么是不同的呢?
2、你能从Mg、Al的核外电子排布出发,解释为什么Mg的第一电离能更大。
3、那么P和S比较,谁的第一电离能更大呢?为什么?
跟踪练习
1、从元素原子的第一电离能数据的大小可以判断出()
A、元素原子得电子的难易
B、元素的主要化合价
C、元素原子失电子的难易
D、核外电子是分层排布的
问题探究二
观察图1-3-5和1-3-6,请你说明原子的第一电离能随着元素原子序数的递增呈现怎样的变化,并从原子结构的角度加以解释。
电离能的周期性变化规律:
同一周期()
其中:
同一主族()
跟踪练习
2.下列元素中,第一电离能最小的是()
A、K
B、 Na
C、P
D、Cl
问题探究三
阅读分析表格数据:
数据的突跃变化说明了什么?
【跟踪练习】
3、某元素的全部电离能(电子伏特)如下:
A. IA
B. ⅡA
C. ⅢA D 、ⅣA E 、ⅥA F 、ⅤA G 、 ⅦA
【巩固练习】
1、在基态多电子原子中,关于核外电子能量的叙述错误..的是( ) A .最易失去的电子能量最高 B .电离能最小的电子能量最高
C .p 轨道电子能量一定高于s 轨道电子能量
D .在离核最近区域内运动的电子能量最低
2、下表是一些气态原子失去核外不同电子所需的能量(KJ/mol ):
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远
远大于失去第一个电子所需的能量。
_____________________。
②表中X可能为1~13号元素中的__(填写字母)元素。
用元素符号表示X和O形成化合物的化学式_____;
③第三周期元素中,__(填写元素符号)元素原子失去核外第一个电子需要的能量最多。
3、不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。
试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:______________。
各主族中E值的这种变化特点体现了元素性质的_______________变化规律。
(2)同周期内,随原子序数增大,E值增大。
但个别元素的E值出现反常现象。
试预测下列关系式中正确的是______(填写编号,多选倒扣)
①E(砷)>E(硒)②E(砷)<E(硒)③E(溴)>E(硒)④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:_<E<_
4、A、B、C、D四种短周期元素,E是过渡元素。
A、B、C同周期,C、D同主族,A
的原子结构示意图为,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A ______ B_______ C _____ D ________
(2) A的最高价氧化物的化学式为,C元素的基态原子的电子排布式为,C的气态氢化物的化学式为。
(3)D元素所在周期中,第一电离能最小的元素是, D元素在周期表的区。
(4) E元素的单质与氯化铁溶液反应的离子方程式为。