则M元素的 I1 =738 KJ·mol-1.
2、已知Na元素的I1=496 KJ·mol-1,则Na (g) -e- →Na
+(g) 时所需最低能量4为96 KJ
.
精选
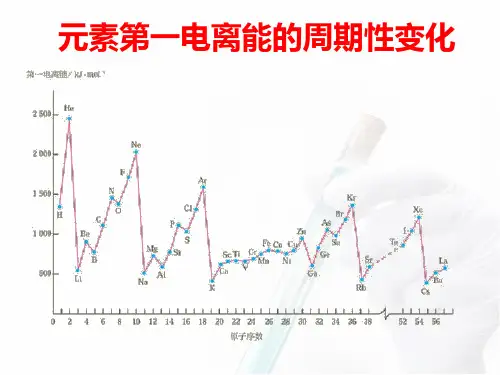
问题探究一 元素的I1与原子失电子能力的关系?
I1越小,越易失电子,金属性越强 I1越大,越难失电子,金属性越弱
精选
交流与讨论
鲍林(L.Pauling)首先提出了元素的电负性 的概念,并指出:电负性就是表示某元素原子 在化合物分子中吸引电子能力大小的相对数值。 根据热化学数据建立了元素的定量标度,指定 氟的电负性为4.0,然后求出其它元素的电负 性。
精选
2.0 2.2
观察教材第23图2-14元素的电负性回答下列问题:
1、同一周期中,元素的电负性如何变化?
精选
2. 判断分子中元素的正负化合价: X 大的,化合价为负; X 小的, 化合价为正; △X = 0, 化合价为零;
请指出下列化合物中化合价为正值的元素。
+1 +1
+3 +4 +1 +1
CH4 NaH NF3 SO2 ICl HBr
精选
3. 化学键型判别 △x≥1.7,通常形成离子键 △x<1.7,通常形成共价键
专题二 原子结构与元素性质
第二单元 元素性质的递变规律
第二课时
第一电离能的周期性变化
精选
一、概念
元素第一电离能
气态 原子失去一个电子形成+1价 气态 阳离子所
需 最低能量。符号 I1 单位:_K_J_·_m__o_l-1
概念应用
1、已知 M(g) - e- →M +(g)时所需最低能量为738 KJ,