元素第一电离能学习指导
- 格式:doc
- 大小:38.50 KB
- 文档页数:2

第3节 原子结构与元素性质第1课时 电离能及其变化规律1.理解电离能的概念及第一电离能的周期性变化规律。
(重点)2.能运用电离能解释元素的性质及第一电离能与原子半径、核外电子排布周期性变化的关系。
(难点)教材整理1 电离能及其分类1.电离能(1)概念:气态原子或气态离子失去一个电子所需要的最小能量。
(2)符号:I ,单位:kJ·mol -1。
2.电离能的分类M(g)――――――――→第一电离能(I 1)失去1个e -M +(g)――――――――→第二电离能(I 2)失去1个e -M 2+(g)――――――――→第三电离能(I 3)失去1个e-M 3+(g)…且I 1<I 2<I 3。
(1)氮原子的原子半径及第一电离能都比氧原子的大。
(√)(2)M(g)→M 2+(g)+2e -所需能量不是第二电离能。
(√)(3)Na 原子在不同状态失去1个电子所需能量相同。
(×)(4)原子的电离能大小I 1>I 2>I 3。
(×)教材整理2 电离能的意义1.电离能越小,该气态原子越容易失去电子。
2.电离能越大,该气态原子越难失去电子。
3.运用电离能可以判断金属原子在气态时失去电子的难易程度。
“第一电离能大的元素的金属性一定比第一电离能小的元素的金属性弱。
”这种说法对吗?【提示】不对。
[核心·突破]1.理解电离能的定义时要把握两点:一是气态(原子或离子);二是最小能量。
2.对于同一元素:I3>I2>I1。
3.运用电离能的数值可以判断金属原子在气态时失去电子的难易程度。
[题组·冲关]1.下列有关电离能的说法中,正确的是()A.第一电离能越大的原子失电子的能力越强B.第一电离能是元素的原子失去核外第一个电子需要的能量C.同一周期中,主族元素原子第一电离能从左到右越来越大D.可通过一种元素各级电离能的数值,判断元素可能的化合价【解析】元素原子的第一电离能越大,表示该元素的原子越难失去电子,A不正确;电离能是气态原子或离子失去核外一个电子需要的最低能量,B不正确;从总的变化趋势上看,同一周期中第一电离能从左到右逐渐增大,但有反常,如N>O,C不正确。


第一电离能同主族的变化规律说到化学,很多人可能会觉得有些枯燥。
但其实,化学里的很多规律和变化,跟我们日常生活中的许多事情都息息相关。
今天,我们来聊聊第一电离能(也就是把一个电子从原子里搞出来所需要的能量)在同一主族元素中的变化规律。
这可是个既有趣又实用的知识点哦!1. 认识第一电离能先来个小科普吧。
第一电离能,顾名思义,就是把一个原子中的一个电子给“驱逐”出去时所需要的能量。
这个能量的大小和很多因素有关,比如原子内部的电子排布、原子的核电荷等等。
简单来说,电离能越大,说明原子的“护卫”越严,那个电子就越难被挤走。
2. 同主族元素的电离能变化规律好啦,进入正题了。
我们主要讲讲同一主族的元素第一电离能是怎么变化的。
说到主族,大家可以把它理解成周期表上竖着一列的元素。
这些元素有很多共同的性质,比如化学反应的特点,当然,第一电离能也是一样的。
2.1 由上而下逐渐减小如果你看周期表的那一列,应该会发现,从上往下的元素,第一电离能是逐渐降低的。
这是为什么呢?比如说,周期表的第一主族(就是那一列的最左边,氢、锂、钠、钾什么的),你会发现,氢的第一电离能非常高,而钾的则相对较低。
为啥?因为原子从上往下逐渐变大,电子离原子核越来越远,这样就需要的电离能就减少了。
就像你在沙发上躺着,离电视遥控器远了,自然就不想动了;电离能低了,电子自然也更容易被“抛弃”。
2.2 原子半径与电离能除了原子离核远,另一个原因就是原子半径增大。
原子半径的增大,导致核对外层电子的吸引力减小,电子就更容易被剥离。
这就好比你在宽敞的客厅里,你的狗狗跑来跑去,你自然不容易抓住它;但如果在狭小的房间里,你就容易把它抓住。
原子半径大,电子就“跑”得更远,抓住它们的难度也就小了。
3. 具体例子为了让大家更容易理解,我们可以举几个实际的例子。
比如,我们在主族元素中,氢、锂、钠、钾这些元素的电离能是逐渐降低的。
具体来说:3.1 氢元素氢元素只有一个电子,原子核对这个电子的吸引力非常强,因此它的第一电离能很高。







元素第一电离能学习指导
电离能是元素性质的一个重要参数。
电离能的大小表示元素的原子失去电子的难易,说明元素通常呈现的化合价状态。
学好元素电离能的有关知识,可以帮助我们更好地了解元素的性质,理解元素原子核外电子的运动状态。
为了帮助同学们更好地学习元素的第一电离能知识,特设计如下问答:
1什么叫电离能?同一元素的各级电离能大小关系是怎样的?为什么?
答:使一个基态的气态原子失去一个电子生成+1价气态阳离子所需的能量叫元素的第一电离能。
常用I1表示,单位为kJ/mol。
从气态+1价离子再失去一个电子生成+2价气态阳离子所需的能量叫该元素的第二电离能,用I2表示,余类推。
M(g)→M+(g)+e I1
M+(g)→M2+(g)+e I2
M2+(g)→M3+(g)+e I3
I1<I2<I3……
因为原子移去一个电子后成为带正电荷的阳离子,
2影响电离能大小的因素有哪些?
答:电离能的大小主要取决于原子的有效核电荷、原子半径以及原子的电子构型。
一般说来,有效核电荷越大,原子半径越小,电离能越大;电子构型越稳定,电离能越大。
如3元素的第一电离能大小的变化规律有哪些?
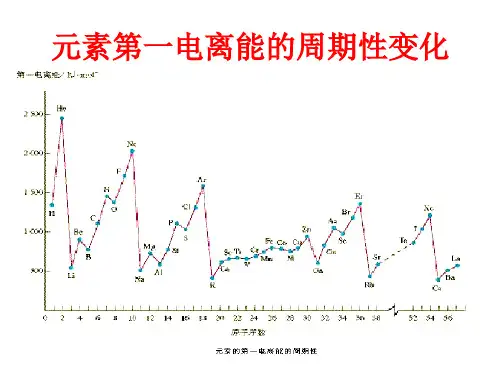
答:同周期元素从左到右,元素的第一电离能总的趋势是逐渐增大的;同一主族自上而下元素的第一电离能依次减小。
但在同一副族中,自上而下元素的第一电离能变化幅度不大,且不规则。
4元素的第一电离能大小与元素性质的关系
答:元素的第一电离能越大,元素的原子越难失去电子,元素的金属性越弱;元素的第一电离能越小,元素的原子越易失去电子,元素的金属性越强。
5为什么第一电离能是Be比B大,Mg比Al大,N比O大?
答:Be和B的电子排布式分别为1s22s2、1s22s22p1,Be的2s亚层有2个电子,为全充满的稳定结构,失去其中一个电子需要较高的能量,而B的2p亚层只有一个电子,结构不稳定,失去这个电子需要的能量较低,所以第一电离能是Be比B大。
同理可以解释“Mg 比Al大”。
N和O的电子排布式分别为1s22s22p3、1s22s22p4,N的2p亚层有3个电子,为半充满的较稳定结构,失去其中一个电子需要较高的能量,而O的2p亚层有4个电子,结构不稳定,失去这个电子需要的能量较低,所以第一电离能是N比O大。
9
试说明其变化的规律性.
[解析]稀有气体的第一电离能是随原子序数的增加而递减的。
因为稀有元素的原子的电子构型相似,随着原子序数的增加,原子核的核电荷增加,内层电子的屏蔽作用也增大,削弱了原子核对外层电子的引力,同时原子半径的递增也使原子核对外层电子的引力减弱。
所以
稀有气体元素的第一电离能是随原子序数(或原子半径)的增加而减小。
[点拨] 第一电离能的大小取决于原子核对外层电子的引力,引力小则电离能小。
10.下表是第二周期元素的第一电离能数据:
⑴将上表数据,分别以原子序数和电离能为横、纵坐标画一草图。
⑵讨论Li ~ Ne电离能变化的总趋势;
⑶试从电子构型解释该图中两处反常现象。
[解析]⑴从Li 到Ne电离能变化的总趋势草图如下:
⑵从电离能数据和图象都可以看出,Li ~ Ne电离能变化的总趋势为逐渐增大。
因为同一周期从左到右(Li ~ F),核电荷依次增大,原子半径逐渐减小,原子核对最外层电子的引力逐渐增大,失去电子的能力逐渐减弱,所以元素的第一电离能逐渐增大。
Ne的外层电子构型为全满的稳定结构,所以氖元素的第一电离能最大。
⑶图中两处电离能大小反常的是Be和B、N和O。
Be和B的电子排布式分别为1s22s2、1s22s22p1,Be和B的最外层电子构型分别为2s2、2s22p1,Be的2s亚层有2个电子,为全充满的稳定结构,失去其中一个电子需要较高的能量,而B的2p亚层只有一个电子,结构不稳定,失去这个电子需要的能量较低,所以第一电离能是Be比B大。
N和O的最外层电子构型分别为2s22p3、2s22p4,N的2p亚层有3个电子,为半充满的较稳定结构,失去其中一个电子需要较高的能量,而O的2p亚层有4个电子,结构不稳定,失去这个电子后变成2p3的较稳定结构,失去这个电子需要的能量较低,所以第一电离能是N比O大。
[点拨]电子构型中,全满(ns2、np6、nd10)、全空(ns0、np0、nd0)或半满(ns1、np3、nd5)是较稳定的结构。