元素第一电离能的变化规律
- 格式:ppt
- 大小:868.50 KB
- 文档页数:15


第一电离能变化规律
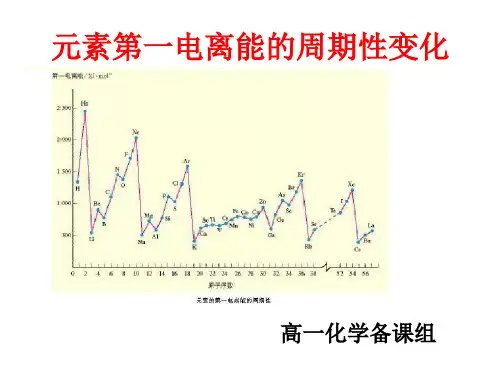
1、随着核电荷数的递增,元素的第一电离能呈现周期性变化。
2、总体上金属元素第一电离能较小,非金属元素第一电离能较大。
3、同周期元素第一电离能从左到右有增大的趋势。
所以同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素。
4、同一周期内元素的第一电离能在总体增大的趋势中有些曲折。
当外围电子在能量相等的轨道上形成全空(p0,d0,f0)、半满(p3,d5,f7)或全满(p6,d10,f14)结构时,原子的能量较低,元素的第一电离能较大。
特例是第二主族的第一电离能大于第三主族,第五主族的第一电离能大于第六主族。
5、同一主族元素从上到下,原子半径增加,有效核电荷增加不多,则原子半径增大的影响起主要作用,第一电离能由大变小,元素的金属性逐渐增强。
6、同一副族第一电离能变化不规则。






第一电离能大小比较规律的特殊情况第一电离能是指一个原子中最外层电子被剥离形成正离子所需要的能量。
根据元素周期表的排列,我们可以发现一些特殊情况,其中的规律令人着迷。
我们来看一下第一电离能最小的情况。
根据元素周期表,我们可以发现第一电离能最小的元素是铯(Cs)和钫(Fr)。
这是因为它们的电子结构特殊,最外层只有一个电子。
这个电子离核距离很远,受到的核吸引力较弱,因此剥离所需的能量较小。
铯和钫是元素周期表中最活泼的金属,它们具有很强的还原性。
接下来,我们来看一下第一电离能最大的情况。
氦(He)是第一电离能最大的元素。
这是因为氦的电子结构中,最外层的电子对称地排列,形成稳定的电子壳层结构。
这种结构使得氦的第一电离能非常高,需要较大的能量才能剥离最外层的电子。
除了铯、钫和氦外,还有一些元素也有特殊的第一电离能大小。
例如,氧(O)的第一电离能要高于氮(N)和氟(F)。
这是因为氧的电子结构中,最外层的电子排列成了一个半满轨道,具有较高的稳定性。
因此,剥离氧的最外层电子需要更大的能量。
另一个特殊情况是碱金属的第一电离能。
碱金属包括锂(Li)、钠(Na)、钾(K)等元素。
它们的第一电离能较低,是因为它们的电子结构中,最外层的电子容易被剥离。
这是因为这些元素的最外层电子只占据了一个s轨道,距离原子核较远,受到的核吸引力较弱。
除了以上特殊情况外,一般情况下,第一电离能随着原子序数的增加而增加。
这是因为原子序数增加,核电荷数增加,而最外层的电子数不变。
因此,最外层电子与原子核之间的电吸引力增强,需要更大的能量才能剥离最外层的电子。
总的来说,第一电离能大小比较规律的特殊情况包括铯和钫的第一电离能最小,氦的第一电离能最大,氧的第一电离能较高,碱金属的第一电离能较低。
除了这些特殊情况外,一般情况下,第一电离能随原子序数增加而增加。
这些规律的存在,揭示了元素周期表中元素性质的奥秘,为我们理解元素的化学行为提供了重要线索。
通过对第一电离能大小比较规律的特殊情况的探讨,我们可以更深入地理解元素周期表中的规律性。


第一电离能规律
定义:电离能规律是指电子从原子的电子能级挥离原子核时所释放的能量。
因此,它决定了原子通过气态到固态的转变、它们的分子结构和化学特性。
第一电离能规律:在电子挥离原子时,释放的能量非常规,即电子从较高的能级挥离到较低的能级时,释放的能量越多。
类似的,从较低的能级挥离原子核到较高的能级会释放一定数量的能量。
由于电子从受核引力影响较弱的能级中脱离,因此电子挥离原子核常常释放较多的能量。
第一电离能规律的物理意义:原子中的电子排列成能级结构,能级越接近原子核,电子和原子核的间距越小,也就是说,这些电子拥有较大的电子亲和力,即受到比较强的核吸引力,需要更多的能量来释放。
在无离子变换中,该能量可以以光、热或其他形式表现其原理。
第一电离能规律的应用:第一电离能规律为原子结构的研究提供了基石,为许多天然和人工制造的物质提供了理论依据;为化学反应的研究提供了基础;还有一些应用于放射性同位素标记及簇状分子的反应等。
此外,也可以应用第一电离能规律来研究原子和分子的光谱,从而对颜色的产生有一定的认识。
根据光子的激发和电子的挥发,原子和分子可以呈现不同的颜色,也可用激发谱作为化学分析的一种方法。
过渡元素第一电离能
过渡元素第一电离能的变化趋势:
1. 同一周期内,从左到右,过渡元素第一电离能呈增大趋势。
这是因为从左到右,原子核正电荷增大,束缚外层电子的能力增强。
2. 同一主族内,从上到下,过渡元素第一电离能呈减小趋势。
虽然原子核正电荷增大,但电子所处的主能级也增大,电子离核距离加大,原子半径增大,导致有效核荷电减小。
3. 过渡元素第一电离能的最高值出现在同周期的最右端,即惰性气体元素。
4. 过渡元素第一电离能的最低值出现在铜(Cu)和铬(Cr)元素,这是由于半满和完全填充的3d轨道的特殊稳定性导致的。
过渡元素第一电离能的大小对元素的化学性质有重要影响,如金属性、离子半径、氧化还原性质等。
了解过渡元素第一电离能的规律有助于深入理解过渡元素的性质和行为。
同一周期第一电离能的变化规律原子中的电子能够被用来描述其特性。
电子能描述了原子,以及电子在原子中的稳定状态。
根据量子力学理论,原子中可用电子能级来描述这些稳定状态,其中同一周期第一电离能是最重要的。
在科学上,第一电离能(简称IP)指的是原子向外面辐射一个电子,需要输出的能量。
在化学上,第一电离能是电子学过程中的基础特性,它可以用来衡量化学反应的活性,以及化合物的稳定性。
同一周期第一电离能的变化规律可以被用来描述原子中电子结构,以及这些结构对化学反应产生的影响。
周期表中的元素,从第一周期到第八周期,原子的结构和能量都不断变化,从而影响到第一电离能的大小和变化规律。
第一周期的这四个元素:氢、氦、锂和铍,其中氢的IP最小,符合可以推断出,第一周期的第一电离能值从最小到最大的顺序是氢、氦、锂和铍。
第二周期元素中,氮的IP最小,说明第二周期的第一电离能从最小到最大的顺序为氮、氧、氟、氖。
第三周期元素中,钠IP最小,因此,第三周期元素第一电离能从最小到最大的顺序为钠、镁、铝和硅。
以上这些周期元素的共性表明,同一周期的第一电离能会依次增大,而第一电离能在第十周期的元素中又有显著的变化。
此外,室温下,同一周期内的原子形成的化合物之间的电离能也是有规律的,如第一周期的第一电离能越来越小,如从氦的IP值为8.18eV到铍的IP值为10.08eV;第二周期的第一电离能越来越大,从氮的IP值为14.53eV到氖的IP值为13.61eV;第三周期的第一电离能也越来越大,从钠的IP值为5.14eV到硅的IP值为8.15eV;第四周期的第一电离能也越来越大,从钾的IP值为4.33eV到硫的IP 值为10.36eV;第五周期的第一电离能则是从铷的IP值为5.99eV到碲的IP值为9.75eV;而第六周期的第一电离能则是从锆的IP值为6.11eV到钍的IP值为7.94eV。
总之,从第一周期到第八周期,同一周期内,原子形成的化合物第一电离能都存在变化规律,其中第一周期的第一电离能从最小到最大,第二周期的第一电离能从最小到最大,第三周期和第四周期的第一电离能亦如此。
同周期和同族元素的第一电离能
(1)同周期元素
表1-3是二、三周期部分元素的核外电子排布和第一电离能,图1-5是第二周期和第三周期元素的第一电离能。
表1-3 第二、三周期部分元素的核外电子排布和第一电离能
图1-5第二、三周期元素的第一电离能
①同周期元素的第一电离能,从左到右递变的总趋势是依次增大,原因是核电荷数增多,而能层数不变,核电荷对核外电子的吸引力增大;
②为什么B的第一电离能反而比Be小?原因是B失去的电子是2p电子,2p 电子的轨道能比2s电子的轨道能高;同理,Al的第一电离能比Mg的第一电离能小;
③氧的第一电离能为什么反而比氮的第一电离能小?原因是氧的第一电离能是失去已经成对的2p电子所需能量,成对电子的相互排斥的能量比核电荷增加吸引2p电子的能量还大,导致氧的第一电离能反比氮的第一电离能低;同理,硫的第一电离能反而小于磷的第一电离能。
图1-6第ⅠA族元素的第一电离能
(2)同族元素
图1-6是碱金属元素的第一电离能。
一般来说,同主族元素的第一电离能,从上到下递变的总趋势是依次降低,原因是核外电子的层数增加而且原子半径递增,核电荷对最外层电子的吸引力降低。
应当注意的是,副族元素的第一电离能从上到下变化趋势与主族不相同,大多是从上到下第一电离能反而增加,原因是虽然核外电子层数增加但原子半径增加却不显著甚至减小,导致核电荷对最外层电子的吸引力增加。