高一化学原子结构1(1)
- 格式:pdf
- 大小:773.40 KB
- 文档页数:9

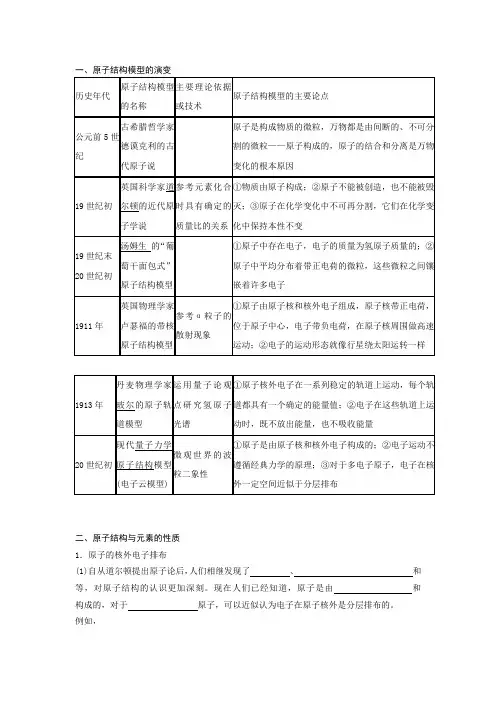
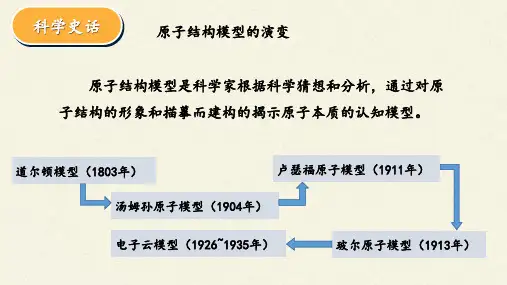
一、原子结构模型的演变历史年代原子结构模型的名称主要理论依据或技术原子结构模型的主要论点公元前5世纪古希腊哲学家德谟克利的古代原子说原子是构成物质的微粒,万物都是由间断的、不可分割的微粒——原子构成的,原子的结合和分离是万物变化的根本原因19世纪初英国科学家道尔顿的近代原子学说参考元素化合时具有确定的质量比的关系①物质由原子构成;②原子不能被创造,也不能被毁灭;③原子在化学变化中不可再分割,它们在化学变化中保持本性不变19世纪末20世纪初汤姆生的“葡萄干面包式”原子结构模型①原子中存在电子,电子的质量为氢原子质量的;②原子中平均分布着带正电荷的微粒,这些微粒之间镶嵌着许多电子1911年英国物理学家卢瑟福的带核原子结构模型参考α粒子的散射现象①原子由原子核和核外电子组成,原子核带正电荷,位于原子中心,电子带负电荷,在原子核周围做高速运动;②电子的运动形态就像行星绕太阳运转一样1913年丹麦物理学家玻尔的原子轨道模型运用量子论观点研究氢原子光谱①原子核外电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;②电子在这些轨道上运动时,既不放出能量,也不吸收能量20世纪初现代量子力学原子结构模型(电子云模型)微观世界的波粒二象性①原子是由原子核和核外电子构成的;②电子运动不遵循经典力学的原理;③对于多电子原子,电子在核外一定空间近似于分层排布二、原子结构与元素的性质1.原子的核外电子排布(1)自从道尔顿提出原子论后,人们相继发现了、和等,对原子结构的认识更加深刻。
现在人们已经知道,原子是由和构成的,对于原子,可以近似认为电子在原子核外是分层排布的。
例如,(2)核外电子排布的表示方法——结构示意图人们常用原子结构示意图表示原子的核外电子排布,如氧原子的结构示意图为,钠原子的结构示意图为。
2.元素的化学性质与原子核外电子排布的关系(1)稀有气体元素原子最外层电子数为8(氦为2),是稳定结构,不易得失电子,因此化学性质稳定,一般不跟其他物质发生化学反应。

高一化学导学案编号:1-1-1 第一章 第一节 原子结构与元素周期律 第一课时 原子结构 【使用说明与学习指导】1、 认真完成完成本学案需要预习的内容。
2、通过预习基本解决本节的学习目标、重点、难点。
【 学习目标】1、认识原子核的结构,懂得质量数和X A Z 的含义。
2、掌握原子序数、核电荷数、质子数、中子数、核外电子数它们之间的关系。
3、知道元素、核素、同位素的含义及它们之间的关系。
课前预习学案(限时15分钟)【自主学习】1、英国物理学家 通过 实验证明:实验结果为: 核式原子模型: 2、原子核的构成原子是由 和 构成的,而原子核又是由更小的微粒—— 和 构成的。
核电荷数= = 质量数= +原子的表示方式:(写名称及符号)原子Z AX 3、 核素元素 核素如氢元素有 、 、 三种核素,分别用 、 、 来表示。
碳元素有3种核素 、 、 。
氧元素有3种核素 、 、 。
同位素 同位素分为 和 两种。
【预习自测】1.自从下列哪项发现或学说开始,化学才开始成为一门科学( )A .阿伏加德罗提出原子——分子学说B .拉瓦锡确定空气的组成C .道尔顿提出近代原子学说D .汤姆生发现电子2.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。
他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。
下列说法正确的是( )A 化学不再是纯实验科学B 化学不再需要实验C 化学不做实验,就什么都不知道D 未来化学的方向还是经验化 3. 下列说法正确的是 ( )A .原子是不可再分的粒子B .相对原子质量就是原子的实际质量C .分子是保持物质性质的最小粒子D .原子是化学变化中的最小粒子 【课堂探究】一.原子核[交流研讨]阅读P 3表格,分析电子、质子、中子的基本数据表,思考讨论以下题 1、电子、质子各带何种电荷?中子带不带电?为什么原子呈电中性? 2、在原子中质子数、核电荷数和电子数之间存在怎样的关系?为什么? 3、原子的质量主要由哪些微粒决定的?4、若忽略电子的质量,质子、中子的相对质量取近似值,试推测原子的相对质量的数值与核内质子数和中子数的关系。


煌敦市安放阳光实验学校第二中学高一化学《第一章原子结构与元素周期律》知识总结必修2
一原子结构:
原子的构成:
相关知识点:原子的构成、核素、同位素、质量数、原子核外电子排布、10电子微粒、18电子微粒
2. 元素周期表和周期律
二、元素周期律与元素周期表
相关知识点:元素周期律、粒子半径大小比较、元素周期表结构、位-构-性关系。
(1)元素周期表的结构
A. 周期序数=电子层数
B. 原子序数=质子数
C. 主族序数=最外层电子数=元素的最高正价数
D. 主族非金属元素的负化合价数=8-主族序数
E. 周期表结构
(2)元素周期律()
A. 元素的金属性和非金属性强弱的比较(难点)
a. 单质与水或酸反置换氢的难易或与氢化合的难易及气态氢化物的稳性
b. 最高价氧化物的水化物的碱性或酸性强弱
c. 单质的还原性或氧化性的强弱
(注意:单质与相离子的性质的变化规律相反)B. 元素性质随周期和族的变化规律
a. 同一周期,从左到右,元素的金属性逐渐变弱
b. 同一周期,从左到右,元素的非金属性逐渐增强
c. 同一主族,从上到下,元素的金属性逐渐增强
d. 同一主族,从上到下,元素的非金属性逐渐减弱
C. 第三周期元素的变化规律和碱金属族和卤族元素的变化规律(包括物理、化学性质)
D. 微粒半径大小的比较规律:
a. 原子与原子
b. 原子与其离子
c. 电子层结构相同的离子
(3)元素周期律的用(重难点)
A. “位,构,性”三者之间的关系
a. 原子结构决元素在元素周期表中的位置
b. 原子结构决元素的化学性质
c. 以位置推测原子结构和元素性质
B. 预测元素及其性质。


高一化学原子的结构知识点总结化学是一门研究物质的构成、性质、结构和变化规律的自然科学。
而原子是构成物质的基本单位,了解原子的结构对于理解物质的性质以及各种化学反应至关重要。
在高一化学学习中,我们接触到了一些关于原子结构的基本知识,下面就来对这些知识点进行总结和归纳。
1. 原子的组成原子是由带负电的电子、带正电的质子和中性的中子组成的。
电子绕着原子核运动,并以负电荷呈球形分布在原子周围的电子壳层中。
原子核是原子的中心,由质子和中子组成,质子带正电荷,中子没有电荷。
原子的质量主要集中在原子核中,电子的质量相对较小。
2. 元素的周期表元素是由同种原子组成的纯物质,元素的种类很多。
为了更好地整理和研究元素,科学家将元素按照一定的规律排列在元素周期表中。
元素周期表按照原子序数递增的顺序排列,但同时也具有一些特定的规律。
元素周期表的列被称为“族”,周期表的行被称为“周期”。
3. 原子序数和质子数元素的原子序数就是元素的质子数,表示元素中原子核中质子的数量。
原子序数决定了一个元素的化学性质,相同元素的原子序数是固定的,不同元素的原子序数是不同的。
4. 同位素同位素是指原子序数相同、质量数不同的元素。
同位素具有相同的化学性质,但物理性质会有所不同。
在元素周期表中,同位素会出现在同一个元素的不同质量数下,例如氢的同位素有氢-1、氢-2、氢-3等。
5. 电子排布原子的电子排布遵循一定的规则,首先填充最内层的电子壳层,然后依次填充外层的电子壳层。
根据泡利不相容原理、奥布规则和洪特规则,我们可以推断出电子在不同的壳层中的填充方式。
6. 化学键化学键是原子之间相互作用的结果,它们将原子聚集在一起形成分子。
常见的化学键包括共价键、离子键和金属键。
共价键是通过共享电子对来形成的,离子键是由正负离子之间的电荷作用力形成的,金属键是由金属中自由移动的电子与金属离子之间的相互作用力形成的。
7. 原子的外层电子原子的外层电子决定了原子的化学性质,它们参与化学反应或者形成化学键。


高一化学教案原子结构9篇原子结构 1教学目标1.常识性了解原子的核式结构.2.常识性了解通常情况下原子是中性的、物体不显电性的原因.3.常识性了解摩擦起电的原因.4.通过观察实物模型、各种媒体资料,建立原子及电子得失的微观图景,培养学生的抽象思维能力.教学建议教材分析本节的教学内容有:原子的微观结构、原子核外电子的得失及物体带电、摩擦起电的原因.是对第一节“摩擦起电两种电荷”的进一步分析和解释,在知识结构上二者是一个有因果关系的整体.教法建议关于原子结构的知识,通过教学要使学生认识到以下几点:原子是由位于中心的原子核和核外电子组成的;原子核带正电,电子带负电;在通常情况下,原子核所带的正电荷与核外电子总共所带的负电荷在数量上相等,整个原子呈中性.关于摩擦起电的原因,可以充分利用电教手段,帮助学生初步建立原子结构的微观图景,确立电子可以转移,从而使物体可以带两种电荷的观点,培养学生的抽象思维能力.在解释摩擦起电现象时,应抓住以下四点:(1)在通常情况下,原子呈中性,由原子组成的物体也呈中性.(2)不同物质的原子核束缚电子的本领不同.(3)两个物体相互摩擦时,哪个物体的原子核束缚电子的本领弱,它的一些电子就会转移到另一个物体上,失去电子的物体带正电,得到电子的物体带等量的负电.(4)强调“摩擦起电的原因是电荷从一个物体转移到另一个物体上,并不是摩擦创造了电荷.”教学设计方案教学过程应突出以下几个方面:一是在复习上一节知识的基础上引入新课.二是充分利用电教手段,帮助学生初步建立一个原子结构的微观图景,确立电子可以转移,从而使物体可以带两种电荷的观点,培养学生的抽象思维能力.三是多启发、多诱导,使教学过程真正成为学生的学习过程.1. 在复习上一节知识的基础上引入新课演示:用玻璃棒与丝绸摩擦吸引轻小物体.提问1:为什么玻璃棒会吸引碎纸屑?提问2:若将与玻璃棒摩擦过的丝绸靠近碎纸屑,会出现什么现象?提问3:自然界里存在几种电荷?提问4:被丝绸摩擦过的玻璃棒带什么电荷?摩擦起电的原因是什么?2.进行新课(1)物质的原子结构①物质由分子组成.简单介绍人类对物质微观世界的认识,并举例说明原子大小的数量级:经过科学家世世代代的研究,现在已经认识到,一切物质都是由分子构成的,分子又是由原子构成的.若把原子看作球形,一般原子的半径只有10-10米左右.设想把1亿个氧原子一个挨着一个地排成一行,也只有几厘米长.原子并不是组成物质的最小微粒,人们认识原子的结构,经历了漫长的时间,直到19世纪末叶,英国科学家汤姆生用实验证明了比原子小得多的带负电的粒子电子的存在,从此才揭示出原子是具有结构的.②原子的核式结构.原子是由位于中心的原子核和核外绕核高速运转的电子所组成;原子核半径约相当于原子半径的十万分之一,原子核几乎集中了原子的全部质量;原子核带正电,电子带负电.电子是带有最小负电荷的粒子,实验证明:一个电子所带电量为1.6×10-19库.一个电子也可叫做一个元电荷,用符号e表示.任何带电体带的电量都是e的整数倍.请同学们计算一下,多少个电子所带的电量是1库?(6.25×1018个)提问:那么通常情况下,物体为什么不显电性呢?(原子核所带的正电荷与核外电子总共所带的负电荷在数量上相等,整个原子呈中性.)不同物质中的原子核所带的电量并不相同,核外电子的数目也不相同.(利用氢原子、氧原子的原子挂图,讲解氢原子、氧原子的原子结构.)了解物质的原子结构.(2)摩擦起电的原因利用电教手段,帮助学生初步建立原子结构模型和原子得失电子的微观图景,并进一步归纳出结论:①不同物质的原子核束缚电子的本领不同.②失去部分电子的物体带正电,得到多余电子的物体带等量的负电.讨论:玻璃棒与丝绸摩擦后,玻璃棒带什么电?为什么带正电?(3)摩擦起电的实质电荷从一个物体转移到另一个物体上,并不是摩擦创造了电荷.探究活动上物理课时,老师精心准备的静电仪器,用丝绸摩擦玻璃棒,常常效果不明显,而满教室静观实验的学生却被自己的衣服不时电一下.因为学生的运动衣裤或其他外衣面料常常用尼龙织物的,比较结实,里面再穿件毛衣比较保暖.查一下起电顺序表就会发现,羊毛(羊皮)排最前面,尼龙排后,这是最容易起电的一套配置.每个人穿戴一套天然的静电起电设备.人的一举一动都造成摩擦,起电过程一刻也不停止.同样我们也可以理解过去的人穿不起毛衣,也没有这些化纤织物,棉布对棉布当然摩擦不出电来.为什么面粉厂车间总要洒水以保持空气潮湿?油罐车为什么要拖一条铁链?手握金属棒用丝绸摩擦能不能带电?化纤衣服面料中加一些金属线有什么用?原子结构 2教学目标1.常识性了解原子的核式结构.2.常识性了解通常情况下原子是中性的、物体不显电性的原因.3.常识性了解摩擦起电的原因.4.通过观察实物模型、各种媒体资料,建立原子及电子得失的微观图景,培养学生的抽象思维能力.教学建议教材分析本节的教学内容有:原子的微观结构、原子核外电子的得失及物体带电、摩擦起电的原因.是对第一节“摩擦起电两种电荷”的进一步分析和解释,在知识结构上二者是一个有因果关系的整体.教法建议关于原子结构的知识,通过教学要使学生认识到以下几点:原子是由位于中心的原子核和核外电子组成的;原子核带正电,电子带负电;在通常情况下,原子核所带的正电荷与核外电子总共所带的负电荷在数量上相等,整个原子呈中性.关于摩擦起电的原因,可以充分利用电教手段,帮助学生初步建立原子结构的微观图景,确立电子可以转移,从而使物体可以带两种电荷的观点,培养学生的抽象思维能力.在解释摩擦起电现象时,应抓住以下四点:(1)在通常情况下,原子呈中性,由原子组成的物体也呈中性.(2)不同物质的原子核束缚电子的本领不同.(3)两个物体相互摩擦时,哪个物体的原子核束缚电子的本领弱,它的一些电子就会转移到另一个物体上,失去电子的物体带正电,得到电子的物体带等量的负电.(4)强调“摩擦起电的原因是电荷从一个物体转移到另一个物体上,并不是摩擦创造了电荷.”教学设计方案教学过程应突出以下几个方面:一是在复习上一节知识的基础上引入新课.二是充分利用电教手段,帮助学生初步建立一个原子结构的微观图景,确立电子可以转移,从而使物体可以带两种电荷的观点,培养学生的抽象思维能力.三是多启发、多诱导,使教学过程真正成为学生的学习过程.1. 在复习上一节知识的基础上引入新课演示:用玻璃棒与丝绸摩擦吸引轻小物体.提问1:为什么玻璃棒会吸引碎纸屑?提问2:若将与玻璃棒摩擦过的丝绸靠近碎纸屑,会出现什么现象?提问3:自然界里存在几种电荷?提问4:被丝绸摩擦过的玻璃棒带什么电荷?摩擦起电的原因是什么?2.进行新课(1)物质的原子结构①物质由分子组成.简单介绍人类对物质微观世界的认识,并举例说明原子大小的数量级:经过科学家世世代代的研究,现在已经认识到,一切物质都是由分子构成的,分子又是由原子构成的.若把原子看作球形,一般原子的半径只有10-10米左右.设想把1亿个氧原子一个挨着一个地排成一行,也只有几厘米长.原子并不是组成物质的最小微粒,人们认识原子的结构,经历了漫长的时间,直到19世纪末叶,英国科学家汤姆生用实验证明了比原子小得多的带负电的粒子电子的存在,从此才揭示出原子是具有结构的.②原子的核式结构.原子是由位于中心的原子核和核外绕核高速运转的电子所组成;原子核半径约相当于原子半径的十万分之一,原子核几乎集中了原子的全部质量;原子核带正电,电子带负电.电子是带有最小负电荷的粒子,实验证明:一个电子所带电量为1.6×10-19库.一个电子也可叫做一个元电荷,用符号e表示.任何带电体带的电量都是e的整数倍.请同学们计算一下,多少个电子所带的电量是1库?(6.25×1018个)提问:那么通常情况下,物体为什么不显电性呢?(原子核所带的正电荷与核外电子总共所带的负电荷在数量上相等,整个原子呈中性.)不同物质中的原子核所带的电量并不相同,核外电子的数目也不相同.(利用氢原子、氧原子的原子挂图,讲解氢原子、氧原子的原子结构.)了解物质的原子结构.(2)摩擦起电的原因利用电教手段,帮助学生初步建立原子结构模型和原子得失电子的微观图景,并进一步归纳出结论:①不同物质的原子核束缚电子的本领不同.②失去部分电子的物体带正电,得到多余电子的物体带等量的负电.讨论:玻璃棒与丝绸摩擦后,玻璃棒带什么电?为什么带正电?(3)摩擦起电的实质电荷从一个物体转移到另一个物体上,并不是摩擦创造了电荷.探究活动上物理课时,老师精心准备的静电仪器,用丝绸摩擦玻璃棒,常常效果不明显,而满教室静观实验的学生却被自己的衣服不时电一下.因为学生的运动衣裤或其他外衣面料常常用尼龙织物的,比较结实,里面再穿件毛衣比较保暖.查一下起电顺序表就会发现,羊毛(羊皮)排最前面,尼龙排后,这是最容易起电的一套配置.每个人穿戴一套天然的静电起电设备.人的一举一动都造成摩擦,起电过程一刻也不停止.同样我们也可以理解过去的人穿不起毛衣,也没有这些化纤织物,棉布对棉布当然摩擦不出电来.为什么面粉厂车间总要洒水以保持空气潮湿?油罐车为什么要拖一条铁链?手握金属棒用丝绸摩擦能不能带电?化纤衣服面料中加一些金属线有什么用?原子结构 3教学目标1.常识性了解原子的核式结构.2.常识性了解通常情况下原子是中性的、物体不显电性的原因.3.常识性了解摩擦起电的原因.4.通过观察实物模型、各种媒体资料,建立原子及电子得失的微观图景,培养学生的抽象思维能力.教学建议教材分析本节的教学内容有:原子的微观结构、原子核外电子的得失及物体带电、摩擦起电的原因.是对第一节“摩擦起电两种电荷”的进一步分析和解释,在知识结构上二者是一个有因果关系的整体.教法建议关于原子结构的知识,通过教学要使学生认识到以下几点:原子是由位于中心的原子核和核外电子组成的;原子核带正电,电子带负电;在通常情况下,原子核所带的正电荷与核外电子总共所带的负电荷在数量上相等,整个原子呈中性.关于摩擦起电的原因,可以充分利用电教手段,帮助学生初步建立原子结构的微观图景,确立电子可以转移,从而使物体可以带两种电荷的观点,培养学生的抽象思维能力.在解释摩擦起电现象时,应抓住以下四点:(1)在通常情况下,原子呈中性,由原子组成的物体也呈中性.(2)不同物质的原子核束缚电子的本领不同.(3)两个物体相互摩擦时,哪个物体的原子核束缚电子的本领弱,它的一些电子就会转移到另一个物体上,失去电子的物体带正电,得到电子的物体带等量的负电.(4)强调“摩擦起电的原因是电荷从一个物体转移到另一个物体上,并不是摩擦创造了电荷.”教学设计方案教学过程应突出以下几个方面:一是在复习上一节知识的基础上引入新课.二是充分利用电教手段,帮助学生初步建立一个原子结构的微观图景,确立电子可以转移,从而使物体可以带两种电荷的观点,培养学生的抽象思维能力.三是多启发、多诱导,使教学过程真正成为学生的学习过程.1. 在复习上一节知识的基础上引入新课演示:用玻璃棒与丝绸摩擦吸引轻小物体.提问1:为什么玻璃棒会吸引碎纸屑?提问2:若将与玻璃棒摩擦过的丝绸靠近碎纸屑,会出现什么现象?提问3:自然界里存在几种电荷?提问4:被丝绸摩擦过的玻璃棒带什么电荷?摩擦起电的原因是什么?2.进行新课(1)物质的原子结构①物质由分子组成.简单介绍人类对物质微观世界的认识,并举例说明原子大小的数量级:经过科学家世世代代的研究,现在已经认识到,一切物质都是由分子构成的,分子又是由原子构成的.若把原子看作球形,一般原子的半径只有10-10米左右.设想把1亿个氧原子一个挨着一个地排成一行,也只有几厘米长.原子并不是组成物质的最小微粒,人们认识原子的结构,经历了漫长的时间,直到19世纪末叶,英国科学家汤姆生用实验证明了比原子小得多的带负电的粒子电子的存在,从此才揭示出原子是具有结构的.②原子的核式结构.原子是由位于中心的原子核和核外绕核高速运转的电子所组成;原子核半径约相当于原子半径的十万分之一,原子核几乎集中了原子的全部质量;原子核带正电,电子带负电.电子是带有最小负电荷的粒子,实验证明:一个电子所带电量为1.6×10-19库.一个电子也可叫做一个元电荷,用符号e表示.任何带电体带的电量都是e的整数倍.请同学们计算一下,多少个电子所带的电量是1库?(6.25×1018个)提问:那么通常情况下,物体为什么不显电性呢?(原子核所带的正电荷与核外电子总共所带的负电荷在数量上相等,整个原子呈中性.)不同物质中的原子核所带的电量并不相同,核外电子的数目也不相同.(利用氢原子、氧原子的原子挂图,讲解氢原子、氧原子的原子结构.)了解物质的原子结构.(2)摩擦起电的原因利用电教手段,帮助学生初步建立原子结构模型和原子得失电子的微观图景,并进一步归纳出结论:①不同物质的原子核束缚电子的本领不同.②失去部分电子的物体带正电,得到多余电子的物体带等量的负电.讨论:玻璃棒与丝绸摩擦后,玻璃棒带什么电?为什么带正电?(3)摩擦起电的实质电荷从一个物体转移到另一个物体上,并不是摩擦创造了电荷.探究活动上物理课时,老师精心准备的静电仪器,用丝绸摩擦玻璃棒,常常效果不明显,而满教室静观实验的学生却被自己的衣服不时电一下.因为学生的运动衣裤或其他外衣面料常常用尼龙织物的,比较结实,里面再穿件毛衣比较保暖.查一下起电顺序表就会发现,羊毛(羊皮)排最前面,尼龙排后,这是最容易起电的一套配置.每个人穿戴一套天然的静电起电设备.人的一举一动都造成摩擦,起电过程一刻也不停止.同样我们也可以理解过去的人穿不起毛衣,也没有这些化纤织物,棉布对棉布当然摩擦不出电来.为什么面粉厂车间总要洒水以保持空气潮湿?油罐车为什么要拖一条铁链?手握金属棒用丝绸摩擦能不能带电?化纤衣服面料中加一些金属线有什么用?原子结构 41.3 原子结构的模型教学目标:1、了解原子的构成、原子结构模型及其在历史上的发展过程,体验建立模型的思想。
精选高一化学知识点原子结构总结
精选高一化学知识点原子结构总结化学是学习生涯的关键阶段,为了能够使同学们在化学方面有所建树,小编特此整理了高一化学知识点原子结构总结,以供大家参考。
原子结构
1.构成原子的粒子间的关系如下
质子数=核电荷数=核外电子数=原子序数
质量关系:质量数=质子数+中子数
2.核素同位素
具有一定数目的质子和一定数目的中子的一种原子,叫做核素。
同一元素的不同核素之间互称为同位素。
3.元素的相对原子质量
质量的1/12之比。
4.核外电子的排布
(1)核外电子运动的特征
电子在核外空间作高速运动,没有确定的轨迹,好像带负电荷的云雾笼罩在原子核周围,人们形象地称之为电子云。
(2)电子层
根据电子的能量差别和通常运动的区域离核的远近不同,核外电子处于不同的电子层。
(3)电子层排布倾向能量最低。