论被动免疫制剂与人用狂犬病疫苗的区别及适用范围
- 格式:doc
- 大小:15.00 KB
- 文档页数:3

狂犬病疫苗和抗狂犬病血清/狂犬病人免疫球蛋白使用知情同意书狂犬病是由狂犬病病毒引起的急性传染病,主要由携带狂犬病病毒的犬、猫等动物咬伤所致。
当人被感染狂犬病病毒的动物咬伤、抓伤及舔舐伤口或粘膜后,其唾液所含病毒经伤口或粘膜进入人体,一旦引起发病,病死率达100%。
被可疑动物咬伤后,立即正确地处理伤口,根据需要注射抗狂犬病血清/狂犬病人免疫球蛋白和严格按照要求全程接种狂犬病疫苗,则能大大减少发病的风险。
抗狂犬病血清/狂犬病人免疫球蛋白能特异地中和狂犬病病毒,可立即起效。
狂犬病疫苗接种后可刺激机体产生抗狂犬病病毒的保护性抗体。
为安全有效地使用狂犬病疫苗和抗狂犬病血清/狂犬病人免疫球蛋白,在您使用之前我们将有关信息告知于您,您可以根据自己的具体情况决定是否使用。
分级接触方式暴露程度医师建议(在相应栏目划勾)患者/监护人员签名I级符合以下情况之一者:1.接触或喂养动物2.完好的皮肤被舔无确认接触方式可靠则不需处臵同意()不同意()II级符合以下情况之一者:1.裸露的皮肤被轻咬2.无出血的轻微抓伤或擦伤轻度1.处理伤口2.接种狂犬病疫苗同意()不同意()III 级符合以下情况之一者:1.单处或多处贯穿性皮肤咬伤或抓伤2.破损皮肤被舔3.开放性伤口或粘膜被污染严重1.处理伤口2.注射狂犬病被动免疫制剂(抗狂犬病血清/狂犬病人免疫球蛋白)3.注射狂犬病疫苗同意()不同意()同意()不同意()【不良反应】狂犬病疫苗:个别人接种后可产生不同程度的不良反应。
如:注射部位局部反应(疼痛、红肿、硬结等);皮疹和荨麻疹等过敏反应;发热或全身不适等全身反应。
抗狂犬病血清:个别人注射后可能出现血清病、皮疹、荨麻疹,甚至过敏性休克等异常反应。
狂犬病人免疫球蛋白:一般无不良反应,少数人有红肿、疼痛感,无需特殊处理可自行恢复。
【注意事项】狂犬病疫苗和抗狂犬病血清/狂犬病人免疫球蛋白属于公民自费、自愿接种疫苗。
接种后留观30分钟,如出现轻微反应,一般不需特殊处理。

狂犬病被动免疫制剂的保护效果一、狂犬病被动免疫制剂的保护效果根据WHO狂犬病专家咨询委员会建议,原卫生部颁布的《狂犬病暴露预防处置工作规范(2009年版)》以及狂犬病疫苗使用说明书等相应规定,III级暴露即一处或多处皮肤出血性咬伤或被抓伤出血,或被不能确定健康状况的动物唾液污染粘膜,应按暴露后程序在彻底清洗伤口的基础上立即接种疫苗并注射ERA或HRIG。
ERA按40IU/kg给予,HRIG按20IU/kg给予,将被动制剂尽可能多的在咬伤局部浸润注射,剩余部分肌肉注射。
对于艾滋病病人等免疫力低下人群,WHO专家建议即使是II级暴露也应联合使用被动免疫制剂。
被动免疫制剂的正确使用十分重要,基本原则是首先在受伤部位局部进行浸润注射,可直接中和刚进入体内的病毒,构建阻遏病毒从伤口向周边神经组织蔓延的第一道屏障。
国内很多暴露后免疫失败病例,是因未联合使用被动免疫制剂或使用方法不当造成的。
Khawplod 的研究指出,已单独使用疫苗,而未能及时使用被动免疫制剂的III 级暴露者,在7天内仍应考虑给予被动免疫制剂,其主要依据为在此期间内机体对疫苗的主动免疫保护尚未产生,而局部伤口的浸润注射对于使用疫苗后机体主动免疫产生的影响较小。
抗狂犬病被动免疫制剂的应用最早可追溯到1891年,当时即有报道采用疫苗免疫的人全血治疗被疯狼严重咬伤者。
此后采用抗血清治疗暴露后病例的案例时有报道,但疗效无法肯定。
WHO狂犬病专家咨询委员会通过现场观察肯定了疫苗与被动免疫制剂的联合应用效果。
1954年在伊朗一起疯狼咬伤18人的事件中,5人仅单用疫苗治疗,最终3人患狂犬病死亡;而暴露程度相似的另外13人采用疫苗联合抗血清治疗,最终仅1人患病死亡。
伊朗一项为期17年的调查显示,单纯用狂犬病疫苗的298名重伤病人病死率为25%,而在疫苗联合抗血清处置的364名重伤病人病死率仅为5.3%。
对感染狂犬病病毒的动物模型的研究也发现,尽管均接种狂犬病疫苗,但是否联用抗狂犬病被动免疫制剂的保护效果存在显著性差异。

【摘要】狂犬病的病死率极高。
狂犬病暴露后必须正确处理伤口,并及时采取规范地主动免疫和被动免疫程序,以减发病的几率和风险。
【关键词】狂犬病狂犬病暴露免疫被动免疫狂犬病是由狂犬病病毒引起的急性传染病,主要由携带狂犬病病毒的犬、猫等动物咬伤所致。
当人被感染狂犬病病毒的动物咬伤、抓伤及舔舐伤口或粘膜后,其唾液所含病毒经伤口或粘膜进入人体,一旦引起发病,病死率达100%[1]。
被狂犬、疑似狂犬或者不能确定健康的狂犬病宿主动物咬伤、抓伤、舔舐粘膜或者破损皮肤处,或者开放性伤口、粘膜接触可能感染狂犬病病毒的动物唾液或者组织时称为狂犬病暴露[2]。
被可疑动物咬伤后,立即正确地处理伤口,根据需要注射抗狂犬病血清/狂犬病人免疫球蛋白和严格按照要求全程接种狂犬病疫苗,则能大大减少发病的风险。
抗狂犬病血清/狂犬病人免疫球蛋白能特异地中和狂犬病病毒,可立即起效,称之为被动免疫。
而狂犬病疫苗接种后可刺激机体产生抗狂犬病病毒的保护性抗体,称为主动免疫[3]。
根据卫生部《狂犬病暴露预防处置工作规范》,判定为ⅱ级暴露者,应当立即处理伤口并接种狂犬病疫苗。
判定为ⅲ级暴露者,应当立即处理伤口并注射狂犬病被动免疫制剂,随后接种狂犬病疫苗。
1狂犬病的主动免疫 1.1接种程序:一般咬伤者于0(注射当天)、3、7、14和28天各注射狂犬病疫苗1个剂量。
狂犬病疫苗不分体重和年龄,每针次均接种1个剂量。
1.2注射部位:上臂三角肌肌内注射。
2岁以下婴幼儿可在大腿前外侧肌肉内注射。
禁止臀部注射。
1.3主动免疫的注意事项 1.3.1首次暴露后的狂犬病疫苗接种应当越早越好。
1.3.2如不能确定暴露的狂犬病宿主动物的健康状况,对已暴露数月而一直未接种狂犬病疫苗者也应当按照接种程序接种疫苗。
1.3.3正在进行计划免疫接种的儿童可按照正常免疫程序接种狂犬病疫苗。
接种狂犬病疫苗期间也可按照正常免疫程序接种其他疫苗,但优先接种狂犬病疫苗。
1.3.4接种狂犬病疫苗应当按时完成全程免疫,按照程序正确接种对机体产生抗狂犬病的免疫力非常关键,当某一针次出现延迟一天或者数天注射,其后续针次接种时间按延迟后的原免疫程序间隔时间相应顺延。




狂犬病疫苗及被动免疫制剂接种操作规程第一篇:狂犬病疫苗及被动免疫制剂接种操作规程狂犬病疫苗及被动免疫制剂接种操作规程一、接种人员要持证上岗,工作衣帽穿戴整齐。
二、接种前要核实接种对象,询问接种者的健康状况、既往疾病史、过敏史及接种疫苗的反应史等。
三、使用一次性注射器,严格“一人一针一管”制度。
四、疫苗要冷藏保存,使用时要核查疫苗是否有效后,充分摇匀,吸取至注射器内。
五、狂犬病疫苗接种部位选上臂三角肌肌内注射(幼儿可在大腿前外侧区肌内注射),常规消毒皮肤,待干后,左手绷紧皮肤,右手持注射器与皮肤呈90度角,快速注入针头的2/3,固定针管,放松皮肤,回抽无血后注入疫苗,快速拔出针头,用消毒干棉棒稍加按压针眼部位。
狂犬病人免疫球蛋白按每公斤体重20个国际单位、抗狂犬病血清按每公斤体重40个国际单位进行计算注射。
不得把被动免疫制剂与狂犬病疫苗注射于同一部位,禁止使用同一注射器注射狂犬病疫苗和被动免疫制剂。
六、向接种对象交代可能出现的反应和注意事项。
嘱接种对象在观察室内留15~30分钟,无反应后方可离开接种门诊。
七、对接种后废弃的注射器和疫苗制剂瓶要正确妥善处理。
第二篇:人用狂犬病疫苗接种知情同意书人用狂犬病疫苗接种知情同意书狂犬病又称恐水病,是由狂犬病毒侵犯神经系统引起的急性传染病,临床特征为脑脊髓炎,表现为兴奋、恐水、怕风、怕光、咽肌痉挛、进行性瘫痪等,尤以恐水最为典型,为人兽共患自然疫源性疾病。
潜伏期为暴露后数天到数年,一般1–3个月。
我国90%以上的人狂犬病是因被感染的犬(包括表面健康的犬)咬伤、抓伤、舔舐粘膜或破损的伤口而感染,其次为猫,其它动物少见。
发达国家多为受狼、狐狸、蝙蝠等野生动物咬伤而感染。
目前尚无有效治疗办法,病死率近乎100%。
被动物咬抓伤后,及时进行正确的伤口处理,加上狂犬病疫苗的注射,可有效预防狂犬病的发生。
因狂犬疫苗接种后,一般于接种后7~14天才可产生保护抗体,对被疯动物咬抓伤者,咬抓伤头、面、颈部者,严重咬伤(伤口深大或多处伤口)者,破损皮肤被舔者,应在伤口清理消毒后,注射狂犬疫苗前,尽早注射狂犬病免疫球蛋白,最迟不得超过伤后7天。

狂犬病暴露者被动免疫制剂的使用作者:柴良梅来源:《医学信息》2014年第20期摘要:狂犬病是临床上比较常见的疾病,这种疾病发病机制比较复杂,诱因也比较多,它主要是人体感染狂犬病病毒后而引起的中枢神经系统疾病。
临床上,狂犬病也被称为恐水症、疯狗病等。
此外,这种病毒通常来说只在动物间进行传播,当人皮肤被感染后的动物咬破或抓伤后也会引起感染。
患者一旦发生狂犬病,病死率几乎为100%。
目前,临床上对于这种疾病缺乏理想的根治方法,近年来,被动免疫制剂在临床上使用较多并取得理想的效果。
关键词:狂犬病;中枢神经系统;恐水症;被动免疫制剂狂犬病是临床上比较常见的疾病,这种疾病发病机制比较复杂,诱因也比较多,它主要是人体感染狂犬病病毒后而引起的中枢神经系统疾病。
目前,临床上对于这种疾病的治疗还没有理想的治疗方法,并且人对于这种疾病没有免疫力,一些看似正常的患者而体内携带有狂犬病病毒的犬>10%。
且这种疾病患者一旦发病,将必死无疑。
因此,对于疾控中心来说:应该加强流浪动物及家养猫、犬的管理,患者一旦被咬伤后,应及时到疾控中心对伤口进行冲洗、消毒等,降低临床死亡率。
近年来,被动免疫制剂在临床上使用较多,本位将主要论述患者使用过程中的使用情况等,先综述如下。
1暴露分级及处置原则根据暴露性质和严重程度将狂犬病暴露分为以下三级,并分别采取不同的处置原则。
I 级。
符合以下情况之一者:①患者曾经接触过动物或者喂养过动物。
②患者皮肤完好,曾经被动物舔过,无确认病史可靠则不需处置II级。
患者符合以下情况:①皮肤被动物咬伤,但是病情并不严重;②裸露皮肤被动物抓伤或者擦伤,但是并没有出血,患者伤口处理后应该接种狂犬病疫苗。
III级。
被咬者符合以下要求:①裸露部位被动物咬伤或者抓伤;②被咬者破损的皮肤处被动物舔过;③粘膜被动物体液污染。
被咬着并且比较严重,患者应该立即处理伤口并注射狂犬疫苗和狂犬病被动免疫制剂。
2伤口处理当人被动物,如:狗、猫等咬伤后,对于不能确定动物是够健康时应该立即对患者伤口进行处理,并进行全面的消毒,对于局部伤口患者而言,其处理时间越早越好。

512017.09基础研究论被动免疫制剂与人用狂犬病疫苗的区别及适用范围张世兰黔西南州兴义市疾病预防控制中心 贵州省兴义市 562400【摘 要】目的:探讨分析狂犬病暴露后接种被动免疫制剂与人用狂犬病疫苗的区别及适用范围。
方法:本文研究对象是随机抽取2017年狂犬病暴露高峰季的100例到我单位接受诊治的暴露对象,根据暴露性质和严重程度分别进行不同的处置。
结果:在随机抽取的100例中其中有60例在狂犬病暴露后进行正确处置接种人用狂犬病疫苗,其中有40例在狂犬病暴露后进行正确处置后进行被动免疫制剂与人用狂犬病疫苗接种。
【关键词】被动免疫制剂;人用狂犬疫苗;区别;适用狂犬病暴露是指被狂犬、疑似狂犬或者不能确定是否患有狂犬病的宿主动物咬伤、抓伤、舔舐粘膜或者破损皮肤处,或者开放性伤口、粘膜直接接触可能含有狂犬病病毒的唾液或者组织。
此外,罕见情况下,可以通过器官移植或吸入气溶胶而感染狂犬病病毒。
按照暴露性质和严重程度将狂犬病暴露分为三级[6, 18,19, 22]:根据暴露性质和严重程度分别进行不同的处置。
在告知暴露者狂犬病危害并获得知情同意后,根据暴露性质和严重程度,及时采取正确的处置措施,分别进行不同的处置。
A 饲养或触摸动物;B 无破损的皮肤被舔舐;C 无破损的皮肤被狂犬病动物或人狂犬病病例的分泌物或排泄物接触。
以上这几种情况属于I 级暴露者,不需要进行处置。
A 裸露的皮肤被轻咬;B 无出血的轻微抓伤或擦伤;以上这几种情况属于II 级暴露者,应该迅速清洗伤口,按照暴露后的免疫程序接种人用狂犬病疫苗。
A 一处或多处皮肤被咬伤或抓伤导致出血;B 有损伤的皮肤被舔舐;C 开放性伤口或粘膜被疑似疯动物的唾液污染;以上这几种情况属于III 级暴露者,应该迅速对伤口进行规范处理,注射狂犬病被动免疫制剂,注射人用狂犬病疫苗。
人用狂犬病疫苗是用狂犬病固定毒aG 株接种生物反应器培养的Vero 细胞,经过培养,收获,浓缩,灭活病毒,纯化后,加入适宜的稳定剂冻干而成,经过疫苗稀释剂复溶后为澄明液体,不含任何防腐剂。

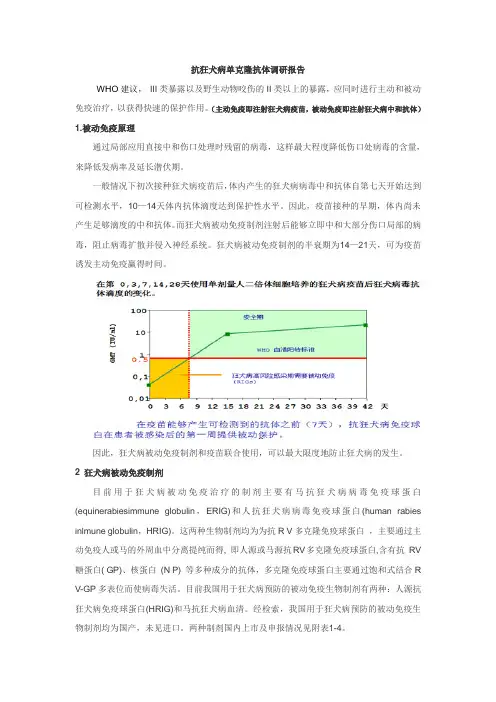
抗狂犬病单克隆抗体调研报告WHO建议,III类暴露以及野生动物咬伤的II类以上的暴露,应同时进行主动和被动免疫治疗,以获得快速的保护作用。
(主动免疫即注射狂犬病疫苗,被动免疫即注射狂犬病中和抗体)1.被动免疫原理通过局部应用直接中和伤口处理时残留的病毒,这样最大程度降低伤口处病毒的含量,来降低发病率及延长潜伏期。
一般情况下初次接种狂犬病疫苗后,体内产生的狂犬病病毒中和抗体自第七天开始达到可检测水平,10—14天体内抗体滴度达到保护性水平。
因此,疫苗接种的早期,体内尚未产生足够滴度的中和抗体。
而狂犬病被动免疫制剂注射后能够立即中和大部分伤口局部的病毒,阻止病毒扩散并侵入神经系统。
狂犬病被动免疫制剂的半衰期为14—21天,可为疫苗诱发主动免疫赢得时间。
因此,狂犬病被动免疫制剂和疫苗联合使用,可以最大限度地防止狂犬病的发生。
2 狂犬病被动免疫制剂目前用于狂犬病被动免疫治疗的制剂主要有马抗狂犬病病毒免疫球蛋白(equinerabiesimmune globulin,ERIG)和人抗狂犬病病毒免疫球蛋白(human rabies inlmune globulin,HRIG)。
这两种生物制剂均为为抗R V多克隆免疫球蛋白,主要通过主动免疫人或马的外周血中分离提纯而得, 即人源或马源抗RV多克隆免疫球蛋白,含有抗RV 糖蛋白( GP)、核蛋白(N P) 等多种成分的抗体,多克隆免疫球蛋白主要通过饱和式结合R V-GP多表位而使病毒失活。
目前我国用于狂犬病预防的被动免疫生物制剂有两种:人源抗狂犬病免疫球蛋白(HRIG)和马抗狂犬病血清。
经检索,我国用于狂犬病预防的被动免疫生物制剂均为国产,未见进口。
两种制剂国内上市及申报情况见附表1-4。
两种狂犬病被动免疫制剂的优缺点狂犬病人免疫球蛋白(HRIG)马抗狂犬病血清(ERIG)理论上存在感染HIV/HCV的危险不存在感染HIV/HCV的危险免疫用制备疫苗要求高,价格高制备抗原容易且价格较低来源受限供应量保证存在伦理道德问题不存在伦理道德问题异源性小有异源性几乎无不良反应接种不良反应发生率高较为安全部需做皮试有过敏风险,必须做皮试半衰期为21天左右半衰期为14天左右由于ERIG 副反应比较严重,而且对某些疫苗的抗体反应有抑制,而HRIG价格昂贵,供应量有限并且有潜在的病原威胁。
狂犬病被动免疫制剂的安全性分析一、狂犬病被动免疫制剂的安全性最早上市的抗狂犬病被动免疫制剂为马抗狂犬病血清,因血清病发生率高达40%,美国于1965年停止了该抗血清的使用。
目前应用的马抗狂犬病血清为利用胃蛋白酶切除ERIG免疫球蛋白Fc段,通过纯化提高制剂中F(ab')2纯度并降低其他血清蛋白成分及过敏物质含量的纯化制剂。
部分马抗狂犬病血清制剂有引起血清病的风险,取决于其总蛋白质含量。
一项对使用者的研究发现,ERIG制剂血清病的发生率从0.82%至6.19%不等。
与ERIG相比,纯化的F(ab')2制剂血清病发生率大幅降低,且大部分为轻症病例。
尽管F(ab')2制剂安全性较好,但由于无法完全除去异性蛋白,仍然不能排除引起个别敏感者出现不良反应的风险。
与马抗狂犬病血清相比,狂犬病人免疫球蛋白(HRIG)则不存在因异源蛋白等因素而导致过敏的风险,不良反应发生率相对更低。
其存在的另一个问题就是因其来源于人,理论上具有传播血源性病原体的潜在风险。
因此在HRIG制品的生产工艺中除采用低温乙醇法外还增加了严格的病毒灭活/去除工艺。
国内大量的实验和资料证实,目前国内外上市的HRIG具有很高的安全性。
分析二、狂犬疫苗行业前景展望由于人二倍体疫苗产量低、大体积生物反应器培养人二倍体细胞难度较大等因素,二代狂犬疫苗仍为国内使用的主流狂犬疫苗。
不过,康华生物正在进行产能扩建,随着三代狂犬疫苗获批企业数量的增加以及产能的不断释放,三代疫苗将逐步替代二代疫苗。
中国疾病预防控制中心报告显示,我国狂犬病疫情主要分布在人口稠密的华中、华南、西南、华东地区。
人群分布上呈三多特征:农村地区病例较多、15岁以下儿童和50岁以上人群发病较多。
中国的犬数超过1亿只,其中大部分在农村散养。
消除狂犬病必须免疫动物,而与欧洲等发达国家的动物普遍免疫不同,中国接种疫苗的动物比例较少。
因此,人用狂犬病疫苗属于刚性需求。
狂犬疫苗是我国主要出口的疫苗之一,预计到2023年,中国狂犬病疫苗主要出口国泰国、埃及、孟加拉国和印度的市场将达6.8亿美元,年均复合增长率为22.2%。
狂犬病疫苗和被动免疫制剂使用知情同意书【疾病简介】狂犬病是由狂犬病病毒引起的急性传染病,主要由携带狂犬病病毒的犬、猫等动物咬伤和抓伤所致。
当人被感染狂犬病病毒的动物咬伤、抓伤及舔舐伤口或黏膜后,其唾液所含病毒经伤口或黏膜进入人体,一旦引起发病,病死率几乎达100%。
被可疑动物咬伤和抓伤后,需及时处置伤口,按要求全程接种狂犬病疫苗,根据需要注射狂犬病被动免疫制剂(抗狂犬病血清/狂犬病人免疫球蛋白/单克隆抗体)能大大减少狂犬病发病风险。
狂犬病疫苗接种后可刺激机体产生抗狂犬病病毒的保护性抗体。
狂犬病被动免疫制剂能特异地中和狂犬病病毒,减少狂犬病发病的可能。
【处置原则】暴露分级接触方式风险程度医师建议(在相应栏目划勾)受种者/监护人确认I级符合以下情况之一者:1.接触或喂饲动物2.完好的皮肤被舔舐无确认接触方式可靠则不需医学处置同意()不同意()II级符合以下情况之一者:1.裸露的皮肤被轻咬2.无明显出血的轻微抓伤或擦伤轻度1.处置伤口2.接种狂犬病疫苗同意()不同意()III级符合以下情况之一者:1.单处或多处贯穿性皮肤咬伤或抓伤2.破损皮肤被舔舐3.开放性伤口、黏膜被唾液或者组织污染4.直接接触蝙蝠重度1.处置伤口2.注射狂犬病被动免疫制剂(抗狂犬病血清/狂犬病人免疫球蛋白/单克隆抗体)3.注射狂犬病疫苗同意()不同意()【不良反应】狂犬病疫苗:一般无不良反应,个别接种者可能会产生不同程度的不良反应。
局部反应有接种部位疼痛、红斑、水肿、瘙痒、硬结等。
全身反应有轻微发热、寒战、晕厥、乏力、头痛、眩晕、关节痛、肌肉痛、胃肠道功能紊乱等。
另外,极个别人可能出现皮疹、荨麻疹、神经性水肿、过敏性休克等过敏反应。
狂犬病人免疫球蛋白:一般无不良反应,少数人可能有注射局部红肿、疼痛感,无需特殊处理可自行恢复。
抗狂犬病血清:个别人注射后可能出现血清病、皮疹、荨麻疹,甚至过敏性休克等异常反应。
单克隆抗体:一般无不良反应,个别人可能出现注射部位肿胀、红斑、疼痛、荨麻疹等异常反应。
狂犬病被动免疫制剂泓域健康(MacroAreas Health)聚焦创新性医疗与健康技术服务,作为行业领先的“互联网+大健康”解决方案供应商,截至2021年底,泓域健康与国内外80余家医疗服务机构建立了战略合作,并在北京、重庆、广州、杭州、南京、武汉、青岛、大连、成都等全国13个地区设立分支机构,系统开展包括“狂犬病中和抗体检测”、“HPV中和抗体检测”等疫苗接种后效果评价在内的多项病理诊断、医学检验、公卫筛查等专业服务。
一、狂犬病被动免疫制剂按暴露前或暴露后程序完成了全程狂犬病疫苗接种者,以后均无需使用被动免疫制剂。
二、常用狂犬疫苗对比狂犬病是由狂犬病毒引起的人兽共患急性传染病,多见于犬、狼、猫等食肉动物,人多因被病兽咬伤而感染。
人患狂犬病后的病死率几近100%,目前对于狂犬病尚无有效治疗手段,因此暴露后接种狂犬疫苗是预防狂犬病的关键。
我国常用狂犬疫苗可分为动物细胞狂犬疫苗和人源细胞狂疫苗两大类,其中动物细胞狂犬疫苗常用地鼠肾、鸡胚、非洲绿猴肾(Vero)细胞,人源细胞狂犬疫苗则使用人二倍体细胞。
三、中国狂犬病疫苗行业竞争格局分析目前已上市的狂犬疫苗产品根据使用细胞基质不同可分为:二倍体细胞、Vero细胞(非洲绿猴肾细胞)、地鼠肾细胞及鸡胚细胞,其中Vero细胞是目前应用最为广泛的细胞基质;根据采用的细胞规模化培养方式,可分为罐培养工艺(片状载体,微载体),转瓶培养工艺。
我国主要生产狂犬疫苗的企业有辽宁成大生物股份有限公司、宁波荣安生物药业有限公司、广州诺诚生物制品股份有限公司等。
其中,成大生物占据狂犬疫苗市场的主要市场份额,2019年批签发占比为73.08%;其次,广州诺诚与宁波荣安的批签发占比分别为6.88%和5.91%;此外,成都康华的第三代狂犬疫苗的批签发占比为3.46%。
四、国内狂犬疫苗市场持续增长近年来,随着我国狂犬病预防教育普及、人用狂犬病疫苗接种数量增加,我国狂犬病预防工作取得了重大进展,在控制狂犬病发病率方面起到了重要作用。
人用狂犬病疫苗和被动免疫制剂研发进展
赖永洁;李靖
【期刊名称】《中国人兽共患病学报》
【年(卷),期】2018(34)6
【摘要】狂犬病(Rabies)是由狂犬病毒(Rabies virus)引起的一种人兽共患病.人一旦发病致死率几乎100%.目前预防狂犬病的人用疫苗为狂犬病毒灭活疫苗.随着基因工程技术的进步,新一代以狂犬病毒G蛋白(Glycoprotein)为免疫原的疫苗在开发中,包括不同表达系统的G蛋白亚单位疫苗,G蛋白DNA疫苗,G蛋白病毒载体疫苗等.同时本文还探讨了未来可能取代狂犬病免疫球蛋白的被动免疫制剂(单克隆抗体)的研发进展.
【总页数】8页(P563-569,573)
【作者】赖永洁;李靖
【作者单位】遵义医学院珠海校区免疫学与病原生物学教研室,珠海519041;珠海联邦制药股份有限公司,珠海 519041
【正文语种】中文
【中图分类】R373
【相关文献】
1.抗狂犬被动免疫制剂研究进展 [J], 金晶;孙丽娜;梁米芳
2.常用被动免疫制剂 [J], 沈永才;李彦
3.被动免疫制剂抗Pg-IgY对大鼠实验性牙周炎的治疗 [J], 孙晓瑜;徐燕;王姹;姜大
川;沈继龙
4.狂犬病暴露者被动免疫制剂的使用 [J], 柴良梅
5.2008~2009年乌兰镇居民被动物致伤及狂犬病疫苗接种情况调查分析 [J], 梁慧敏
因版权原因,仅展示原文概要,查看原文内容请购买。
论被动免疫制剂与人用狂犬病疫苗的区别及适用范围
作者:张世兰
来源:《现代养生·下半月》2017年第09期
[摘要]目的:探讨分析狂犬病暴露后接种被动免疫制剂与人用狂犬病疫苗的区别及适用范围。
方法:本文研究对象是随机抽取2017年狂犬病暴露高峰季的100例到我单位接受诊治的暴露对象,根据暴露性质和严重程度分别进行不同的处置。
结果:在随机抽取的100例中其中有60例在狂犬病暴露后进行正确处置接种人用狂犬病疫苗,其中有40例在狂犬病暴露后进行正确处置后进行被动免疫制剂与人用狂犬病疫苗接种。
[关键词]被动免疫制剂;人用狂犬疫苗;区别;适用
狂犬病暴露是指被狂犬、疑似狂犬或者不能确定是否患有狂犬病的宿主动物咬伤、抓伤、舔舐粘膜或者破损皮肤处,或者开放性伤口、粘膜直接接触可能含有狂犬病病毒的唾液或者组织。
此外,罕见情况下,可以通过器官移植或吸入气溶胶而感染狂犬病病毒。
按照暴露性质和严重程度将狂犬病暴露分为三级[6,18,19,22]:根据暴露性质和严重程度分别进行不同的处置。
在告知暴露者狂犬病危害并获得知情同意后,根据暴露性质和严重程度,及时采取正确的处置措施,分别进行不同的处置。
A饲养或触摸动物;
B无破损的皮肤被舔舐;
C无破损的皮肤被狂犬病动物或人狂犬病病例的分泌物或排泄物接触。
以上这几种情况属于I级暴露者,不需要进行处置。
A裸露的皮肤被轻咬;
B无出血的轻微抓伤或擦伤;
以上这几种情况属于II级暴露者,应该迅速清洗伤口,按照暴露后的免疫程序接种人用狂犬病疫苗。
A一处或多处皮肤被咬伤或抓伤导致出血;
B有损伤的皮肤被舔舐;
C开放性伤口或粘膜被疑似疯动物的唾液污染;
以上这几种情况属于III级暴露者,应该迅速对伤口进行规范处理,注射狂犬病被动免疫制剂,注射人用狂犬病疫苗。
人用狂犬病疫苗是用狂犬病固定毒aG株接种生物反应器培养的Veto细胞,经过培养,收获,浓缩,灭活病毒,纯化后,加入适宜的稳定剂冻干而成,经过疫苗稀释剂复溶后为澄明液体,不含任何防腐剂。
接种人用狂犬病疫苗后,可刺激机体产生抗狂犬病病毒免疫力。
经临床前研究及临床试验,获得签发合格证的狂犬病疫苗方可上市使用。
人用狂犬病疫苗免疫程序及剂量:
1,使用疫苗稀释剂复溶并摇匀后注射。
2,接种程序,途径、部位和剂量:暴露后按照“5针法”(0、3、7、14、28天)接种。
成人和两岁及以上儿童在上臂三角肌进行肌内注射;2岁以下儿童的注射部位是大腿前外侧肌。
不能在臀部肌肉注射人用狂犬病疫苗!
如果有下列情况之一的,建议第一剂接种狂犬疫苗的剂量加倍:
A在注射人用狂犬疫苗前注射过被动免疫制剂的慢性病人;
B存在免疫缺陷病人;
C进行免疫抑制剂(包括抗疟疾药物)治疗的病人;
D老年人群;
E暴露后超过48小时后才注射人用狂犬病疫苗的人员。
狂犬病人免疫球蛋白是通过人用狂犬病疫苗免疫健康人后,采集狂犬病抗体效价较高的血浆,经过相应的科学方法提取,进行严格的病毒灭活处理完成。
目前使用的制剂均通过大量的实验和资料证实具有很高的安全性。
狂犬病人免疫球蛋白按照以下方法使用:
用量:注射剂量按20IU/kg体重计算进行注射。
如果总剂量大于1000IU,需在1~2日内分次注射。
然后接种狂犬病疫苗,被动免疫制剂与人用狂犬病疫苗不能使用同一具注射器注射,不能在相同侧的肢体注射!
用法:暴露部位彻底清创后,用狂犬病人免疫球蛋白尽可能多的在暴露部位作皮下浸润注射,余下剂量进行肌内注射(头部咬伤者可注射于背部肌肉)。
如果暴露部位深、广,则应对本品进行稀释后再注射。
在狂犬病疫苗诱导机体还未产生有效抗体之前,在患者伤口周围浸润注射的被动免疫制剂,可使伤口周围很快产生高浓度的中和抗体,阻断病毒扩散。
暴露者在接种狂犬病疫苗7天后,机体就会产生较高水平的中和抗体,因此狂犬病暴露者在这个阶段就没有必要再注射被动免疫制剂。
由此得出,被动免疫制剂和人用狂犬病疫苗在作用机理及效果上相辅相成,各有特点,医务工作者在接诊狂犬病暴露者后,正确判断伤口暴露级别,给予规范处置。
1资料和方法
1.1一般资料
本文随机抽取了2017年狂犬病暴露高峰季的100例到我单位接受诊治的暴露对象。
1.2处置方法
①判定为I级暴露者,不需要进行处置:
②判定为II级暴露者,需立即清洗伤口,按照“5针法”(0、3、7、14、28天)接种接种狂犬病疫苗。
③判定为III级暴露者,需立即规范处置伤口,注射被动免疫制剂,接种狂犬病疫苗。
2结局
在暴露者知晓狂犬病的危害并取得同意后,根据暴露性质和严重程度,及时采取正确的处置措施,分别进行不同的处置。
3讨论
狂犬病(Rabies)是由狂犬病病毒(Rabies virus)感染引起的一种动物源性传染病。
狂犬病病毒主要通过破损的皮肤或粘膜侵入人体,临床大多表现为特异性恐风、恐水、咽肌痉挛、进行性瘫痪等。
近年来,狂犬病报告死亡数一直位居我国法定报告传染病前列,给人民群众生命健康带来严重威胁。
属于致死性疾病,只能预防,不能治疗,因此,一旦狂犬病暴露后应根据暴露性质和严重程度分别进行不同的处置,才能有效预防狂犬病的发生。