USP标准药用级磷酸氢钙检验原始记录
- 格式:doc
- 大小:246.00 KB
- 文档页数:6


磷酸氢钙检验操作规程1 目的:建立磷酸氢钙检验操作规程。
2 适用范围:适用于磷酸氢钙的检验操作。
3 职责:检验人员对本规程的实施负责。
4 规程:4.1 编制依据:《中国药典》2010年版二部P1164。
4.2 质量指标:见《磷酸氢钙质量标准》。
4.3 仪器与用具:铂丝、电阻炉、电子天平。
4.4 试药与试液:甲基红指示液、草酸铵试液、氯化铵镁试液、钼酸铵试液、硝酸、氢氧化钠滴定液(0.5mol/L)、标准氯化钠、盐酸、锌滴定液、EDTA滴定液。
4.5 操作方法4.5.1 性状:本品为白色粉末;无臭,无味。
本品在水或乙醇中不溶;在稀盐酸或稀硝酸中易溶。
4.5.2 鉴别(化学反应):本品的酸性溶液显钙盐与磷酸盐的鉴别反应。
4.5.2.1钙盐4.5.2.1.1 取铂丝,用盐酸湿润后,蘸取供试品,在无色火焰中燃烧,火焰即显砖红色。
4.5.2.1.2 取供试品溶液(1→20),加甲基红指示液2滴,用氨试液中和,再滴加盐酸至恰呈酸性,加草酸铵试液,即生成白色沉淀;分离,沉淀不溶于醋酸,但可溶于稀盐酸。
4.5.2.2 磷酸盐4.5.2.2.1 取供试品的中性溶液,加硝酸银试液,即生成浅黄色沉淀;分离,沉淀在氨试液或稀硝酸中均易溶解。
4.5.2.2.2 取供试品溶液,加氯化铵镁试液,即生成白色结晶性沉淀。
4.5.2.2.3 取供试品溶液,加钼酸铵试液与硝酸后,加热即生成黄色沉淀;分离,沉淀能在氨试液中溶解。
4.5.3 检查4.5.3.1 氟化物:取本品2.0g,置连接有冷凝管的50ml 蒸馏瓶中,加高氯酸5ml、水15ml与玻璃珠数粒;瓶塞具有2孔,孔内分别插入装有水的滴液漏斗(下接毛细管)与温度计,毛细管前端与温度计汞球均插入液面之下。
用小火加热至135℃,收集馏出液于加有水约10ml的液面之下,再从滴液漏斗通过毛细管逐滴注入水,使温度维持在135℃-140℃;继续蒸馏至馏出液约达70ml,用水冲洗馏液管,并稀释至100ml,摇匀,分取50ml;另取氟对照液[取在105℃干燥至恒重的氟化钠0.2210g,精密称定,置100ml量瓶中,加水溶解并稀释至刻度,摇匀;临用前,精密量取10ml,置1000ml量瓶中,用水稀释至刻度,摇匀,即得每1ml中含氟(F)10μg的对照液]15ml,加水至50ml。

XXXXX药业(饮片)有限公司原药材检验报告单XXXXX药业(饮片)有限公司原药材检验记录【性状】结果:【鉴别】(1)显微鉴别横截面:结果:粉末:结果:(2)薄层鉴别供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加乙醇5ml使溶解。
对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。
再取绿原酸对照品,加乙醇制成每1ml含O.5mg的溶液。
温度:(℃)相对湿度:(%)展开剂:三氯甲烷-丙酮-甲醇-5%浓氨试液(6:1:1:0.1)薄层板:硅胶G显色剂:稀碘化铋钾试液灯光:白光、紫外光灯(365nm)展距:(cm)供试品色谱中,在与对照药材色谱相对应的位置上,显相同颜色的荧光斑点。
S1为对照药材(对照品为中检所提供编号为)S2为对照品(对照品为中检所提供编号为) T为样品结果:【检查】杂质不得过 XX % (附录IX A)杂质称重: g杂质计算结果为: % (标准规定不得过 XX %)结果:膨胀度应不低于4.0(附录IX O)温度:(℃)相对湿度:(%)电子天平型号:CP214 溶剂:水样品编号 1# 2# 3#干燥品称重: g g g第一次样品膨胀后体积: ml ml ml第二次样品膨胀后体积: ml ml ml(两次差异不超过0.1ml)膨胀度计算结果为:(标准规定不低于4.0)结果:水分不得过12.0% (附录Ⅸ H 第一法)。
温度:(℃)相对湿度:(%)烘箱型号:DHG-91012SA型电子天平型号:CP214样品编号 1# 2#第一次称量瓶干燥(105℃ 3h) (g)(g)第二次称量瓶恒重(105℃ 1h) (g)(g)样品称重(g)(g)第一次称量瓶+样品干燥(105℃ 5h) (g)(g)第二次称量瓶+样品恒重(105℃ 1h) (g)(g)水分计算结果为:(%)(标准规定不得过12.0%)结果:总灰分不得过4.0%(附录Ⅸ K)温度:(℃)相对湿度:(%)马福炉型号:SX2.5-10 电子天平型号:CP214样品编号 1# 2#第一次坩锅称重(600℃ 3h) (g)(g)第二次坩锅恒重(600℃ 0.5h) (g)(g)样品称重(g)(g)第一次坩锅+残渣称重(600℃ 3h) (g)(g)第二次坩锅+残渣恒重(600℃ 0.5h) (g)(g)总灰分计算结果为:(%)(标准规定不得过4.0%)结果:酸不溶性灰分不得过3.0%(附录Ⅸ K)。

磷酸氢钙,也被称为二氢磷酸钙,是一种无机化合物,化学式为Ca(H2PO4)2。
这个物质可能有多个用途,包括在食品工业中用作酵母发酵剂、在医学和制药领域中用作矿物补充剂。
至于药典标准,具体的规范和要求可能因国家/地区而异,以下是磷酸氢钙在美国药典(USP)中的一些一般性规定:
1. 标识和外观:
-磷酸氢钙的标识应包括化学名称、化学式、分子量等信息。
外观方面,药品的颜色、形状、气味等也会受到关注。
2. 纯度和含量:
-药典通常规定磷酸氢钙的纯度标准,包括对杂质和重金属的限制。
药物中磷酸氢钙的含量也必须符合规定。
3. 溶解度:
-药典可能规定磷酸氢钙在特定条件下的溶解度,以确保其在给定条件下的适用性。
4. 微生物限度:
-药典可能对磷酸氢钙中的微生物限度进行规定,确保产品的微生物质量符合安全标准。
5. 重金属残留:
-药典通常规定磷酸氢钙中重金属(如铅、汞、镉等)的残留量限制,以确保产品的安全性。
6. 稳定性:
-药典可能要求对磷酸氢钙的稳定性进行评估,以确保其在储存和使用期间的质量和效力。
需要注意的是,不同国家/地区的药典可能存在差异,因此在特定地区销售或使用的磷酸氢钙产品应符合当地相关的法规和药典标准。
药典标准的更新和修改也可能导致规定的变化,因此建议查阅最新版本的药典或相关法规文献。
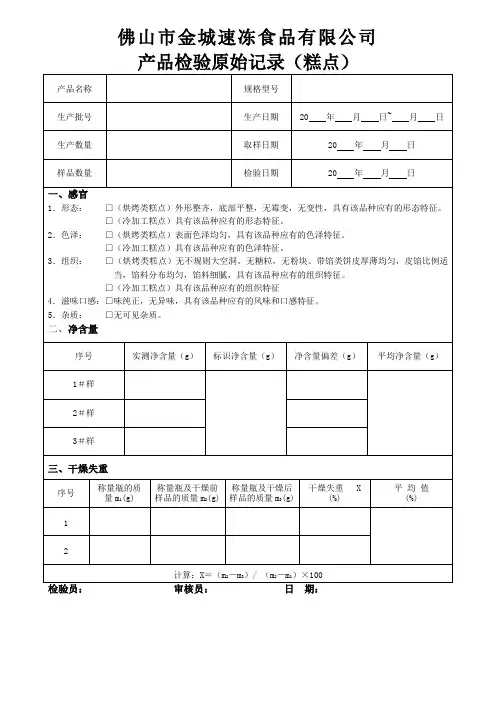
产品检验原始记录(糕点)产品检验报告(糕点)产品检验原始记录(面包)产品检验报告(面包)产品检验原始记录(裱花蛋糕)产品检验报告(裱花蛋糕)产品检验原始记录(冰皮月饼)产品检验报告(冰皮月饼)产品检验原始记录(月饼)产品检验报告(月饼)佛山市金城速冻食品有限公司南海分公司产品检验原始记录(馅料)佛山市金城速冻食品有限公司南海分公司产品检验报告(馅料)理化检验原始记录(一)()佛山市金城速冻食品有限公司()佛山市金城速冻食品有限公司南海分公司 (以“√”标识生产公司)样品名称样品数量生产日期(批次) 取样日期年月日样品来源报告日期年月日判定标准1、水分:检测方法:GB/T 5009.3-2003□称量瓶质量(g): 1# 2# 3#样品+称量瓶质量(g): 1# 2# 3#烘后恒重: 1# 2# 3#样品中水分含量(%): 1# 2# 3#平均标准要求:≤ % 检验人:2、馅含量:检测方法:SN/T 0801.19-1999 □样品总质量(g): 1# 2# 3#馅料质量m(g): 1# 2# 3#1馅料含量(%): 1# 2# 3#平均:标准要求:≥ % 检验人:3、总糖:检测方法:GB/T 5009.7、8-2008□样品质量(g): 1# 2# 3#斐林氏系数(A):试样消耗的体积(ml): 1# 2# 3#试样的总糖(以计) (%) : 1# 2# 3#平均:标准要求:≤ % 检验人:__________审核人:复核人:日期:理化检验原始记录()佛山市金城速冻食品有限公司()佛山市金城速冻食品有限公司南海分公司 (以“√”标识生产公司)样品名称样品数量生产日期(批次) 取样日期年月日样品来源报告日期年月日判定标准1、灰分:检测方法:GB/T 5009.4-2003 □坩埚的质量(g): 1# 2#样品+坩埚质量(g): 1# 2#坩埚和灰分的质量(g): 1# 2#样品中灰分含量(g100/g): 1# 2#平均:标准要求:≤ g/100g 检验人:2、酸价:检测方法:GB/T 5009.37-2003 □样品质量(g): 1# 2#氢氧化钾标准溶液浓度(mol/L):试样消耗标准溶液的体积(ml): 1# 2#试样的酸价(以KOH计)(mg/g): 1# 2#平均:标准要求:≤ mg/g 检验人:3、过氧化值:检测方法:GB/T 5009.37-2003 □样品质量(g): 1# 2#硫代硫酸钠标准溶液浓度(mol/L):试剂空白消耗标准溶液的体积(ml):试样消耗标准溶液的体积(ml): 1# 2#试样的过氧化值: 1# 2#平均:标准要求:≤ g/100g 检验人:__________审核人:复核人:日期:产品检验报告()佛山市金城速冻食品有限公司()佛山市金城速冻食品有限公司南海分公司 (以“√”标识生产公司)样品名称样品数量生产日期(批次) 取样日期年月日样品来源报告日期年月日判定标准检验员:审核员:日期:。
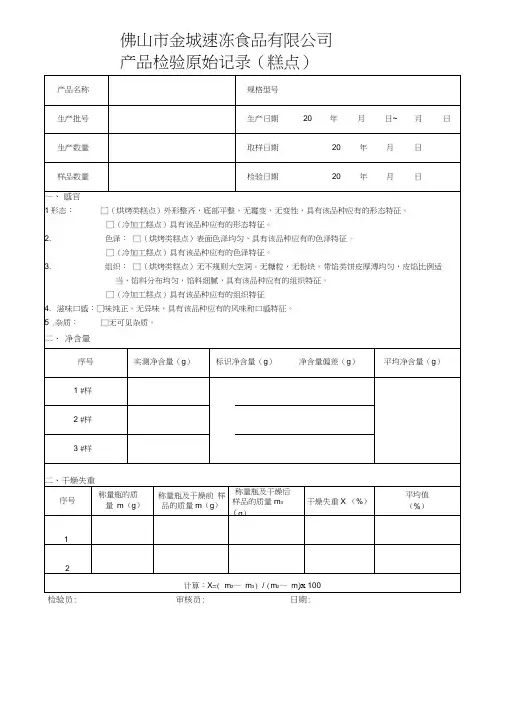
产品检验原始记录(糕点)检验员: 审核员: 日期:产品检验报告(糕点)佛山市金城速冻食品有限公司产品检验原始记录(面包)检验员: 审核员: 日期:产品检验报告(面包)产品检验原始记录(裱花蛋糕)检验员: 审核员: 日期:产品检验报告(裱花蛋糕)产品检验原始记录(冰皮月饼)检验员: 审核员: 日期:产品检验报告(冰皮月饼)产品检验原始记录(月饼)检验员: 审核员: 日期:产品检验报告(月饼)不合格品处置:()返工()报废()改作他用()其它:负责人:日期:产品检验原始记录(月饼)检验员: 审核员: 日期:产品检验报告(馅料)()返工()报废()改作他用()其它:日期:负责人:()佛山市金城速冻食品有限公司()佛山市金城速冻食品有限公司南海分公司(以“V”标识生产公司)审核人: 复核人: 日期:理化检验原始记录(一)判定标准 __________________________________________________________________________1水分:检测方法:GB/T 5009 32003 □称量瓶质量(g ): 1 #2 #3 #样品+称量瓶质量(g ): 1 # 2 # 3 #烘后恒重:1 #2 #3 #样品中水分含量(%):1# 2 #3#平均 标准要求:w%检验人:2、馅含量:检测方法: SN/T 0801.19-1999 □样品总质量(g ): 1 #2 #3 #馅料质量m (g ): 1 # 2 #3 #馅料含量(% :1# 2#3#平均 标准要求:》%检验人3、总糖:样品质量(g ): 1检测方法:GB/T 5009.7、8-2008 □#2 #3#斐林氏系数(A ):试样消耗的体积( ml ): 1# 2 # 3 #试样的总糖(以 计)(%):1#2 #3#平均: 标准要求:w%检验人:理化检验原始记录()佛山市金城速冻食品有限公司()佛山市金城速冻食品有限公司南海分公司(以“V”标识生产公司)判定标准 __________________________________________________________________________1灰分: 检测方法:GB/T 5009.4-2003□坩埚的质量(g): 1#2#样品+坩埚质量(g): 1#2#坩埚和灰分的质量(g): 1#2#样品中灰分含量(glOO/g): 1#2#平均标准要求:w g/lOOg检验人2、酸价:检测方法:GB/T 5009.37-2003 □样品质量(g): 1# 2#氢氧化钾标准溶液浓度(mol/L):试样消耗标准溶液的体积(ml ): 1 # 2#试样的酸价(以KOH计)(mg/g): 1 # 2# 平均标准要求:w mg/g检验人3、过氧化值:检测方法:GB/T 5009.37-2003 □样品质量(g): 1# 2#硫代硫酸钠标准溶液浓度(mol/L ):试剂空白消耗标准溶液的体积(ml):试样消耗标准溶液的体积(ml): 1# 2#试样的过氧化值:1# 2# 平均标准要求:w g/100g检验人审核人: 复核人: 日期:产品检验报告()佛山市金城速冻食品有限公司()佛山市金城速冻食品有限公司南海分公司(以“V”标识生产公司)判定标准___________________________________________________________________________检验员审核员日期。


药品检验原始记录书写范例检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料;为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,内容完整、齐全,书写清晰、整洁。
药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件;药检人员应本着严肃负责的态度,根据检验记录,认真填写“检验卡”,经逐级审核后,由所领导签发“药品检验报告书”。
要求做到:依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范;每一张药品检验报告书只针对一个批号。
1检验记录的基本要求:11原始检验记录应采用统一印制的活页记录纸和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。
凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
1检验人员在检验前,应注意检品标签与所填检验卡的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等。
并将样品的编号与品名记录于检验记录纸上。
13检验记录中,应先写明检验的依据。
凡按中国药典、部颁标准、地方药品标准或国外药典检验者,应列出标准名称、版本和页数;凡按送验者所附检验资料或有关文献检验者,应先检查其是否符合要求,并将前述有关资料的影印件附于检验记录之后,或标明归档编码。
14检验过程中,可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如系完全按照13检验依据中所载方法,可简略扼要叙述;但如稍有修改,则应将改变部分全部记录),实验条件(如实验温度,仪器名称型号和校正情况等),观察到的现象(不要照抄标准,而应是简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算,详见《中国药品检验标准操作规范》第414页)和结果判断等;均应及时、完整地记录,严禁事后补记或抄。
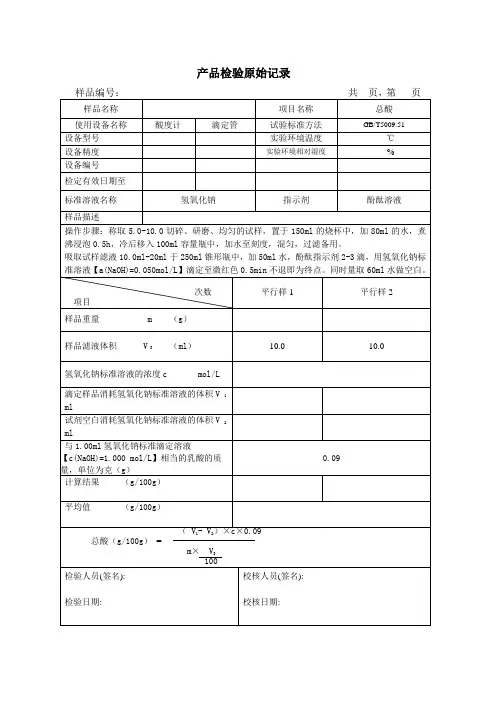
![检验原始记录规范标准[详]](https://uimg.taocdn.com/7f05b47ab4daa58da0114a79.webp)
检验原始记录规1 围本规规定了检验原始记录(以下简称原始记录)的基本要求、格式和填写要求。
2 术语2.1 测定值测定时,从仪器仪表或量具上读取的数值。
2.2 给定值为了得到测定值而按标准规定给出的标准试剂(或试样)特性的量值。
2.3 计算值由给定值和测定值经计算公式,按有效数字运算规则计算所得到的数值。
2.4 灭菌用物理或化学的方法杀灭传播媒介上所有的微生物,使其达到无菌。
2.5 消毒用物理或化学的方法杀灭或清除传播媒介上的病原微生物,使其达到无害化。
3 基本要求3.1 原始记录的容应包括与检验有关的一切资料、数据和现象,完整地记录全过程。
3.2 每一样品的原始记录应给出足够的信息以保证检验能够再现。
3.3 原始记录要格式化,每类样品应有固定的格式。
3.4 多个产品的同一检验项目的原始记录不准集中填写。
3.5 填写原始记录最好用钢笔(蓝色或黑色),也可使用碳素笔,禁止用铅笔。
3.6 字迹清晰、端正,尤其是0到9这10个阿拉伯数字和计量单位的书写。
3.7 改正错误的时要用“杠改法”(在需要改正的地方用红色笔划一横杠,在其右上方进行修改),并加盖改正人本人印章或签字确认。
3.8 记录应卷面整齐、洁净。
同一页中不准使用两色或两色以上的墨水。
3.9 原始记录不允许重新抄写整理,要保持原始记录的原始属性。
3.10 对因检测、填写或其他原因造成得失误,使原始记录出现多处错误或卷面不洁欲作废的原始记录,不准撕毁废弃,应加盖“作废”(红色)章,仍与重新填写的原始记录一起存档。
4 填写要求4.1 样品编号样品编号为样品唯一性标识号,由业务室负责编写,原始记录样品编号应与检验报告及送样单编号一致。
4.2 共页第页4.2.1 原始记录总页数等于手填原始记录页数与仪器设备自动记录页数之和。
4.2.2 手填写的原始记录应采用A4幅面纸,并算为1页:仪器设备自动记录纸不小于32开为1页;如小于32开,要粘贴在A4幅面原始记录纸上。
〔规则:供试品在R f值约0.5处显紫白色斑点〕契合规则。
2.2.5 气〔液〕相色谱:如为援用反省或含量测定项下所得的色谱数据,记载可以复杂;但应注明反省或含量测定项记载的页码。
同2.6.4 气相色谱法和2.6.5 高效液相色谱法项下的记载要求。
2.2.6 紫外-可见吸收光谱:同2.1.7吸收系数项下的记载要求。
2.2.7 红外吸收光谱:记载仪器型号,环境温度与湿度,供试品的预处置和试样的制备方法,对照图谱的来源〔或对照品的图谱〕,并附供试品的红外光吸收图谱。
如惯例操作红外图谱与对照图谱不分歧时,需详细记载供试品的特殊处置进程。
例:
红外光谱:检验日期:2005.08.05 t:28℃RH :65%
按«中国药典»2005年版二部〔附录ⅣC〕方法检验
仪器型号:AE-240型电子天平〔№008〕
Avatar330型智能型傅立叶变换红外光谱仪〔№074〕供试品〔醋酸泼尼松〕的制备〔压片法〕:取供试品0.03~0.2mg,置玛瑙研钵中,参与枯燥的溴化钾细粉15~20mg,充沛研磨混匀,依法压片。
测定:取制成的供试片,目视反省平均无清楚颗粒。
将供试片置于仪器的样品光路中,扣除用同法制成的空白溴化钾片的背景,录制光谱图。
〔红外吸收图谱附后见页〕。
XXXXX药业(饮片)有限公司1原药材检验报告单2检验单号:345XXXXX药业(饮片)有限公司6原药材检验记录7检验单号:8【性状】9101112结果:【鉴别】(1)显微鉴别1314横截面:15161718结果:粉末:192021结果:2223(2)薄层鉴别24供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加乙醇5ml使溶解。
2526对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。
再取绿27原酸对照品,加乙醇制成每1ml含O.5mg的溶液。
28温度:(℃)29相对湿度:(%)30展开剂:三氯甲烷-丙酮-甲醇-5%浓氨试液31(6:1:1:0.1)32薄层板:硅胶G33显色剂:稀碘化铋钾试液34灯光:白光、紫外光灯(365nm)35展距:(cm)36供试品色谱中,在与对照药材色谱相对应的37位置上,显相同颜色的荧光斑点。
38S1为对照药材(对照品为中检所提供编号39为)40S2为对照品(对照品为中检所提供编号41为)42T为样品结果:434445【检查】杂质不得过 XX % (附录IX A)杂质称重: g4647杂质计算结果为: % (标准规定不得过 XX %)48结果:膨胀度应不低于4.0(附录IX O)4950温度:(℃)相对湿度:(%)51电子天平型号:CP214 溶剂:水52样品编号 1# 2# 3#53干燥品称重: g g g54第一次样品膨胀后体积: ml ml ml55第二次样品膨胀后体积: ml ml ml56(两次差异不超过0.1ml)57膨胀度计算结果为:(标准规定不低于4.0)58结果:59水分不得过12.0% (附录Ⅸ H 第一法)。
6061温度:(℃)相对湿度:(%)62烘箱型号:DHG-91012SA型电子天平型号:CP214样品编号 1# 2#6364第一次称量瓶干燥(105℃ 3h) (g)(g)第二次称量瓶恒重(105℃ 1h) (g)(g)6566样品称重(g)(g)67第一次称量瓶+样品干燥(105℃ 5h) (g)(g)68第二次称量瓶+样品恒重(105℃ 1h) (g)(g)69水分计算结果为:(%)(标准规定不得过12.0%)7071结果:7273总灰分不得过4.0%(附录Ⅸ K)74温度:(℃)相对湿度:(%)75马福炉型号:SX2.5-10 电子天平型号:CP21476样品编号 1# 2#77第一次坩锅称重(600℃ 3h) (g)(g)78第二次坩锅恒重(600℃ 0.5h) (g)(g)79样品称重(g)(g)80第一次坩锅+残渣称重(600℃ 3h) (g)(g)81第二次坩锅+残渣恒重(600℃ 0.5h) (g)(g)82总灰分计算结果为:(%)(标准规定不得过4.0%)83结果:8485酸不溶性灰分不得过3.0%(附录Ⅸ K)。
药品检验原始记录的书写规定药品检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料,具有科学性、规范性和可追溯性。
规范检验记录是保证再现实验过程,提高检验工作质量,实现实验室质量方针和质量目标的有效方法,从而提高实验室的核心竞争力,更好地发挥技术支撑和服务社会的功能。
为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,标准正确,数据准确,内容完整、齐全,书写清晰、整洁。
1、检验记录的基本要求:1.1 检验人员在检验前,应进行核对。
注意检品与检品卡的内容是否相符,逐一查对检品的编号、名称、规格、产品批号、有效期,生产单位、检验项目、检验目的、检验依据、收检日期、检品数量和包装情况等,并将相关内容记录于检验原始记录纸上。
1.2 检验原始记录应记录在检验原始记录纸上,用统一的文件编号,采用活页记录纸和各类专用检验记录表格,检验过程可采用计算机打印或用蓝黑色钢笔、碳素笔或签字笔书写,试验数据如取样量、溶剂用量等应用钢笔、碳素笔或签字笔书写,各检验项目的记录格式参照各检验科室原始记录模板书写,内容应包括所有与检验有关的信息。
凡用仪器打印的数据与图谱,应注明检品编号、文件编号、检验项目(包括图谱的具体试验名称和数据归属),并有检验者、校对者签名,需要引用的数据要在相关数据前打勾。
仅有数据(如不溶性微粒)的打印纸附于检验原始记录后,或粘贴于原始记录的适宜处,并加盖检验者骑缝章或骑缝签字。
如用热敏纸打印数据,为防止日久褪色难以识别,应以钢笔、碳素笔或签字笔将主要数据记录于原始记录纸上。
1.3 检验依据按国家(中国药典)、部、局颁标准等成册标准检验的,应在检验原始记录中写明标准名称、版本和页数;按单篇标准检验的,应在检验原始记录中写明标准名称并将标准复印件附于检验原始记录最后面;按委托人提供检验资料或有关文献检验的,应在检验原始记录中写明标准名称并将有关资料附于检验原始记录最后面(注册检验资料除外)。
3檢查3.1儀器及用具:馬弗爐、電爐、乾燥箱、冷凝管、蒸餾瓶、膠塞、玻璃珠、滴液漏斗(下接毛細管)、溫度計、燒杯、容量瓶、納氏比色管、100ml標準磨口錐形瓶、標準磨口塞、具孔的有機玻璃旋塞、導氣管、坩堝、刻度吸管、棉花、移液管、錐形瓶、萬分之一分析天平、滴定管、蒸發器。
3.2試劑及試液:高氯酸、純化水、氯化鈉、茜素磺酸鈉指示液、氫氧化鈉滴定液(0.05mol/L)、鹽酸滴定液(0.02mol/L)、0.025%硝酸釷溶液、硝酸、稀硝酸、標準氯化鈉溶液、硝酸銀試液、稀鹽酸、標準硫酸鉀溶液、25%氯化鋇溶液、硫酸鉀試液、標準鉛溶液、醋酸鹽緩衝液(PH3.5)、稀焦糖溶液、硫代乙酰胺試液、醋酸鉛、碘化鉀試液、酸性氯化亞錫試液、鋅粒、溴化汞試紙、標準砷溶液、氟化鈉、鹽酸。
3.3測定法3.3.1 氟化物:取本品2.0g,置聯接有冷凝管的50ml蒸餾瓶中,加高氯酸5ml,純化水15ml與玻璃珠數粒,瓶塞具有2孔,孔內分別插入裝有水的滴液漏斗(下接毛細管)與溫度計,毛細管前端與溫度計汞球均插入液面之下,用小火加熱至135℃,收集餾出液于加有水約10ml的液面之下,再從滴液漏斗通過毛細管逐滴注入水,使溫度維持在135~140℃;繼續蒸餾至餾出液約達70ml,用水沖洗餾液管,並稀釋至100ml,搖勻,分取50ml;另取氟對照液[精密稱取在105℃乾燥至恒重的氟化鈉0.2210g,置100ml量瓶中,加水溶解並稀至刻度,搖勻;臨用前,精密量取10ml 置1000ml量瓶中,用水稀釋至刻度,搖勻,即得每1ml含氟(F)10u g的對照液]15ml,加水至50ml,在上述供試品溶液與對照液中,各加茜素磺酸鈉指示液1.5ml,滴加氫氧化鈉滴定液(0.05mol/L)至溶液剛顯紅色,各加鹽酸滴定(0.02mol/L)5ml,用0.025%硝酸釷溶液滴定至溶液顯紅色,滴定供試品溶液消耗的容積(ml)不得超過滴定對照液消耗的容積(ml)(0.015%)3.3.2氯化物:取本品0.20g,加水10ml與硝酸2ml,緩緩熱至溶解、放冷,照《氯化物檢查法標準操作規程》檢查,與標準氯化鈉溶液10ml 製成的對照液比較,不得更濃(0.05%)。