元素符号表示的量
- 格式:ppt
- 大小:625.00 KB
- 文档页数:27

![科学八年级下册第一章第7节元素符号表示的量[1]](https://uimg.taocdn.com/302c80651ed9ad51f01df21b.webp)
元素符号表示的量(一)学习目标:1、会查阅相对原子质量表。
2、能根据化学式计算物质的相对分子质量。
3、能根据化学式计算元素含量以及各元素的质量比。
(二)重点和难点1、能解释化学式表示的意义;2、根据化学式计算相对原子质量和元素的质量比。
[知识要点1]相对原子质量1. 相对原子质量以一种碳原子(碳—12)的质量的1/12作为标准,则1份质量为 1.993×10-26×1/12=1.661×10-27千克,把其他原子的质量跟这个标准相比较所得的比值,叫做这种原子的相对原子质量。
注意:相对原子质量的单位符号为“1”,“1”不用明确写出,因此,相对质量是有单位的。
以下的相对分子质量的单位也为“1”。
2、查阅相对原子质量:根据元素符号在元素周期表中的位置就可以查出其相对原子质量,也可以在相对原子质量表中按其字母的排列顺序查阅。
3、相对分子质量化学式中各原子的相对原子质量的总和就是相对分子质量。
单位是“1”。
4、相对分子质量的计算第一,写出正确的化学式,如H2O第二,查出各原子的相对原子质量,如H:1,O:16第三,计算出分子中各元素的相对原子质量乘以其原子个数的和,即为该分子的相对分子质量。
如H2O的相对分子质量=1×2+16=185、化学式的涵义化学式涵义微观由分子构成的物质中化学式表示该物质的一个分子注意:(1)质子和中子的质量与C—12原子质量的1/12(标准量)相当,因此,一个质子或中子的相对质量即为1;(2)电子的质量很小,其相对质量可以忽略;(3)相对原子质量=质子数+中子数【典型例题】例1、一个C-12原子的质量为m千克,某元素一个原子的质量为n千克,则该元素的相对原子质量为()A、m/12nB、12n/mC、n/12mD、12m/n精析:解答这类习题关键是正确地理解“相对原子质量”的含义,理解“相对原子质量”关键是正确理解“相对”的内涵和C-12质量的1/12。


化学方程式中的化学符号代表什么化学方程式中的化学符号代表化学元素或化学物质的简化表示。
化学符号由拉丁字母、数字、上下标和其他特殊的符号组成,用来表示元素的名称、原子量、原子数或化合物的化学式等信息。
下面将详细解释化学方程式中常见的化学符号代表的含义。
1. 元素符号:元素符号由一个或两个拉丁字母构成,并用来表示化学元素的名称。
例如,H代表氢,O代表氧,C代表碳,N代表氮等。
化学方程式中使用元素符号来说明参与反应的元素。
2. 原子量:原子量是指元素的一个相对质量单位,通常以u(原子质量单位)表示。
化学方程式中,元素符号的右下角数字表示该元素的相对原子质量。
例如,H2O中的2表示一个氧原子的相对原子质量为2u。
3. 原子数:原子数指的是参与反应或存在于化学物质中的元素的数量。
化学方程式中,元素符号前面的数字表示元素的原子数。
例如,2H2O表示有2个氧原子和4个氢原子。
4. 化学式:化学式表示化合物中元素的种类和相对原子比例。
化学式可以是分子式、离子式或化学实体式。
分子式用元素符号和下标表示分子中各元素的原子数,例如H2O表示水分子,NaCl表示氯化钠。
除了以上常见的化学符号代表的含义,还有一些特殊的化学符号,如:1. 气体状态符号:化学方程式中,气体状态用(g)表示,例如H2(g)表示氢气。
2. 溶液状态符号:溶液状态用(aq)表示,表示物质溶解在水中形成的溶液。
例如,NaCl(aq)表示氯化钠溶液。
3. 沉淀状态符号:沉淀是指在溶液中析出的固体颗粒。
化学方程式中,沉淀通常用(s)表示。
例如,AgCl(s)表示氯化银沉淀。
4. 离子符号:化学方程式中,离子通常用带电荷的符号表示。
阳离子写在前面,阴离子写在后面,之间用一个“+”或“-”表示两者之间的电荷差异。
例如,Na+表示钠离子,Cl-表示氯离子。
总之,化学方程式中的化学符号能够简洁明了地表示元素、原子量、原子数、化合物等化学信息,有助于理解和描述化学反应和化学物质的性质。

浙教版八年级下科学同步学习精讲精练第2章 微粒的模型与符号2.7-1 元素符号表示的量——相对原子质量 目录.................................................................................................................................................. 1 .................................................................................................................................................. 2 .................................................................................................................................................. 3 .................................................................................................................................................. 5 .. (9)相对原子质量 1.相对原子质量(1)定义:以碳-12原子(含有6个质子和6个中子,也可表示为126C )质量的112(1.661×10-27kg)作为标准,其他原子的质量跟它相比后所得的比值,就是这种原子的相对原子质量,用符号A r 表示。
(2)计算式:某原子的相对原子质量=()1()12kg kg ⨯该原子的实际质量标准碳原子的质量如C 、H 、O 一个原子的质量 一个碳原子的质量:1.993×10-26千克 一个氢原子的质量:1.674×10-27千克 一个氧原子的质量:2.657×10-26千克碳的相对原子质量= 千克千克27-26-10661.110993.1⨯⨯=12 氧的相对原子质量= 千克千克27--2610661.110657.2⨯⨯=16氢的相对原子质量= 千克千克27-27-10661.110674.1⨯⨯=12.原子的质量与相对原子质量的区别与联系A 、B 两原子的相对原子质量之比等于A 、B 两原子的质量之比。


元素符号角标1. 什么是元素符号角标元素符号角标是化学元素符号的角标,用于表示元素的原子量或者电荷。
在化学式和方程中,元素符号的下标上会有一个数字或符号,用于标记原子量或者电荷的大小。
2. 元素符号角标的用途2.1 表示原子量元素符号角标中的数字常用于表示原子量。
原子量是一个元素中原子质量的总和,它决定了元素的化学性质。
例如,氧的原子量是16,写作O₂即表示氧气中含有两个原子,每个原子的质量为16。
2.2 表示电荷元素符号角标中的正负符号常用于表示离子的电荷。
离子是带有正或负电荷的原子或原子团。
正电荷用“⁺”表示,负电荷用“⁻”表示。
例如,氯的电荷为负一,写作Cl⁻。
3. 描述元素符号角标的方法3.1 数字角标在元素符号后面直接跟随一个数字,表示元素符号角标的数值。
这个数字表示元素的原子量或者电荷的绝对值。
例如,H₂O表示水分子,其中的数字角标2表示氢原子的原子量为2。
3.2 正负符号角标在元素符号后面跟随一个正负符号,表示元素符号角标的正负。
正符号“⁺”表示正电荷,负符号“⁻”表示负电荷。
例如,Ca²⁺表示钙离子,其电荷为正二。
3.3 混合角标元素符号角标可以由数字和正负符号组合而成,表示同时存在原子量和电荷的情况。
例如,NH₄⁺表示铵离子,其中的数字角标4表示氢原子的原子量为1,正符号角标表示氮原子失去了一个电子。
4. 元素符号角标的重要性4.1 确定化学式元素符号角标的使用可以准确地表示化学式中各种元素的数量和电荷,从而确保化学式的准确性。
化学式描述了化学反应中各种元素之间的比例关系,对于研究元素和化合物的性质非常重要。
4.2 推导化学反应元素符号角标的使用可以帮助化学家推导出化学反应的过程和结果。
通过观察化学式中元素符号角标的变化,可以揭示反应中原子数目的改变,从而推导出化学反应的机理和平衡。
4.3 进行化学计算元素符号角标的数值可以用于进行化学计算。
通过知道反应物和产物的化学式,以及元素符号角标的数值,可以计算反应物的质量、摩尔数、体积等重要参数,为实验操作和理论研究提供支持。

元素符号表示的量(1)1.相对原子质量。
(1)标准:一个 的质量的121(标准=1.661×10-27kg )。
(2)其他原子的质量与碳-12质量的121相比所得的 ,叫做这种原子的相对原子质量。
(3)相对原子质量是一个比值,单位符号为“1”,无须表明。
(4)原子核内 + =相对原子质量。
2.与原子相似,分子的质量很小,分子质量通常也用相对质量来表示。
(1)定义:一个分子中各原子的相对原子质量总和就是该分子的相对分子质量。
(2)求物质的相对分子质量的一般步骤:①写出正确的化学式②利用相对原子质量表,查出各元素的相对原子质量③根据分子中备元素的相对原子质量总和求出相对分子质量。
(3)求相对分子质量,例:Ca(OH)2的相对分子质量=40+(16+1)×2=74;H 2SO 4的相对分子质量=1×2+32+16×4=98。
3.化学式意义。
(以CO 2为例填空)(1)表示某种物质。
例:二氧化碳。
(2)表示组成物质的元素种类。
例: 。
(3)表示物质的一个分子。
例: 。
(4)表示物质分子的结构。
例: 。
(5)表示它的相对分子质量。
例: 。
题型一相对原子质量计算1.已知碳(C-12)原子的质量为m kg ,另一种原子的质量为n kg ,则该原子相对原子质量为( )A .m nB .m n 12C .12nD .nm 12 2.铁的相对原子质量为56,它表示( )A .铁单质的质量为5 6gB .一个铁原子的质量为56gC .铁的原子核内有56个质子D .一个铁原子的质量是一个碳-12原子质量121的56倍 题型二相对分子质量计算1.明矾的化学式为KAl(SO 4)2·12H 2O ,它的相对分子质量为( )A .39×27×(32+16×4)×2+12×18B .39+27+(32+16×4)×2+12×2×1+18C .39+27+(32+16×4)×2×12×(1×2+16)D .39+27+(32+16×4)×2+12×(1×2+16)2.下列相对分子质量计算正确的是( )A .NO 2的相对分子质量=14×16×2=448B .2NH 3的相对分子质量=2×14+1×3=31C .O 2的相对分子质量=16×2=32gD .Ca(OH)2的相对分子质量=40+(16+1)×2=74一、选择题1.水的相对分子质量为( )A .10B .17C .18D .322.已知某原子的核电荷数为15,原子核中的16个中子,则该原子的相对原子质量约为( )A .15B .16C .1D .313.据英国《自然》杂志报道,科学家最近研制成了以锶原子做钟摆的“光格钟”,成为世界上最精确的钟。
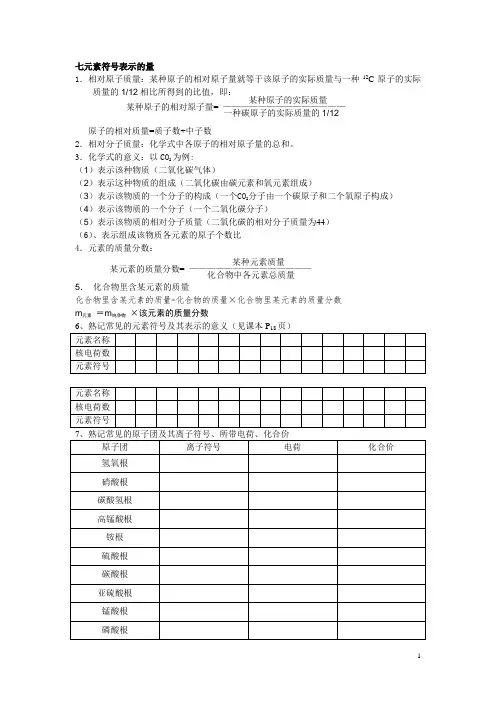
七元素符号表示的量1.相对原子质量:某种原子的相对原子量就等于该原子的实际质量与一种12C 原子的实际质量的1/12相比所得到的比值,即:原子的相对质量=质子数+中子数2.相对分子质量:化学式中各原子的相对原子量的总和。
3.化学式的意义:以CO 2为例:(1)表示该种物质(二氧化碳气体)(2)表示这种物质的组成(二氧化碳由碳元素和氧元素组成)(3)表示该物质的一个分子的构成(一个CO 2分子由一个碳原子和二个氧原子构成) (4)表示该物质的一个分子(一个二氧化碳分子)(5)表示该物质的相对分子质量(二氧化碳的相对分子质量为44) (6)、表示组成该物质各元素的原子个数比 4.元素的质量分数: 5. 化合物里含某元素的质量化合物里含某元素的质量=化合物的质量×化合物里某元素的质量分数 m 元素 =m 纯净物 ×该元素的质量分数6、熟记常见的元素符号及其表示的意义(见课本P 18页) 元素名称 核电荷数 元素符号元素名称 核电荷数 元素符号7、熟记常见的原子团及其离子符号、所带电荷、化合价原子团 离子符号电荷 化合价氢氧根 硝酸根 碳酸氢根 高锰酸根 铵根 硫酸根 碳酸根 亚硫酸根 锰酸根 磷酸根某元素的质量分数= ——————————————某种元素质量化合物中各元素总质量某种原子的相对原子量= ——————————————某种原子的实际质量一种碳原子的实际质量的1/128、常见单质(注意金属单质、稀有气体、部分固态非金属直接用元素符号表示化学式的书写。
)氢气氮气氯气氧气碘溴碳硅硫磷氦气氖气氩气锌镁铜钠铝铁钾钙汞银臭氧12、氧化物二氧化硫三氧化硫一氧化碳四氧化三铁五氧化二磷二氧化碳二氧化硅氧化钙氧化铁氧化亚铁氧化铝氧化铜氧化汞氧化钾氧化钠氧化镁氧化锌二氧化锰过氧化氢氧化钠9、简单化合物氯化钠硫化锌氯化氢氯化钾二氧化氮水氯化银氯化钙氯化镁氯化钡氯化锌氯化铝氯化铜氯化铁氯化亚铁四氯化碳氯化氢硫化钠硫化钠硫化钾硫化银硫化钙硫化镁硫化钡硫化锌硝酸铵硫化铜硫化铁硫化氢硫化亚铁氢氧化钠氢氧化钾氢氧化钙氢氧化镁氢氧化铝氢氧化锌氢氧化铁氢氧化钡氢氧化铜氢氧化亚铁氢氧化铵硫酸。

第二章第七节第1课时教学设计【内容来源】八年级浙教版下册第二章【主题】元素符号表示的量【课时】第1课时一、教学目标1.知识与技能(1)了解相对原子质量的概念及计算方法;(2)会查阅相对原子质量表。
2.过程与方法(1)通过推导结论的过程,提高分析问题、解决问题的能力;(2)通过借助饼图认识新概念的过程,学会用类比法来认识抽象事物与概念。
3.情感态度与价值观(1)体会元素符号与相对原子质量的对应关系,认识到符号中包含着量的意义;(2)通过借助数学工具完成科学公式推导的过程,体验各学科相互之间如何起关联。
二、教学重难点教学重点:相对原子质量的概念及公式教学难点:规律的推导三、教学准备PPT知识点的线索知识拓展,完善认知板书重点知识整理思路,把握重点四、教材分析本节课选自初中科学八年级下册的第二章《微粒的模型与符号》的第七节。
本节课内容难度较小,需花3个课时进行落实。
第一课时的内容主要讲述了相对原子质量的概念、公式、单位,查询方法以及重要结论(相对原子质量=质子数+中子数)。
本节课以前,教材已经编排了元素符号的意义这一知识点,本节课的内容是对元素符号的第四种意义的补充。
而该知识点又是学习相对分子质量与质量比等概念的重要基础。
因而,本节内容具有承上启下的作用。
五、学情分析本节课的授课对象为初级中学的二年级学生,他们的年龄大都在15岁左右,具备一定的数学计算基础。
由于目前处在形式运算阶段初期,他们的逻辑思维能力与抽象思维能力总体较薄弱,需要教师加以耐心的辅导和帮助。
本节课前,学生已经学习了元素符号的三种意义,“相对原子质量”这个新概念作为第四种意义,学生在接触时比较容易接受。
良好的数学基础在本节课重要结论的推导以及公式的引出时也起到了必不可少的作用。
六、教学过程1.复习回顾【教师】同学们,今天接着上新的内容。
上新课之前,我们照例要复习一下之前的知识。
大家拿出纸笔,来写写看这几个根离子的符号(PPT)。
请两位同学来黑板上来写……【学生】写根离子的符号【教师】接着,老师来报几个物质,请一位同学来黑板上听写,其他同学在自己的草稿本上写。

2020浙教版八年级下科学同步提高必刷题训练第2章 微粒的模型与符号2.71 元素符号表示的量——相对原子质量◆要点1相对原子质量1.定义:把一个碳12原子的质量分为12等份,则1份质量为1.993×1026千克×112=1.661×1027千克.其他原子的质量与1.661×1027千克质量相比后得出一定的比值,这个比值就是该原子的相对原子质量. 相对原子质量=-27=11.66110-12⨯⨯一个该原子的质量一个该原子的质量千克一个碳12原子的质量 2.某原子的相对原子质量约等于该原子的质子数与中子数之和.3.相对原子质量的单位为1.◆要点2相对分子质量1.定义:相对分子质量就是化学式中各原子的相对原子质量的总和.2.举例:(1) CO 2的相对分子质量=12+16×2=44;(2) CuSO 4•5H 2O 的相对分子质量=64+32+16×4+5×(1×2+16)=250.Δ基础题系列1.(2019春•杭州期中)下列说法不正确的是( )A .物质可由分子、原子或离子构成B .结构示意图和表示了同种元素的两种粒子C .相对原子质量为m 的原子,核外有n 个电子,则核内中子数为:m ﹣nD .原子序数为16的原子,位于周期表中第2周期第ⅦA 族【答案】D【解析】A 、构成物质的基本微粒是分子、原子和离子,正确;B 、这两种微粒的核内质子数都是12,属于镁元素的镁原子和镁离子,正确;C、相对原子质量=质子数+中子数,质子数=电子数,故中子数=m﹣n,正确;D、原子序数为16的原子,是硫原子,其原子核外有3个电子层,位于第三周期,错误。
2.(2019春•瓯海区期中)已知一个碳﹣12原子的质量为N克,又知一个某原子的质量为M克,则该原子的相对原子质量为()A.B.C.D.【答案】A【解析】已知一个碳12原子的质量的质量为N克,一个某原子的质量为M克,则该原子的相对原子质量是=。
2020年浙教版八年级下科学同步学习精讲精练第2章微粒的模型与符号2.72元素符号表示的量——相对分子质量目录 (1) (2) (3) (8) (12)一、相对分子质量一个分子中各原子的相对原子质量的总和叫作该分子的相对分子质量(它的国际单位制单位为“1”)。
相对分子质量也是以碳12原子质量的112作为标准的一种相对质量(用符号M r表示)。
【说明】相对分子质量越大,分子的质量也越大;②质量相同、由不同分子构成的纯净物,相对分子质量越小的物质所含的分子个数越多。
二、根据化学式计算1.根据化学式计算组成物质的元素质量比如:水的化学式为H2O,求水中氢元素和氧元素的质量比。
H:O=(1×2):(16×1)=1:8练习:(1)计算二氧化碳中各元素的质量比。
(2)计算硫酸(H2SO4) 中各元素的质量比。
(3)计算碳酸氢铵(NH4HCO3) 中各元素的质量比。
2.根据化学式,计算物质中某一元素的质量分数。
如:计算水中氢元素的质量分数。
水中氢元素质量分数=(氢元素的相对原子质量(总)/水的相对分子质量)×100%=2/18×100%≈11.1% 练习:(1)求二氧化碳中碳元素、氧元素的质量分数。
(2)计算碳酸氢铵(NH 4HCO 3)中氮元素的质量分数。
(3)计算硝酸铵(NH 4NO 3)中氮元素的质量分数。
【说明】由上可知,知道了物质中各元素的质量比或物质中某元素的质量比,也知道该物质的量,就能算出一定量的物质中某元素的质量。
【思考】有几种方法可以计算180克水中含有多少氢元素和氧元素?有关化学式的计算的五种基本类型1.计算物质的相对分子质量计算化学式中各原子的相对原子质量之和,要注意将各元素的相对原子质量乘以其原子个数,再进行求和。
结晶水化合物中的结晶水的相对分子质量必须计算在内,如CuSO 4•5H 2O 的相对分子质量为160+5×18=250.2.计算物质中各元素的质量比(以A m B n 为例)()()m A A m m B B n⨯=⨯的相对原子质量的相对原子质量。