2019全南方凤凰台国一轮复习高中化学教师用书课件专题一 第7讲 专题提升
- 格式:ppt
- 大小:1.42 MB
- 文档页数:28


课时6 专题提升(本课时对应学生用书第28~29页)【微专题】微小专题1 氧化还原反应的试题研究【问题引出】在高考中氧化还原反应是非常重要的考试内容。
那么,如何判断氧化产物或还原产物?如何分析反应中电子转移数目?如何正确书写并配平氧化还原反应的化学方程式或离子方程式?【考题呈现】1. (2015·新课标Ⅰ卷)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。
大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为。
【答案】MnSO4【解析】酸性条件下MnO2将I-氧化为I2,MnO2被还原为MnSO4,离子方程式为MnO2+2I-+4H+I2+Mn2++2H2O,故还原产物为MnSO4。
2. (2015·苏州一模)以CO2为原料可以合成多种物质。
一定条件下,利用FeO 吸收CO 2的化学方程式为6FeO+CO 22Fe 3O 4+C ,则反应中每生成1mol Fe 3O 4,转移电子的物质的量为 mol 。
【答案】 2【解析】 由CO 2转变为C 可知,在该反应中生成2 mol Fe 3O 4转移电子数为4 mol ,当生成1 mol Fe 3O 4时,转移电子2 mol 。
3. (2015·南京三模)KI 可用于制造染料、感光材料、食品添加剂等,其工业生产过程如下:“歧化”产物之一是碘酸钾(KIO 3),该反应的离子方程式是 。
【答案】 3I 2+6OH-5I -+I -3O +3H 2O【解析】 碘单质在碱性条件下发生歧化反应生成KIO 3的同时得到KI ,反应的离子方程式为3I 2+6OH-5I -+I -3O +3H 2O 。
4.(2015·浙江模拟)氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为a HClO 3b O 2↑+c Cl 2↑+d HClO 4 +e H 2O ,用湿润的淀粉-碘化钾试纸检验气体产物时,试纸先变蓝后褪色。


课时4 离子反应(本课时对应学生用书第15~21页)【课时导航】【自主学习】考点1 电解质与非电解质、强电解质与弱电解质及离子反应 【基础梳理】1. 电解质与非电解质2. 强电解质与弱电解质423 4 4COOH 33. 离子反应和离子方程式(1) 离子反应:有离子或离子的反应叫离子反应。
离子反应是在溶液中进行的。
(2) 离子方程式①概念:用的离子的符号表示的式子叫离子方程式。
②离子方程式的书写:离子方程式的书写步骤可归纳为四个字:、、、。
③离子方程式的意义:离子方程式能清楚地揭示离子反应的本质,它不仅表示的反应,还表示的离子反应。
微课1 离子方程式常见的错因举例+2Fe+++2Ag+Cu--H+S2+BaSO++2AlBaSOBaSO-Mn-Mn”“OO微课2 有条件的离子方程式如何书写举例1.往Ca(HCO3)2溶液中加入少量NaOH溶液(把不足的物质当做1 mol,过量的物质需要多少就可以提供多少)1 mol NaOH电离出1 mol OH-最多需要 1 mol HCHC+OH-C+H2O 最多需要 1 mol Ca2+Ca2++C CaCO3↓总的离子方程式:OH-+HC+Ca2+CaCO3↓+H2O2. 往Ca(HCO3)2溶液中加入过量NaOH溶液(把不足的物质当做1 mol,过量的物质需要多少就可以提供多少)1 mol Ca(HCO3)2电离出 1 mol Ca2+和2 mol HC最多需要 2 mol OH-2HC+2OH-2H2O +2C1 mol Ca2+与生成的2 mol C反应生成 1 mol CaCO3,剩余1 mol C总的离子方程式:Ca2++2HC+2OH-CaCO3↓+2H2O+C【举题说法】例题1 下列关于电解质电离的叙述正确的是( )A. 碳酸钙在水中的溶解度很小,其溶液的导电性很弱,所以碳酸钙是弱电解质B. 氢氧化钙微溶于水,但溶解的氢氧化钙全部电离,所以氢氧化钙是强电解质C. 氯气和氨气的水溶液导电性都很好,所以它们是强电解质D. 水难电离,纯水几乎不导电,所以水是非电解质【答案】 B【解析】电解质强弱与溶液导电性没有必然关系,强弱电解质的根本区别在于能否完全电离,碳酸钙溶于水的部分完全电离,所以碳酸钙为强电解质,A错;B正确;氯气为单质,既不是电解质也不是非电解质,氨气的水溶液导电,导电的离子是一水合氨电离的,不是氨气本身电离的,所以氨气为非电解质,C错;水为极弱的电解质,水能够电离出氢离子和氢氧根离子,D错。

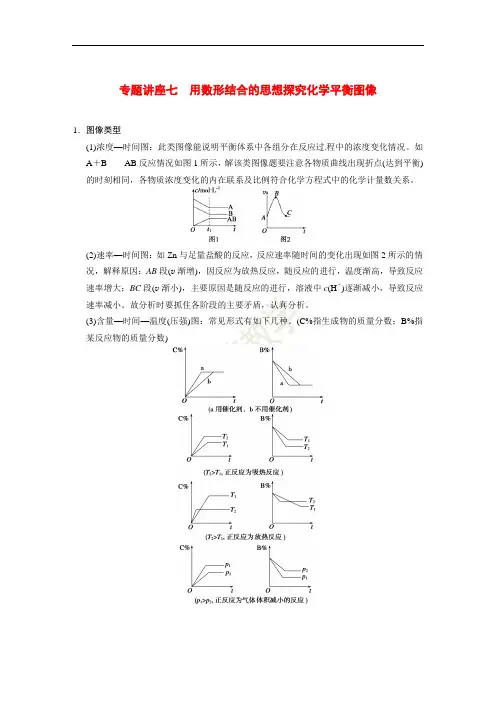
专题讲座七用数形结合的思想探究化学平衡图像1.图像类型(1)浓度—时间图:此类图像能说明平衡体系中各组分在反应过程中的浓度变化情况。
如A+B AB反应情况如图1所示,解该类图像题要注意各物质曲线出现折点(达到平衡)的时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的化学计量数关系。
(2)速率—时间图:如Zn与足量盐酸的反应,反应速率随时间的变化出现如图2所示的情况,解释原因:AB段(v渐增),因反应为放热反应,随反应的进行,温度渐高,导致反应速率增大;BC段(v渐小),主要原因是随反应的进行,溶液中c(H+)逐渐减小,导致反应速率减小。
故分析时要抓住各阶段的主要矛盾,认真分析。
(3)含量—时间—温度(压强)图:常见形式有如下几种。
(C%指生成物的质量分数;B%指某反应物的质量分数)(4)恒压(温)线(如图3所示):该类图的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(p),常见类型如下所示:(5)其他:如图4所示曲线是其他条件不变时,某反应物的最大转化率(α)与温度(T)的关系曲线,图中标出的1、2、3、4四个点,表示v正>v逆的点是3,表示v正<v逆的点是1,而2、4点表示v正=v逆。
2.解题步骤3.解题技巧(1)先拐先平在含量(转化率)—时间曲线中,先出现拐点的先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大等。
(2)定一议二当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。
(3)三步分析法一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。
题组一浓度—时间图像1.已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)(正反应为放热反应)。
现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:(1)图中共有两条曲线X和Y,其中曲线______表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。


专题一化学基础知识注意事项:1. 本试卷分第I卷(选择题)和第n卷(非选择题)两部分。
满分120分,考试时间100分钟。
2. 答题前,请考生务必将自己的学校、班级、姓名填写在密封线内。
第I卷(选择题共40分)单项选择题(本题包括10小题,每小题2分,共20分。
每小题只有一个选项符合题意)1. (2015 •无锡一模)2014年11月APE会议期间,北京市区天空湛蓝,PM2.5浓度为每立方米37微克,接近一级优水平。
网友形容此时天空的蓝色为“APE蓝”。
下列有关说法不正确的是()A. 开发新能源,如太阳能、风能等,减少对化石能源的依赖B. 直径接近于2.5 X 10 -6 m的颗粒物(PM2.5)分散在空气中形成的混合物具有丁达尔效应C. 燃煤进行脱硫脱硝处理,减少硫的氧化物和氮的氧化物的排放D. 通过吸收空气中CO并利用廉价能源合成汽油可推广“绿色自由”计划2. (2015 •南通二模)下列有关化学用语表示正确的是()Ca z+c:6 : OA. 过氧化钙(CaQ)的电子式:B. ''的结构示意图:2-C. H 2CO的电离方程式:HCO- 2H++C°3D. 葡萄糖的结构简式:C6H12O6A.醋酸、乙醇、氯化钠B. 硝酸、烧碱、纯碱3 (2015 •宿迁期中)下列各组物质按酸、碱、盐依次排列的是()7. (2015 •淮安期末)下列反应的离子方程式书写正确的是 ( )A. 氯化铜溶液与铁粉反应: Cu 2++Fe ——Fe 2++CuB. 稀硝酸与铁粉反应:2Fe+6H +2Fe 3++3H4C. 氢氧化钡溶液与稀硫酸反应: Ba 2++OH+H ++S °4一 BaSO J +H.OO 2- D. 碳酸钙与醋酸反应: C O 3 +2KHO+COf8. (2015 •苏锡常镇二模)设2为阿伏加德罗常数的值。
下列说法正确的是 ( )A. 标准状况下,2.24 L 苯中含C- H 键数目为0.6N AC.碳酸氢钠、氢氧化铜、硫酸钾D. 盐酸、熟石灰、苛性钠4. (2015 •无锡期中)下列关于胶体的叙述不正确的是 ( )A. 胶体区别于其他分散系的本质特征是分散质的微粒直径在 10-9~10-7 m 之间B. 光线透过胶体时,胶体中可发生丁达尔效应C. 用聚光手电筒照射NaCI 溶液和Fe (OH )3胶体时,产生的现象相同D. Fe (OH ) 3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水的目的5. (2015 •盐城期中)相同物质的量的 N 2和CO 两者相比较,下列说法不正确的是A. 所占的体积一定相等B. 所含原子总数相等C.所含电子总数相等D.所含分子数相等6. (2015 •南通期中)在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是 A. Na +、X 、O 耳 CIB. Cu 2、Cl2- - S O 4、N 。


