20182019年高中化学总复习一轮复习钠及化合物文件27张
- 格式:ppt
- 大小:2.08 MB
- 文档页数:27




第一节钠及其化合物考纲定位全国卷5年考情1. 了解钠的主要性质及其应用。
2. 掌握钠的重要化合物(M2O2、NaOH. Na 2CO3> NaHCO 3等)的主要性质及其应用。
3. 了解钠及其重要化合物的制备方法。
4. 了解Na+、K+的检验方法。
2017 年:II 卷 T10{B)、T13(B) 2016 年:ii 卷 %、T I 3(D ); me T 7(A > 2015 年:I 卷 T B (C); I [卷 T1O(B,C)> Ina) 2014 年:I 卷 T SCA ); II 卷 T7⑻、T9⑻、T IO (B ) 2013 年:II 卷 T IO (B , 0考点11钠及其氧化物(对应学生用书第34页) [考纲知识整合]1 •钠的主要性质及应用⑴物理性质:P=0. 97 g/cm 3,比水的密度尘、比煤油的密度太,质软,熔点为97.81 °C, 沸点为882.9 °C 。
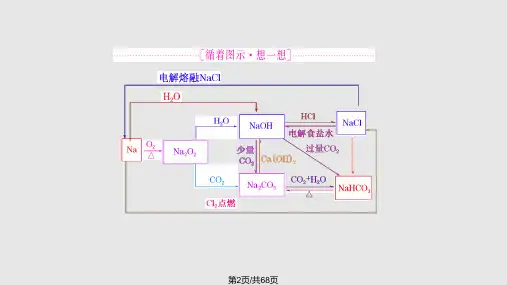
(2) 化学性质(写出化学方程式)点燃、CL : 2Na+C122NaC 1② 与 FW 反应:2Na + 2H 2O=2NaOH+H2 t o 实验探究:W 与比0(含酚駄)反应的现象及解释密度比水小 熔点低,反应放热生成气体,使钠受力不均衡 反应剧烈,产生气体 生成了碱(NaOH)③ 与乙醇反应:2%+2C2lWH —2GHCNa+H2 f 。
④ 与酸(HC1)反应:2Na+2HCl=2NaCl+H 2 t o⑤ 与盐(CuSOi)溶液反应:2Na+2H 2O=2NaOH+H 2 t , CuSO ,i+2NaOH=Cu (0H)2 I +Na 2S0.lo(3) 钠的保存与用途① 保存:少量钠保存在煤迪或石蜡油中。
② 用途:制Na 2O 2, Na-K 合金可用于原子反应堆的导热剂,制高压钠灯,冶炼某些金属如①与非金属反应s[常温:〔点4Na+O 2=2Na.O2Na +02=Na 202熔融4Na+TiCl4^=4NaCl +Ti (g)。