2019版高中化学一轮复习方案文档选修3物质结构与性质 3 第三讲 课后达标训练 Word版含解析
- 格式:doc
- 大小:333.00 KB
- 文档页数:7

高中化学选修三《物质结构及性质》复习提纲及高考分析归纳整理:索会锋2016.元月前言:《物质结构与性质》这门课虽然是选修课程,但是在高考中作为选考题之一,占得分值和《有机化学基础》《化学工艺》一样多,但内容比另两门选修课程要少,题型单一易解,所以复习方便,得分容易,是高考复习中对于基础较差的学生复习的捷径之选,所以经郭校长和高三化学组研究决定,特归纳整理了有关该课程的知识点及高考题型分析,便于同学们寒假回家自我复习,请同学们给予重视。
高三化学组索会锋一 . 原子结构与性质 .一 . 认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图. 离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小 .电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层 . 原子由里向外对应的电子层符号分别为K、 L、 M、N、 O、 P、 Q.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、 d、 f 表示不同形状的轨道,s 轨道呈球形、p 轨道呈纺锤形, d 轨道和 f 轨道较复杂 . 各轨道的伸展方向个数依次为1、 3、 5、 7.2.(构造原理)了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~ 36 号元素原子核外电子的排布.(1).原子核外电子的运动特征可以用电子层、原子轨道( 亚层 ) 和自旋方向来进行描述. 在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.(2).原子核外电子排布原理.①. 能量最低原理: 电子先占据能量低的轨道,再依次进入能量高的轨道.②. 泡利不相容原理: 每个轨道最多容纳两个自旋状态不同的电子.③. 洪特规则 : 在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.洪特规则的特例 :在等价轨道的全充满(p6、d10、f 14)、半充满( p3、d5、f 7)、全空时 (p0、d0、f 0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d 54s1、29Cu [Ar]3d 104s1.(3).掌握能级交错图和1-36 号元素的核外电子排布式.①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。


(word完整版)⾼中化学选修3物质结构与性质习题附答案《物质结构与性质》同步复习第1讲原⼦结构1题⾯(1)34.969是表⽰__________;(2)35.453是表⽰__________;(3)35是表⽰_______________;(4)35.485是表⽰__________;(5)24.23%是表⽰__________;答案:(1)34.969是表⽰同位素35Cl 的相对原⼦质量;(2)35.453是表⽰氯元素的相对原⼦质量;(3)35是表⽰35Cl 原⼦的质量数;(4)35.485是表⽰氯元素的近似相对原⼦质量;(5)24.23%是表⽰同位素37Cl 在⾃然界存在的氯元素中所占的原⼦个数百分⽐。
5题⾯已知A 、B 、C 、D 和E 5种分⼦所含原⼦数⽬依次为1、2、3、4和6,且都含有18个电⼦。
⼜知B 、C 和D 是由两种元素的原⼦组成。
请回答:(1)组成A 分⼦的原⼦的核外电⼦排布式是;(2)B 和C 的分⼦式分别是和;C 分⼦的⽴体结构呈型,该分⼦属于分⼦(填“极性”或“⾮极性”);(3)若向D 的稀溶液中加⼊少量⼆氧化锰,有⽆⾊⽓体⽣成。
则D 的分⼦式是,该反应的化学⽅程式为;(4)若将1mol E 在氧⽓中完全燃烧,只⽣成1mol CO 2和2molH 2O ,则E 的分⼦式是。
答案:(1)1s 22s 22p 63s 23p 6 (2)HCl H 2S V 极性(3)H 2O 2 2H 2O22H 2O+O 2↑(4)CH 4O1题⾯答案:①1s 22s 22p 63s 23p 5 ②3s 23p 5 ③3 ④ⅦA ⑤10 ⑥2s 22p 6 ⑦2 ⑧0 ⑨24 ⑩1s 22s 22p 63s 23p 63d 54s 1 ⑾4 2题⾯(1)砷原⼦的最外层电⼦排布式是4s 24p 3,在元素周期表中,砷元素位于_______周期族;最⾼价氧化物的化学式为,砷酸钠的化学式是。

高三化学一轮物质结构与性质学案原子结构与性质.一.认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小.电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.例1.下列关于氢原子电子云图的说法正确的是A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大B.黑点密度大,单位体积内电子出现的机会大C.通常用小黑点来表示电子绕核作高速圆周运动D.电子云图是对运动无规律性的描述例2.下列有关认识正确的是A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7B.各能层的能级都是从s能级开始至f能级结束C.各能层含有的能级数为n -1D.各能层含有的电子数为2n22.(构造原理)了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布.(1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.(2).原子核外电子排布原理.①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1.(3).掌握能级交错图和1-36号元素的核外电子排布式.①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。
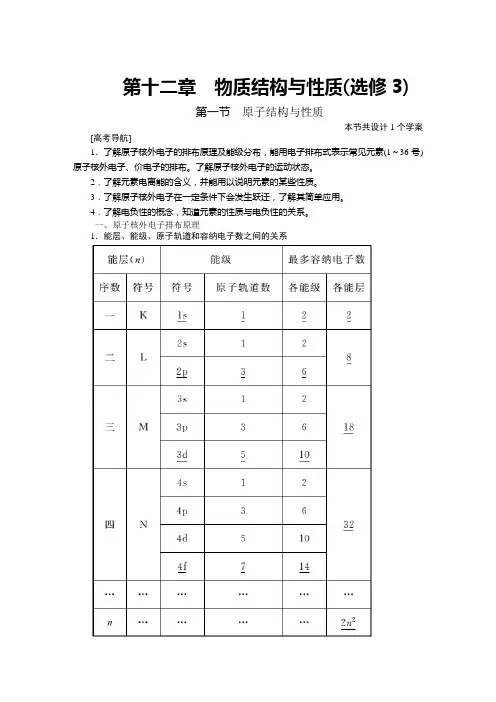
第十二章物质结构与性质(选修3)第一节原子结构与性质本节共设计1个学案[高考导航]1.了解原子核外电子的排布原理及能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子、价电子的排布。
了解原子核外电子的运动状态。
2.了解元素电离能的含义,并能用以说明元素的某些性质。
3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
4.了解电负性的概念,知道元素的性质与电负性的关系。
一、原子核外电子排布原理1.能层、能级、原子轨道和容纳电子数之间的关系2.原子轨道的形状和能量高低(1)轨道形状①s电子的原子轨道呈球形。
②p电子的原子轨道呈哑铃形。
(2)能量高低①相同能层上原子轨道能量的高低:n s<n p<n d<n f。
②形状相同的原子轨道能量的高低:1s<2s<3s<4s<…。
③同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如n p x、n p y、n p z轨道的能量相等。
3.原子核外电子的排布规律(1)三个原理①能量最低原理:原子的核外电子排布遵循构造原理,使整个原子的能量处于最低状态。
构造原理示意图:②泡利原理:在一个原子轨道里最多只能容纳2个电子,而且自旋方向相反。
③洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋方向相同。
洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低。
如24Cr的基态原子电子排布式为1s22s22p63s23p63d54s1,而不是1s22s22p63s23p63d44s2。
[思考]Mn的电子排布式能否书写为1s22s22p63s23p64s23d5?并说明理由。
提示:不能。
当出现d能级时,虽然电子按n s、(n-1)d、n p的顺序填充,但在书写电子排布式时,仍把(n-1)d放在n s前,如Mn:1s22s22p63s23p63d54s2正确,Mn:1s22s22p63s23p64s23d5错误。


模块综合检测(选修3)(时间:90分钟,满分:105分)1.(15分)(2018•山西走点中学协作体期末)现有前四周期T、X、Y、Z、W、M六种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的S电子总数等于p电子总数的2倍。
M原子的M能层上有4个未成对电子。
请完成下列问题:(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序:____________ (用元素符号表示)。
(2)基态M原子的核外电子排布式为____________________________________________ o(3)根据VSEPR理论,推断出由W与X两元素组成的最简单二价阴离子的立体构型为___________ , W原子的杂化类型为_____________ 0(4)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低的顺序为____________ (用化学式表示)。
解析:根据题中信息“W原子的s电子总数等于p电子总数的2倍”可知,W的电子排布式是ls22s22p2,则W是碳元素;又知“W、Z、X、T、Y五种非金属元素原子半径依次减小”,根据元素周期律可推知Z是氮元素,X是氧元素,T是氟元素,Y是氢元素;“M 原子的M能层上有4个未成对电子”,则M的电子排布式是ls22s22p63s23p63d64s2,即M 是铁元素。
(1)C、N、0、F四种元素位于同一周期,随原子序数增大,第一电离能呈增大趋势,但N元素反常,因此第一电离能大小顺序是F>N>O>C o(3)C和O两种元素组成的最简单的二价阴离子是CO芥,该离子的中心原子的价层电子对数是3,孤电子对数是0,因此其立体构型是平面三角形,C原子的杂化类型为s『杂化。
(4)H与F、0、N、C所形成的最简单化合物分别是HF、H2O> NH3、CH4,其中HF、出0、NH3分子之间都存在氢键,它们的沸点都比没有氢键的CH。

第3节晶体结构与性质考纲点击1.理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
2.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
3.理解金属键的含义,能用金属键理论解释金属的一些物理性质。
4.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
一、晶体常识1.晶体与非晶体晶体非晶体结构特征结构微粒在三维空间里呈周期性____序排列结构微粒____序排列性质特征自范性熔点异同表现各向异性无各向异性区别方法熔点法有固定熔点无固定熔点X射线对固体进行X射线衍射实验2.晶胞(1)概念:描述晶体结构的______________。
(2)晶体中晶胞的排列——无隙并置。
1无隙:相邻晶胞之间没有____________;2并置:所有晶胞________排列、________相同。
即时训练1下列有关晶体的说法中正确的是__________。
1凡是有规则外形的固体一定是晶体2晶体与非晶体的本质区别:是否有自范性3熔融态物质凝固就得到晶体4晶体有一定的熔沸点5区分晶体和非晶体最可靠的科学方法:是否具有固定的熔沸点⑥晶胞为的示意图:为阳离子,为阴离子。
以M代表阳离子,N代表阴离子。
化学式为MN2二、分子晶体和原子晶体1.分子晶体(1)结构特点1晶体中只含分子。
2分子间作用力为范德华力,也可能有氢键。
3分子密堆积:一个分子周围通常有12个紧邻的分子。
(2)典型的分子晶体1冰:水分子之间的主要作用力是__________,也存在______________,每个水分子周围只有______个紧邻的水分子。
2干冰:CO2分子之间存在____________,每个CO2分子周围有____个紧邻的CO2分子。
2.原子晶体(1)结构特点1晶体中只含原子。
2原子间以____________结合。
3____________________结构。
(2)典型的原子晶体——金刚石1碳原子取________杂化轨道形成共价键,碳碳键之间夹角为________。

[课后达标训练]一、选择题1.(2018·张掖二中月考)下列说法正确的是( )A .π键是由两个p 轨道“头碰头”重叠形成的B .σ键是镜像对称的,而π键是轴对称的C .乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键D .H 2分子中含σ键,而Cl 2分子中含π键解析:选C 。
π键是由两个p 轨道“肩并肩”重叠形成的,A 项错误;σ键是轴对称的,而π键是镜像对称的,B 项错误;乙烷分子中全部是单键,所以都是σ键,乙烯分子中含有一个碳碳双键,双键中含一个σ键和一个π键,C 项正确;H 2和Cl 2分子中都只含有单键,所以都是σ键,D 项错误。
2.(2018·吉林模拟)在硼酸[B(OH)3]分子中,B 原子与3个羟基相连,其晶体具有与石墨相似的层状结构。
则分子中B 原子杂化轨道的类型及同层分子间的主要作用力分别是( )A .sp ,范德华力B .sp 2,范德华力C .sp 2,氢键D .sp 3,氢键解析:选C 。
由石墨的晶体结构知C 原子为sp 2杂化,故B 原子也为sp 2杂化,但由于B(OH)3中B 原子与3个羟基相连,羟基间能形成氢键,故同层分子间的主要作用力为氢键。
3.(2018·商丘模拟)N 2的结构可以表示为,CO 的结构可以表示为,其中椭圆框表示π键,下列说法中不正确的是( )A .N 2分子与CO 分子中都含有三键B .CO 分子中有一个π键是配位键C .N 2与CO 互为等电子体D .N 2与CO 的化学性质相同解析:选D 。
N 2化学性质相对稳定,CO 具有比较强的还原性,两者化学性质不同。
4.(2018·武汉模拟)用价层电子对互斥理论(VSEPR)预测H 2S 和COCl 2的立体构型,两个结论都正确的是( )A .直线形;三角锥形B .V 形;三角锥形C .直线形;平面三角形D .V 形;平面三角形解析:选D 。
H 2S 分子中的中心S 原子上的孤电子对数是12×(6-1×2)=2,则说明H 2S 分子中中心原子有4对价电子对,其中2对是孤电子对,因此立体构型是V 形;而COCl 2中中心C 原子的孤电子对数是12×(4-2×1-1×2)=0,因此COCl 2中中心原子的价电子对数是3,是平面三角形,故选D 。

⾼三化学⼀轮复习--选修3(物质结构与性质)全套教学案⼈教版第四讲⼀.原⼦结构与性质.⼀.认识原⼦核外电⼦运动状态,了解电⼦云、电⼦层(能层)、原⼦轨道(能级)的含义.1.电⼦云:⽤⼩⿊点的疏密来描述电⼦在原⼦核外空间出现的机会⼤⼩所得的图形叫电⼦云图.离核越近,电⼦出现的机会⼤,电⼦云密度越⼤;离核越远,电⼦出现的机会⼩,电⼦云密度越⼩.电⼦层(能层):根据电⼦的能量差异和主要运动区域的不同,核外电⼦分别处于不同的电⼦层.原⼦由⾥向外对应的电⼦层符号分别为K、L、M、N、O、P、Q.原⼦轨道(能级即亚层):处于同⼀电⼦层的原⼦核外电⼦,也可以在不同类型的原⼦轨道上运动,分别⽤s、p、d、f表⽰不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展⽅向个数依次为1、3、5、7.例1.下列关于氢原⼦电⼦云图的说法正确的是A.通常⽤⼩⿊点来表⽰电⼦的多少,⿊点密度⼤,电⼦数⽬⼤B.⿊点密度⼤,单位体积内电⼦出现的机会⼤C.通常⽤⼩⿊点来表⽰电⼦绕核作⾼速圆周运动D.电⼦云图是对运动⽆规律性的描述例2.下列有关认识正确的是A.各能级的原⼦轨道数按s、p、d、f的顺序分别为1、3、5、7B.各能层的能级都是从s能级开始⾄f能级结束C.各能层含有的能级数为n -1D.各能层含有的电⼦数为2n22.(构造原理)了解多电⼦原⼦中核外电⼦分层排布遵循的原理,能⽤电⼦排布式表⽰1~36号元素原⼦核外电⼦的排布.(1).原⼦核外电⼦的运动特征可以⽤电⼦层、原⼦轨道(亚层)和⾃旋⽅向来进⾏描述.在含有多个核外电⼦的原⼦中,不存在运动状态完全相同的两个电⼦.(2).原⼦核外电⼦排布原理.①.能量最低原理:电⼦先占据能量低的轨道,再依次进⼊能量⾼的轨道.②.泡利不相容原理:每个轨道最多容纳两个⾃旋状态不同的电⼦.③.洪特规则:在能量相同的轨道上排布时,电⼦尽可能分占不同的轨道,且⾃旋状态相同.洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较⼤的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1.(3).掌握能级交错图和1-36号元素的核外电⼦排布式.①根据构造原理,基态原⼦核外电⼦的排布遵循图?箭头所⽰的顺序。

人教版高三化学选修三全年授课方案:物质结构与性质若是要想做出高效、实效,务必先从自己的工作方案开始。
有了方案,才不致于使自己思想诱惑。
下文为您准备了高三化学选修三全年授课方案。
【考纲显现】(1) 能用电子排布式表示常有元素 (1 ~36 号) 原子核外电子的排布。
(2) 认识元素第一电离能、电负性等性质的周期性变化规律。
(3) 认识 NaCl 型和 CSCl 型离子晶体的结构特点,能用晶格能讲解典型离子化合物的物理性质。
(4) 认识“等电子体原理〞的含义,能结合实例说明“等电子体原理〞的应用。
(5) 能依照杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间构型。
(6) 认识氢键的存在对物质性质的影响。
【考题回忆】1.(2021 年江苏卷 ) A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数 A(1)A 、B、C的第一电离能由小到大的序次为。
(2)B 的氢化物的分子空间构型是。
其中心原子采用杂化。
第 1 页(3) 写出化合物 AC2的电子式 ; 一种由 B、C组成的化合物与AC2互为等电子体,其化学式为。
(4)E 的核外电子排布式是,ECl3 形成的配合物的化学式为。
(5)B 的最高价氧化物对应的水化物的稀溶液与 D的单质反响时,B被复原到最低价,该反响的化学方程式是。
2.(2021 年江苏卷 ) 生物质能是一种洁净、可再生的能源。
生物质气 ( 主要成分为 C O、CO2、H2等) 与 H2混杂,催化合成甲醇是生物质能利用的方法之一。
(1) 上述反响的催化剂含有 Cu、Zn、Al 等元素。
写出基态 Zn 原子的核外电子排布式。
(2) 依照等电子原理,写出 CO分子结构式。
(3) 甲醇催化氧化可获取甲醛,甲醛与新制 Cu(OH)2 的碱性溶液反响生成 Cu2O积淀。
①甲醇的沸点比甲醛的高,其主要原因是 ; 甲醛分子中碳原子轨道的杂化种类为。
②甲醛分子的空间构型是 ;1mol 甲醛分子中σ键的数目为。
高中化学选修3物质结构与性质全册知识点总结(word版可编辑修改) 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学选修3物质结构与性质全册知识点总结(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学选修3物质结构与性质全册知识点总结(word版可编辑修改)的全部内容。
高中化学选修3知识点总结主要知识要点:1、原子结构2、元素周期表和元素周期律3、共价键4、分子的空间构型5、分子的性质6、晶体的结构和性质(一)原子结构1、能层和能级(1)能层和能级的划分①在同一个原子中,离核越近能层能量越低.②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。
③任一能层,能级数等于能层序数。
④s、p、d、f,,可容纳的电子数依次是1、3、5、7,,的两倍.⑤能层不同能级相同,所容纳的最多电子数相同。
(2)能层、能级、原子轨道之间的关系每能层所容纳的最多电子数是: 2n2(n:能层的序数)。
2、构造原理(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。
(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。
(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等.原子轨道的能量关系是:ns<(n-2)f < (n-1)d <np (4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目.根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8 个电子;次外层不超过18 个电子;倒数第三层不超过32 个电子。
高中化学选修3《物质结构与性质》全部教案第一章原子结构与性质教材分析:一、本章教学目标1 •了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1〜36号)原子核外电子的排布。
2 •了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件下会发生跃迁产生原子光谱。
3 •了解原子核外电子的运动状态,知道电子云和原子轨道。
4 •认识原子结构与元素周期系的关系,了解元素周期系的应用价值。
5 •能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某些性质。
6 •从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。
本章知识分析:本章是在学生已有原子结构知识的基础上,进一步深入地研究原子的结构,从构造原理和能量最低原理介绍了原子的核外电子排布以及原子光谱等,并图文并茂地描述了电子云和原子轨道;在原子结构知识的基础上,介绍了元素周期系、元素周期表及元素周期律。
总之,本章按照课程标准要求比较系统而深入地介绍了原子结构与元素的性质,为后续章节内容的学习奠定基础。
尽管本章内容比较抽象,是学习难点,但作为本书的第一章,教科书从内容和形式上都比较注意激发和保持学生的学习兴趣,重视培养学生的科学素养,有利于增强学生学习化学的兴趣。
通过本章的学习,学生能够比较系统地掌握原子结构的知识,在原子水平上认识物质构成的规律,并能运用原子结构知识解释一些化学现象。
注意本章不能挖得很深,属于略微展开。
相关知识回顾(必修2)1. _____________________________________________________________________________原子序数:含义:______________________________________________________________________________ (1)原子序数与构成原子的粒子间的关系:原子序数= ___________________ = ___________ = ________________ = __________________ 。
[课后达标训练]一、选择题1.下列晶体分类中正确的一组是()解析:选Co A项中晶体氮为分子晶体;B项中H2SO4为分子晶体,石墨为混合型晶体;D项中玻璃为非晶体。
2.(2018-衡水中学髙三调研)据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为CeSieo,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含5), 也有Si60结构。
下列叙述正确的是()A.该物质有很高的熔点、很大的硬度B.该物质形成的晶体属于分子品体C.该物质分子中Si6o被包裹在C6()里面D.该物质的相对分子质量为1200解析:选B。
由分子式及信息可知该物质为分子晶体,A错误,B正确;Si的原子半径大于C,所以Sig的体积大于C6()的体积,C错误;相对分子质量为(12+28)X60=2 400, D错误。
3.(2015-高考上海卷)下列有关物质性质的比较,错误的是()A.溶解度:小苏打v苏打B.密度:漠乙烷>水C.硬度:晶体硅v金刚石D.碳碳键键长:乙烯〉苯解析:选D。
A.小苏打能溶于水,苏打易溶于水,因此溶解度:小苏打v苏打,正确。
B.;臭乙烷密度>1 g/mL,而水的密度等于1 g/mL,因此密度:渙乙烷〉水,正确。
C.晶体硅、金刚石都是原子晶体,原子之间通过共价键结合,由于原子半径:C<Si,所以共价键的强度:C—C>Si—Si,共价键越强,原子结合得就越牢固,物质的硬度就越大,所以物质的硬度:晶体硅v 金刚石,正确。
D.乙烯分子中碳碳键是碳碳双键,而苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的特殊的化学键,所以键长:乙烯v苯,错误。
4.下列四种有关性质的叙述,可能属于金属晶体的是()A. 由分子间作用力结合而成,熔点低B. 固体或熔融后易导电,熔点在1 000 °C 左右C. 由共价键结合成网状结构,熔点髙D. 固体不导电,但溶于水或熔融后能导电解析:选B 。
高三化学一轮复习学案:《物质结构与性质》全套教学案(新人教版选修3)原子结构与性质.一.认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义1.电子云:用小黑点的疏密来描述电子在原子核外空间显现的机会大小所得的图形叫电子云图. 离核越近,电子显现的机会去,电子云密度越衣;离核越远,电子显现的机会尘,电子云密度越尘.电子层〔能层〕:依照电子的能量差异和要紧运动区域的不同,核外电子分不处于不同的电子层.原子由里向外对应的电子层符号分不为K、L、H、N、0、P、Q.原子轨道〔能级即亚层〕:处于同一电子层的原子核外电子,也能够在不同类型的原子轨道上运动,分不用s、p、d、f表示不同形状的轨道,s轨道呈球形、D轨道呈纺锤形,d轨道和f轨道较复杂•各轨道的舒展方向个数依次为1、3、5、7.例1.以下关于氢原子电子云图的讲法正确的选项是A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大B.黑点密度大,单位体积内电子显现的机会大C.通常用小黑点来表示电子绕核作高速圆周运动D •电子云图是对运动无规律性的描述例2.以下有关认识正确的选项是A.各能级的原子轨道数按s、p、d、f的顺序分不为1、3、5、7B.各能层的能级差不多上从s能级开始至f能级终止C.各能层含有的能级数为n-lD.各能层含有的电子数为2r)22.(构造原理)了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1〜36号元素原子核外电子的排布.(1).原子核外电子的运动特点能够用电壬屋、原子轨道(业层)和自旋方一直进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.(2).原子核外电子排布原理.①•能量最低原理:电子先占据能疑低的轨道,再依次进入能量直的轨道.②.泡利不相容原理:每个轨道最多容纳亜个自旋状态不同的电子.③.洪特规那么:在能量相同的轨道上排布时,电子尽可能分占丕同的轨道,且自旋状态担同. 洪特规那么的特例:在等价轨道的全充满(p6、出0、件)、半充满(p3、cP、f).全空时(p。
——高中化学选修3知识点总结主要知重点:1、原子构2、元素周期表和元素周期律3、共价4、分子的空构型5、分子的性6、晶体的构和性(一)原子构1、能和能( 1)能和能的区分①在同一个原子中,离核越近能能量越低。
②同一个能的子,能量也可能不一样,能够把它分红能 s、p、d、f,能量由低到高挨次s、p、 d、 f。
③任一能,能数等于能序数。
④s、 p、 d、 f⋯⋯可容的子数挨次是 1、 3、 5、7⋯⋯的两倍。
⑤能不一样能相同,所容的最多子数相同。
( 2)能、能、原子道之的关系每能所容的最多子数是:2n2( n:能的序数)。
——2、结构原理(1)结构原理是电子排入轨道的次序,结构原理揭露了原子核外电子的能级散布。
(2)结构原理是书写基态原子电子排布式的依照,也是绘制基态原子轨道表示式的主要依照之一。
(3)不一样能层的能级有交织现象,如E( 3d)> E( 4s)、 E( 4d)> E( 5s)、 E(5d)> E(6s)、 E( 6d)> E(7s)、 E( 4f )> E( 5p)、 E( 4f )> E( 6s)等。
原子轨道的能量关系是: ns<( n-2) f <( n-1)d <np(4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数量对应着每个周期的元素数量。
依据结构原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2;最外层不超出8 个电子;次外层不超出18 个电子;倒数第三层不超出32 个电子。
( 5)基态和激发态①基态:最低能量状态。
处于最低能量状态的原子称为基态原子。
②激发态:较高能量状态(相对基态而言)。
基态原子的电子汲取能量后,电子跃迁至较高能级时的状态。
处于激发态的原子称为激发态原子。
③原子光谱:不一样元素的原子发生电子跃迁时会汲取(基态→激发态)和放出(激发态→较低激发态或基态)不一样的能量(主假如光能),产生不一样的光谱——原子光谱(汲取光谱和发射光谱)。
[课后达标训练]一、选择题1.下列晶体分类中正确的一组是( )24D项中玻璃为非晶体。
2.(2018·衡水中学高三调研)据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。
下列叙述正确的是( )A.该物质有很高的熔点、很大的硬度B.该物质形成的晶体属于分子晶体C.该物质分子中Si60被包裹在C60里面D.该物质的相对分子质量为1200解析:选B。
由分子式及信息可知该物质为分子晶体,A错误,B正确;Si的原子半径大于C,所以Si60的体积大于C60的体积,C错误;相对分子质量为(12+28)×60=2400,D错误。
3.(2015·高考上海卷)下列有关物质性质的比较,错误的是( )A.溶解度:小苏打<苏打B.密度:溴乙烷>水C.硬度:晶体硅<金刚石D.碳碳键键长:乙烯>苯解析:选D。
A.小苏打能溶于水,苏打易溶于水,因此溶解度:小苏打<苏打,正确。
B.溴乙烷密度>1g/mL,而水的密度等于1g/mL,因此密度:溴乙烷>水,正确。
C.晶体硅、金刚石都是原子晶体,原子之间通过共价键结合,由于原子半径:C<Si,所以共价键的强度:C—C>Si—Si,共价键越强,原子结合得就越牢固,物质的硬度就越大,所以物质的硬度:晶体硅<金刚石,正确。
D.乙烯分子中碳碳键是碳碳双键,而苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的特殊的化学键,所以键长:乙烯<苯,错误。
4.下列四种有关性质的叙述,可能属于金属晶体的是( )A.由分子间作用力结合而成,熔点低B .固体或熔融后易导电,熔点在1000℃左右C .由共价键结合成网状结构,熔点高D .固体不导电,但溶于水或熔融后能导电解析:选B 。
A 项,属于分子晶体的性质;C 项,属于原子晶体的性质;D 项,属于离子晶体的性质。
5.下列化合物中,化学键的类型和分子的极性(极性或非极性)皆相同的是( )A .CO 2和SO 2B .CH 4和CH 2Cl 2C .BF 3和NH 3D .HCl 和HI解析:选D 。
A 项,CO 2为极性键构成的非极性分子,SO 2为极性分子;B 项,CH 4为极性键构成的非极性分子,CH 2Cl 2是由极性键构成的极性分子;C 项,BF 3为极性键构成的非极性分子,NH 3为极性键构成的极性分子;D 项,HCl 和HI 都是极性键构成的极性分子。
6.(2018·盐城高三模拟)钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。
钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是( )A .BaTi 8O 12B .BaTi 4O 5C .BaTi 2O 4D .BaTiO 3解析:选D 。
仔细观察钛酸钡晶体的晶胞结构示意图可知:Ba 2+在立方体的中心,完全属于该晶胞;Ti 4+处于立方体的8个顶点,每个Ti 4+为与之相连的8个立方体所共用,即每个Ti 4+只有18属于该晶胞;O 2-处于立方体的12条棱的中点,每条棱为4个立方体共用,即每个O 2-只有14属于该晶胞。
则晶体中Ba 2+、Ti 4+、O 2-的个数比为1∶(8×18)∶(12×14)=1∶1∶3。
7.高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。
如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )A .超氧化钾的化学式为KO 2,每个晶胞含有4个K +和4个O -2B .晶体中每个K +周围有8个O -2,每个O -2周围有8个K +C .晶体中与每个K +距离最近的K +有8个D .晶体中与每个K +距离最近的K +有6个解析:选A 。
由题中的晶胞结构知:有8个K +位于顶点,6个K +位于面心,则晶胞中含有的K +数为8×18+6×12=4个;有12个O -2位于棱上,1个O -2处于中心,则晶胞中含有O -2数为12×14+1=4个,所以超氧化钾的化学式为KO 2;每个K +周围有6个O -2,每个O -2周围有6个K +,与每个K +距离最近的K +有12个。
8.根据表中给出的几种物质的熔、沸点数据,判断下列有关说法中错误的是( )3)A .SiCl 4和AlCl 3都是分子晶体B .单质B 可能是原子晶体C .NaCl 和MgCl 2在熔融状态和溶于水时均能导电D .NaCl 的键的强度比MgCl 2的小解析:选D 。
由表中所给熔、沸点数据可知,SiCl 4和AlCl 3都为分子晶体,A 项正确;单质B 的熔、沸点很高,可能为原子晶体,B 项正确;NaCl 和MgCl 2都是离子晶体,在熔融状态和溶于水时均能导电,C 项正确;NaCl 的熔、沸点高于MgCl 2,表明Na +与Cl -的键断裂比Mg 2+与Cl -的键断裂难,即NaCl 的键的强度大于MgCl 2,D 项错误。
9.下列有关说法不正确的是( )A .水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键B .CaF 2晶体的晶胞如图乙所示,每个CaF 2晶胞平均占有4个Ca 2+C .H 原子的电子云如图丙所示,H 原子核外大多数电子在原子核附近运动D .金属Cu 中Cu 原子堆积模型如图丁所示,为面心立方最密堆积,每个Cu 原子的配位数均为12解析:选C 。
电子云是用来表示电子出现的概率,但不代表有一个电子在那里,C 项错。
二、非选择题10.(2018·湛江毕业班调研)短周期元素X 、Y 的价电子数相同,且原子序数之比等于1∶2;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。
(1)Y 基态原子的价电子排布式为____________。
(2)预测Na 2Y 、H 2Y 在乙醇中的溶解度大小:_____________________________________。
(3)Y 与X 可形成YX 2-3。
YX 2-3的立体构型为____________(用文字描述),Y 原子轨道的杂化类型是________杂化。
写出一种由Y 的同周期元素Q 、V 形成的与YX2-3互为等电子体的分子的化学式:____________。
(4)Y 与Z 所形成化合物晶体的晶胞如图所示,该化合物的化学式为____________。
其晶胞边长为540.0pm ,密度为____________g·cm -3(列式并计算)。
(5)2mol 配合物[Z(NH 3)4]SO 4中含有σ键的数目为____________N A 。
解析:由题中信息可推知X 是O 元素,Y 是S 元素,Z 是Zn 元素。
(2)乙醇是极性溶剂,H 2S 是极性分子,Na 2S 是离子化合物,可看成极性很强的“分子”,根据相似相溶原理,H 2S 和Na 2S 在乙醇中都应有一定的溶解度,由于Na 2S 的“极性”比H 2S要强,因此Na 2S 在乙醇中的溶解度比H 2S 大。
(3)YX 2-3是SO 2-3,S 原子的价层电子对数是4,孤电子对数是1,所以SO 2-3的立体构型是三角锥形,S 原子的轨道杂化类型是sp 3杂化。
等电子体是指原子总数相等、价电子总数也相等的微粒,在第三周期中Cl 和P 形成的PCl 3与SO 2-3互为等电子体。
(4)晶胞中S 的个数是8×18+6×12=4,Zn 的个数是4,因此该化合物的化学式为ZnS 。
1pm =10-10cm ,1个晶胞中有4个“ZnS ”,所以晶胞的密度ρ=m V =97g·mol -16.02×1023mol -1×4(540.0×10-10cm )3≈4.1g ·cm -3。
(5)[Zn(NH 3)4]SO 4中Zn 2+和N 原子形成4个σ键(配位键),N 和H 之间共形成12个σ键,S 和O 之间形成4个σ键,所以1个[Zn(NH 3)4]SO 4中共有20个σ键,2mol[Zn(NH 3)4]SO 4中含有σ键的数目为40N A 。
答案:(1)3s 23p 4 (2)Na 2S>H 2S (3)三角锥形sp 3PCl 3 (4)ZnS 97g·mol -16.02×1023mol -1×4(540.0×10-10cm )3≈4.1(5)4011.如图为CaF 2、H 3BO 3(层状结构,层内的H 3BO 3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题。
(1)图Ⅰ所示的CaF 2晶体中与Ca 2+最近且等距离的F -的个数为________。
图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为________个。
(2)图Ⅱ所示的物质结构中最外层已达8电子结构的原子是________,H 3BO 3晶体中B 原子个数与极性键个数比为________。
(3)金属铜具有很好的延展性、导电性、导热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为________。
(5)已知两个距离最近的Ca 2+核间距为a×10-8cm ,结合CaF 2晶体的晶胞示意图,CaF 2晶体的密度为_________________________________________________________________。
解析:(1)CaF 2晶体中Ca 2+的配位数为8,F -的配位数为4,Ca 2+和F -个数比为1∶2;铜晶体中未标号的铜原子周围最紧邻的铜原子为上层的1、2、3,同层的4、5、6、7、8、9,下层的10、11、12,共12个。
(2)图Ⅱ中B 原子最外层三个电子形成三条共价键,最外层共6个电子,H 原子达到2电子稳定结构,只有氧原子形成两条共价键达到8电子稳定结构。
H 3BO 3晶体是分子晶体,相互之间通过氢键相连,每个B 原子形成三条B —O 极性键,每个O 原子形成一条O —H 极性键,共六条极性键。
(3)电子气理论把金属键描述为金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起,可以用来解释金属键的本质,金属的延展性、导电性、导热性。
(4)H 3BO 3晶体是分子晶体,熔点最低,受热熔化时克服分子间作用力。
(5)一个CaF 2晶胞中实际拥有的离子数:Ca 2+数为8×18+6×12=4,而F -数为8,从而确定1个晶胞实际拥有4个“CaF 2”,则CaF 2晶体的密度为4×78g·mol -1÷[(2a ×10-8cm)3×6.02×1023mol -1]=183.2a3g·cm -3。