实验二 质粒的酶切、琼脂糖凝 胶电泳分离DNA
1. 实验目的 2. 实验原理 3. 实验仪器、材料与试剂 4. 实验步骤 5. 实验结果及讨论
实验目的
限制性内切酶切割出目的DNA
了解琼脂糖凝胶电泳的原理
掌握琼脂糖凝胶的制作及进行电泳的方 法
实验原理
利用限制性内切酶具有特定的识别及切割位 点,定点切割环状质粒DNA。
Tris 242g 冰醋酸 57.1ml 0.5mol/L EDTA(pH8.0) 100ml 3. 溴化乙锭溶液 10mg/ml水溶液,室温,棕色瓶或铝 铂纸包装保存。 4. 10×DN切体系
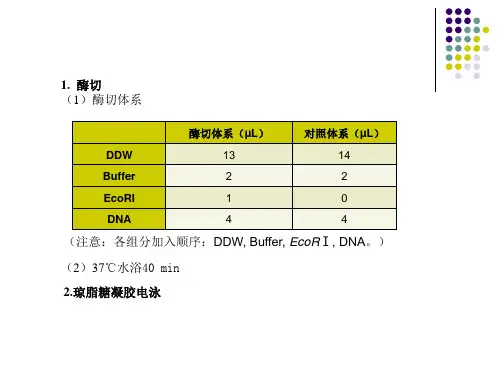
调制酶切体系如下: (共 20μL)
无菌水 6μL,
质粒
10 μL
Buffer K 2μL,
EcoR I 1μL,
BamH I 1 μL
37℃酶切1.5小时。
琼脂糖凝胶制备
1. 洗净电泳槽、制胶槽、梳子、挡板,晾干。 2. 插好挡板、梳子。 3. 根据实验所需称取0.4克琼脂糖,放入制胶
的容器中(一般用三角瓶),然后加入40ml电 泳缓冲液(1×TAE)。 4. 加热煮沸,使琼脂糖完全溶解。 5. 溶液冷至约60℃时,加入溴化乙锭4 μL (终浓 度为0.1 g/l),轻轻摇匀,倒入制胶槽上,检查 有无气泡。
纯度;DNA的甲基化程度;温度;缓冲液成分 (DDT,BSA)等。
使用3 mg的DNA Marker DL 2,000(500 ng/条带)进行1% 的琼脂糖凝胶电泳后,各DNA条带自上至下分别为2kb,1Kb, 750bp,500bp,250bp,100bp。
9.用移液器吸起离心管中溶液,移入凝胶的梳孔中。
10.插上导线,打开电泳仪电源,按照需要调节 电压至120V,电泳开始,观察电流情况或电泳 槽中负极的铂金丝是否有气泡出现。