PCI围手术期辅助抗栓治疗
- 格式:ppt
- 大小:690.00 KB
- 文档页数:42




急诊PCI抗栓治疗策略(全文)急性冠脉综合征(ACS)是以冠状动脉粥样硬化斑块破裂或糜烂,继发完全或者不完全闭塞性血栓形成为病理基础的一组临床综合征。
根据心电图表现为ST段抬高型(STE-ACS)和非ST段抬高型(NSTE-ACS)。
临床实践发现,虽然两者在临床表现和治疗策略上有较大的区别,但冠状动脉粥样硬化斑块由稳定转为不稳定,继而破裂导致血栓的形成。
NSTE -ACS为血栓不完全堵塞动脉或微栓塞,而STE-ACS则为血栓完全阻塞动脉血管。
在ACS的患者中,抗血小板与抗凝同等重要。
粥样斑块破裂后的血栓形成过程是一个多环节的过程。
一旦血管内皮下成分暴露,血栓的形成过程即被激发,这些血管内皮下成分包括胶原和组织因子等,血小板表面受体,主要是糖蛋白Ib,迅速识别这些因子,血小板被吸附并被激活。
再激活的过程中,血小板α颗粒分泌大量的物质,这些物质会导致血管收缩和附近的血小板激活,血小板分泌因子V.在血小板磷脂表面同因子Xa和钙离子结合起来,形成磷脂酶复合物,加速凝血酶原向凝血酶的转化。
凝血酶催化纤维蛋白原转化为纤维蛋白。
交连的纤维蛋白网络细胞成分,包括血小板,最后导致血栓的形成,血栓和由血栓引起的血管收缩可能导致心肌缺血。
目前比较常用的抗血小板药物就是抑制四烯酸(AA)代谢途径的药物,最常见的就是阿司匹林,阿司匹林被誉为抗血小板药物的“常青树”。
另一种是特异性ADP受体抑制剂,像氯吡格雷和普拉格雷、替格瑞洛等。
关于抗栓的治疗策略各个指南也都有推荐。
在2017欧洲心脏病学会《急性ST段抬高型心肌梗死管理指南》中指出,急诊PCI治疗患者的围术期抗栓治疗抗血小板治疗推荐:若无相对禁忌症(如出血风险高),推荐PCI术前(至少在手术时)使用P2Y12抑制剂(普拉格雷或替格瑞洛)或氯吡格雷,使用12个月。
无禁忌症的患者推荐尽早使用阿司匹林(口服,吞咽困难时静脉注射)。
若有证据提示无复流或栓塞并发症考虑使用GP llb/lla抑制剂补救治疗。


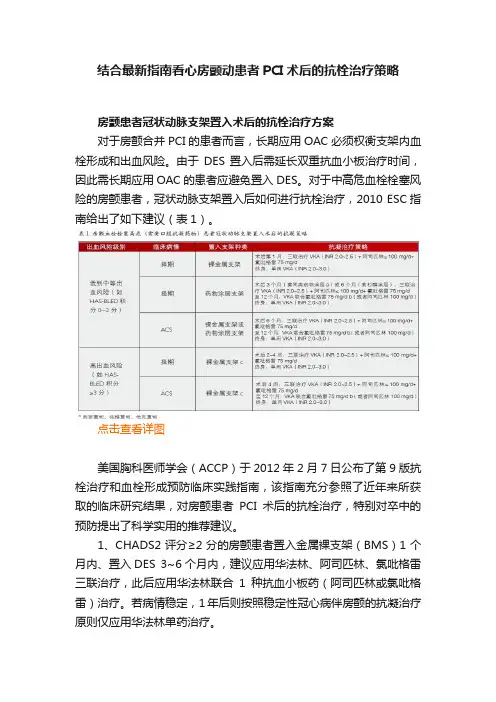
结合最新指南看心房颤动患者PCI术后的抗栓治疗策略房颤患者冠状动脉支架置入术后的抗栓治疗方案对于房颤合并PCI的患者而言,长期应用OAC必须权衡支架内血栓形成和出血风险。
由于DES置入后需延长双重抗血小板治疗时间,因此需长期应用OAC的患者应避免置入DES。
对于中高危血栓栓塞风险的房颤患者,冠状动脉支架置入后如何进行抗栓治疗,2010 ESC指南给出了如下建议(表1)。
点击查看详图美国胸科医师学会(ACCP)于2012年2月7日公布了第9版抗栓治疗和血栓形成预防临床实践指南,该指南充分参照了近年来所获取的临床研究结果,对房颤患者PCI术后的抗栓治疗,特别对卒中的预防提出了科学实用的推荐建议。
1、CHADS2评分≥2分的房颤患者置入金属裸支架(BMS)1个月内、置入DES 3~6个月内,建议应用华法林、阿司匹林、氯吡格雷三联治疗,此后应用华法林联合1种抗血小板药(阿司匹林或氯吡格雷)治疗。
若病情稳定,1年后则按照稳定性冠心病伴房颤的抗凝治疗原则仅应用华法林单药治疗。
2、CHADS2评分0~1分者,建议在支架置入术后1年内进行双联抗血小板药物(阿司匹林与氯吡格雷)治疗,无需进行三联治疗。
1年后若病情稳定则参照稳定性冠心病伴房颤的治疗原则进行抗凝治疗。
3、伴房颤的急性冠状动脉综合征(ACS)患者、未进行支架置入术且CHADS2评分≥1分时,建议华法林联合1种抗血小板药物治疗1年。
1年后若病情稳定则参照稳定性冠心病伴房颤的治疗原则进行抗凝治疗。
对于CHADS2评分为0分者本指南也作出了相同的推荐建议,即华法林联合1种抗血小板药物治疗1年。
不稳定性心绞痛与支架置入术后的患者应用双联抗血小板治疗可显著降低不良心血管事件风险。
当房颤患者合并上述情况时,在华法林治疗基础上加用双联抗血小板药物治疗亦可减少血栓栓塞事件的发生。
现有证据提示,与仅应用双联抗血小板药物治疗者相比,短期(如1个月)加用华法林并不会显著增加出血事件风险,但长期应用三联抗栓药物的安全性尚有待论证。

PCI 围手术期中权衡抗栓治疗与出血风险主要内容经皮冠状动脉介入治疗(PCI) 术后出现出血或者血管相关并发症,延长住院时间,增加短期和长期致病率、致死率。
预防相关并发症能提高PCI 的安全性和健康治疗。
近期,来自梅奥诊所的 Mandeep Singh 对当前用于减少PCI 术后出血风险的技术进行回顾,并为读者提供减少PCI 术后出血风险的措施,该文发表在 Journal of the American College of Cardiology 杂志上。
出血定义评估抗血小板药物、心脏装置或者PCI 的安全性和有效性时,出血并发症常常作为实验的终点,但目前缺乏对出血定义的统一标准。
在BARC 研究中,将出血定义分为5 类,考虑出血原因(程序或非程序)、部位(眼内、颅内、内脏、腹膜等)、出血严重性(根据实验数据及临床状态的影响进行定量分析)及预后,并将CABG 相关出血考虑在内。
而NCDR 研究则考虑手术部位出血或非手术部位出血以及术前血红蛋白量。
同样的在TIMI 研究和GUSTO 研究中其定义也不一致。
高危因素在经股动脉插管的PCI 术后的患者中,女性、老龄、肾脏损害、鞘管大、活化凝血酶时间(ACT)长、Ⅱb/Ⅲa 抑制剂的使用、血管闭合器(VCD)的使用以及手术时间较长是高出血风险的危险因素。
且NCDR 研究指出心功能不全、外周血管疾病以及既往ACS 患者中出血风险较高。
出血趋势总体上PCI 术后穿刺部位出血风险均有明显降低,主要原因可能为:1. 桡动脉穿刺位点的增加;2. 股动脉穿刺时小号鞘管的使用;3. 比伐卢定及Ⅱb/Ⅲa 抑制剂的合理使用。
但非穿刺口部位的出血倾向则无明显的改变。
药物进展随着抗凝药物与抗血小板药物的进展,PCI 术后出血发生率明显下降。
而随着抗凝强度下降与双联抗血小板治疗应用,出血风险明显下降。
但是在高危人群仍存在药物剂量使用不当的情况。
相关研究表明约42% 非ST 段抬高心肌梗死(NSTEMI)患者存在肝素、低分子肝素以及Ⅱb/Ⅲa 抑制剂的过度使用。



PCI围术期抗血栓治疗的再思考——《中国PCI指南(2016)》解读韩雅玲【期刊名称】《中华保健医学杂志》【年(卷),期】2016(018)005【总页数】3页(P349-351)【关键词】冠心病;经皮冠状动脉介入治疗;抗血小板治疗;抗凝治疗【作者】韩雅玲【作者单位】110016 沈阳军区总医院全军心血管病研究所心内科【正文语种】中文【中图分类】R543.31[专家简介]韩雅玲,中国工程院院士,著名心血管病专家,主任医师、教授,医学博士,博士生导师。
现任沈阳军区总医院终身荣誉院长、全军心血管病研究所所长、心血管内科主任,全军心血管急重症救治重点实验室主任。
任美国心脏学院专科会员(FACC)、欧洲心脏协会专科会员(FESC)、中华医学会心血管病学分会候任主任委员、中国医师协会心内科医师分会候任会长、全军心血管内科专业委员会前任主任委员、辽宁省医学会心血管病学分会主任委员、辽宁省医师协会内科医师分会会长、全军医学科技委员会常委和内科学领域委员会副主任委员,美国《Circulation》杂志编委,英国《Cardiovascular Therapeutics》杂志副主编,《临床军医杂志》主编,《中国介入心脏病学杂志》执行主编,《中华医学杂志》(英文版)、《中华心血管病杂志》、《解放军医学杂志》、《解放军医药杂志》、《中华老年多器官疾病杂志》英文版、《中国介入心脏病学杂志》、《中华保健医学杂志》、《中国实用内科杂志》和《Military Medical Research》副主编。
以第一负责人承担国家自然科学基金重点课题、国家重大新药创制创新药物研究开发技术平台建设课题、国家“十二五”科技支撑计划项目、军队“十一五”、“十二五”重点攻关课题、军事医学专项攻关课题等30余项科研课题。
以第一作者获得何梁何利基金科学与技术进步奖1项(2015)、国家科技进步二等奖2项(2008、2013)、军队科技进步一等奖1项(2015)、军队医疗成果一等奖2项(2002、2012)、辽宁省科技进步一等奖3项(1995、2007、2016),以及辽宁医学科技一等奖(2014)、军队医疗成果二等奖(2007)、辽宁省科技进步二等奖(2011)和中华医学科技进步二等奖(2007)各1项。