九年级化学观察化学变化
- 格式:pdf
- 大小:1.23 MB
- 文档页数:8



认识化学变化是九年级化学中的重要章节之一、本章主要内容包括化学反应与化学方程式、质量守恒和能量守恒、化学反应速率、化学平衡等。
以下是对该章节知识点的整合。
1.化学反应与化学方程式化学反应是指物质在化学变化过程中原子、离子或分子之间的重组和重新排列,从而形成新的物质。
化学反应可由化学方程式表示,化学方程式由反应物和生成物组成。
例如:2H2+O2→2H2O表示氢气和氧气反应生成水。
2.质量守恒和能量守恒化学反应过程中,原子数量守恒,即反应物中的原子数量等于生成物中的原子数量。
这个基本原理被称为质量守恒定律。
能量守恒定律指出,在化学反应中,能量既不能被创造也不能被摧毁,只能从一种形式转化为另一种形式。
3.化学反应速率化学反应速率是指单位时间内,反应物消失或生成物出现的量变化。
化学反应速率受到温度、浓度、表面积、催化剂等因素的影响。
通常,高温、高浓度、大表面积和适当的催化剂会加快反应速率。
4.化学平衡在反应物和生成物之间存在的反应物浓度或生成物浓度保持恒定的状态被称为化学平衡。
化学平衡可以用化学方程式和平衡常数来描述。
化学平衡的特点包括转化速度的变化、反应物浓度与生成物浓度之间的比例关系以及平衡常数的大小。
5.反应热反应热是指化学反应过程中放出或吸收的热量变化。
化学反应的放热或吸热性质是比较反应物和生成物之间键的能量差异来确定的。
放热反应是指化学反应过程中放出热量的反应,吸热反应是指化学反应过程中吸收热量的反应。
6.酸碱中和反应酸碱中和反应是指酸和碱反应生成盐和水的反应。
酸性溶液中的氢离子与碱性溶液中的氢氧根离子结合生成水。
酸碱中和反应的化学方程式可用H++OH-→H2O表示。
7.胶体溶液胶体溶液是介于溶液和悬浮液之间的一种混合物。
胶体溶液由胶体和溶剂两部分组成,溶剂中的颗粒被分散均匀,但颗粒大小比溶解物要大。
胶体溶液的可见度随颗粒大小的变化而变化。
8.毒理与环境保护化学变化相关的毒性物质会对人体和环境造成危害。

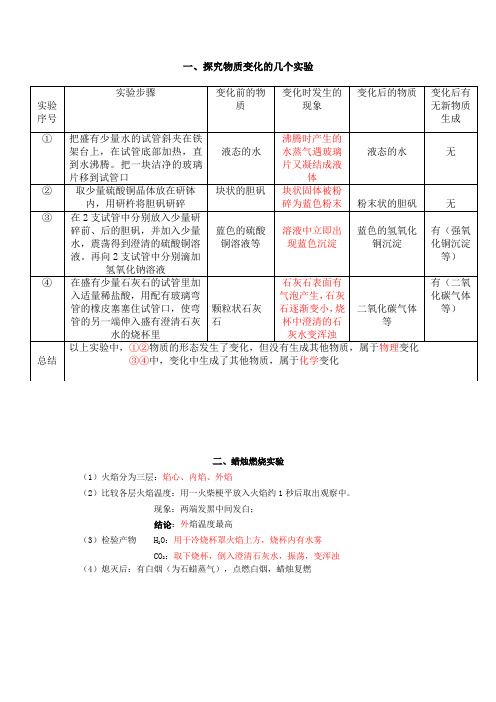
一、探究物质变化的几个实验二、蜡烛燃烧实验(1)火焰分为三层:焰心、内焰、外焰(2)比较各层火焰温度:用一火柴梗平放入火焰约1秒后取出观察中。
现象:两端发黑中间发白;结论:外焰温度最高(3)检验产物 H2O:用干冷烧杯罩火焰上方,烧杯内有水雾CO2:取下烧杯,倒入澄清石灰水,振荡,变浑浊(4)熄灭后:有白烟(为石蜡蒸气),点燃白烟,蜡烛复燃三、吸入空气与呼出气体的比较注意:吸入空气与呼出气体成分是相同的。
四、走近化学实验室1、固体药品的取用取用固体药品一般用药匙或纸槽,有些块状药品可用镊子夹取操作要点:先将试管放平,将药品放入试管底部,再慢慢竖立起来2、液体药品的取用操作要点:液体的倾倒:瓶塞要倒放,避免污染瓶塞;瓶签要向着手心,避免污染标签;瓶口要紧挨着试管口,避免液体洒出液体量取:量筒须放平,视线与量筒内液体的凹液面的最低处保持水平吸取和滴加少量液体时可用滴管保持滴管竖直在管口上方不可把滴管伸入试管内,避免污染滴管不可将滴管横放或倒持,避免试机回流腐蚀胶头3、给物质加热酒精灯的使用操作要点:要用火柴或打火机点燃酒精灯,不能用另一只酒精灯点燃熄灭时要用灯帽盖灭;外焰、内焰、焰心中,外焰温度最高,焰心温度最低加热试管里的液体操作要点:将试管夹从试管底部往上套,夹在试管中上部,先将试管来回移动,使试管均匀受热,然后利用外焰对准试管内被加热物质加热加热时,试管内液体不能超过试管容积的三分之一点燃 五、空气中氧气含量的测定实验原理 利用红磷燃烧小号密闭容器内空气中的氧气,使密闭容器内压强减小,在大气压的作用下,进入容器内水的体积即为减少的氧气的体积红磷+氧气——→五氧化二磷P O2 P2O5实验装置①仪器:集气瓶、燃烧匙、导管、烧杯、弹簧夹乳胶管②药品:红磷、水③实验装置图(附装置图) 实验步骤①连接装置 ②检查装置的气密性 ③在集气瓶内加入少量水后,把集气瓶生于容积五等分 ④用弹簧夹夹紧乳胶管 ⑤点燃红磷后,立即伸入集气瓶内并把塞子塞紧 ⑥燃烧结束冷却后,打开弹簧夹实验现象红磷在集气瓶内燃烧,生成大量白烟(五氧化二磷小颗粒),冷却后,打开弹簧夹,水经导管进入集气瓶,进入水的体积约占集气瓶内空气总体积的五分之一 分析与结论 红磷燃烧生成的五氧化二磷为固体,极易溶于水且几乎不占有体积,燃烧消耗了集气瓶内的氧气,冷却后,大气压把烧杯内的水压进集气瓶,压进的水的体积约是集气瓶内消耗的氧气的体积由此证明氧气约占空气的五分之一 。

第4章认识化学变化知识整合:燃烧与灭火一、燃烧1.燃烧:是一种发光、发热的剧烈的化学反应实验探究:燃烧的条件实验现象:铜片上的白磷燃烧起来,冒出大量白烟;红磷没有燃烧;水中的白磷熔化成液滴,没有燃烧;分析原因:水中的白磷没有燃烧是因为与氧气隔绝;铜片上的红磷没有燃烧是因为温度没有达到红磷的着火点;该实验中,热水的作用:隔绝氧气、提供温度2.物质燃烧的条件 (同时满足,缺一不可)(1)物质具有可燃性(2)可燃物与氧气接触(3)可燃物的温度达到着火点3.影响物质燃烧剧烈程度的因素(1)可燃物的性质(2)氧气的浓度(3)可燃物与氧气的接触面积大小二、完全燃烧和不完全燃烧1.碳的完全燃烧和不完全燃烧在氧气充足时,碳发生完全燃烧的符号表达式:C+O2 CO2在氧气不充足时,碳发生不完全燃烧的符号表达式:C+O2CO小结:木炭在氧气中燃烧比在空气中剧烈,说明可燃物燃烧现象不同是与氧气的浓度有关;木炭在空气中燃烧时出现不同产物,是由氧气的量决定。
2.一氧化碳(1)物理性质:一氧化碳是无色无味的气体,难溶于水,(2)化学性质:①一氧化碳具有可燃性符号表达式:CO+O2 CO2现象:产生蓝色火焰,放热用途:可作气体燃料②一氧化碳具有毒性:能与人体血液中的血红蛋白结合,使血红蛋白丧失了输氧功能,会导致人体缺氧。
当发生一氧化碳中毒时,应立即开窗通风,并迅速将中毒者移至空气新鲜处,严重者应立即送医院救治。
三、爆炸1.在有限的空间内,如果发生急速燃烧,就会在短时间内聚积大量的热,使气体的体积迅速膨胀,引起爆炸。
2.如果氧气的浓度较高或可燃物与氧气的接触面积很大,燃烧范围广,周围的空气迅速猛烈膨胀,也会发生爆炸。
3.可燃性气体、可燃性固体粉尘在空气中并不是在任何比例下都会发生爆炸,只有当它们处于爆炸极限范围内且遇到明火时才会发生爆炸。
4.易燃物或易爆物在遇到明火、高温或撞击时,极易发生燃烧或爆炸。
因此在生产、运输、使用、储存易燃物和易爆物时,要注意通风,严禁烟火,防止撞击和高温,以有效防止爆炸的发生。
九年级化学的全部化学实验步骤实验一:酸碱中和反应1. 准备实验器材和药品:蓝色石蕊试剂、盐酸溶液、酚酞指示剂、滴定管、烧杯等。
2. 取适量盐酸溶液倒入烧杯中。
3. 加入少量蓝色石蕊试剂,并搅拌均匀。
4. 滴加酚酞指示剂,观察颜色变化。
5. 用滴定管滴加盐酸溶液,直到溶液由紫红变成粉红色。
6. 记录滴加的盐酸溶液体积。
7. 根据记录的实验数据,计算出反应的化学方程式和反应物的摩尔比例。
实验二:金属与酸反应1. 准备实验器材和药品:锌粉、稀盐酸、试管、试管夹等。
2. 在试管中倒入适量稀盐酸。
3. 加入少量锌粉。
4. 观察试管中的气泡产生和颜色变化。
5. 记录观察到的实验现象。
6. 根据实验现象,总结金属与酸反应的特点和规律。
实验三:氧气的制取1. 准备实验器材和药品:过氧化氢、锌片、烧杯、试管等。
2. 将过氧化氢倒入烧杯中。
3. 加入适量锌片,并用试管盖住。
4. 观察试管中气体的变化。
5. 记录观察到的实验现象。
6. 根据实验现象,说明氧气的制取原理和制取过程。
实验四:溶液的蒸发结晶1. 准备实验器材和药品:食盐、蒸发皿、三角架、酒精灯等。
2. 在蒸发皿中加入适量食盐溶液。
3. 将蒸发皿放在三角架上,用酒精灯进行加热。
4. 观察蒸发皿中的溶液随着加热的现象。
5. 当溶液快要蒸发完时,停止加热。
6. 观察蒸发皿中形成的结晶物质。
7. 根据观察到的实验现象,说明溶液的蒸发结晶过程。
实验五:电解水制氢气和氧气1. 准备实验器材和药品:蒸馏水、电解池、导线、氢气收集装置等。
2. 将蒸馏水倒入电解池中。
3. 将导线连接电解池的两端。
4. 开启电源,通电一段时间。
5. 观察氢气和氧气的气体产生情况。
6. 使用氢气收集装置收集氢气和氧气。
7. 根据观察到的实验现象,说明水的电解过程和氢气、氧气的制取方法。
以上为九年级化学的部分实验步骤,通过实验的进行,可以加深对化学反应和物质性质的理解和掌握。
(完整)九年级化学的全部化学实验步骤九年级化学的全部化学实验步骤实验一:酸碱反应实验实验材料:- 石蕊试纸- 盐酸溶液- 碳酸氢钠溶液- 红茶水溶液实验步骤:1. 取一小张石蕊试纸,将其蘸入盐酸溶液中;2. 将试纸拿出,观察其颜色变化。
如果试纸变红,说明是酸性物质;3. 再取一小张石蕊试纸,将其蘸入碳酸氢钠溶液中;4. 将试纸拿出,观察其颜色变化。
如果试纸变蓝,说明是碱性物质;5. 最后,将试纸蘸入红茶水溶液中;6. 观察试纸颜色变化,如果试纸保持原来的颜色,说明是中性物质。
实验二:金属活性实验实验材料:- 锌片- 铁片- 美国硬币- 醋酸实验步骤:1. 每一种金属材料准备一块;2. 将锌片放入一个试管中;3. 将铁片放入另一个试管中;4. 将美国硬币放入第三个试管中;5. 向每个试管中加入相同的醋酸;6. 观察每个试管中的金属片变化情况。
如有气泡产生,说明金属活性较高。
实验三:电解实验实验材料:- 电解槽- 碳棒- 铜片- 镀金线- 环氧树脂实验步骤:1. 在电解槽中注满适量的水,并加入一些盐,使其溶解;2. 在电解槽中放入一个碳棒作为阴极,一个铜片作为阳极,并用夹子固定;3. 将两极的电线分别连接到电池的正负极上;4. 打开电池开关,开始通电;5. 观察电解槽中的变化,如果阴极上出现气泡,而阳极上的铜片逐渐溶解,则说明电解反应发生。
实验四:物质燃烧实验实验材料:- 纸片- 火柴- 酒精灯- 碱性电池- 氧气气体实验步骤:1. 将一小条纸片放在实验台上;2. 用火柴点燃纸片的一角;3. 观察纸片燃烧的现象,以及发生的变化;4. 将火柴点燃酒精灯中的酒精;5. 将一根碱性电池放在实验台上;6. 用火柴点燃碱性电池的一角;7. 观察碱性电池燃烧的现象,以及发生的变化;8. 最后,将氧气气体放在明火上,观察其燃烧的现象。
以上是九年级化学的全部化学实验步骤,希望对你有所帮助。
化学观察化学变化是化学实验中最常见和重要的内容之一、通过观察化学反应的现象和变化,可以帮助我们理解物质的性质和变化规律。
下面将从化学反应的颜色变化、气体的产生和消失、固体的沉淀和溶解、液体的蒸发和沸腾等角度,详细介绍九年级化学观察化学变化的内容。
首先,化学反应中的颜色变化是观察化学变化最直观的方法之一、许多化学反应中,物质的颜色发生了明显的变化。
例如,酸和碱反应产生的盐水从无色变为呈现酸或碱的颜色;金属和酸反应时,金属表面被氧化形成的氧化物呈现出不同的颜色(如铜变绿色、铁变红色)。
通过观察颜色变化,我们可以推测出化学反应过程中发生的变化和生成的物质。
其次,化学反应中的气体的产生和消失也是化学变化的重要观察指标之一、在许多化学反应中,气体的产生和消失常常 beg to differ as witnesses to the chemical changes。
例如,酸和碳酸酐反应产生二氧化碳气体,这个气体会使酸溶液产生冒泡现象;金属和酸反应会产生氢气,可以通过放置火柴靠近试管口处,看到火柴会随氢气的产生而燃烧。
通过观察气体的产生和消失,我们可以判断出化学反应是否发生和生成的气体是什么。
此外,化学反应中的固体的沉淀和溶解也是很重要的观察点。
许多化学反应中,固体物质会从溶液中析出形成沉淀,或者反之,沉淀会以溶解的形式重新消失。
例如,饱和盐水冷却后,溶解在水中的一部分盐会结晶析出;金属盐和酸反应时,会产生不溶于水的盐,从而生成固体沉淀。
通过观察固体的沉淀和溶解,我们可以推断出化学反应中物质的溶解度和晶体形成的条件。
最后,液体的蒸发和沸腾也是常见的化学变化观察内容。
在化学反应中,液体可以蒸发为气体,或者在沸腾条件下大量气泡产生。
例如,酒精和水混合后,可以通过加热使酒精挥发,最终得到水的纯净溶液;水在加热到一定温度时,会产生气泡并迅速沸腾。
通过观察液体的蒸发和沸腾,我们可以了解物质的挥发性和沸点。
综上所述,在化学实验中观察化学变化是十分重要的。