第2 章热力学第一定律
- 格式:pdf
- 大小:64.01 KB
- 文档页数:6









第二章热力学第一定律Ⅰ学习指导一、基本思路热力学主要包括热力学第一定律和热力学第二定律。
本章热力学第一定律介绍封闭的热力学系统在状态变化时热力学能、热和功之间相互转化所遵循的规律。
首先介绍了热力学的基本概念,如系统和环境、状态函数、过程和途径、热力学平衡态、热和功等,得出了热力学第一定律的文字表述和数学表达式。
热力学能是热力学第一定律所引出的重要的状态函数,它是系统内部所具有的能量。
热和功是封闭系统在状态变化时与环境传递能量的两种方∆=+,将封闭系统变化过程式,都与过程有关,称为过程量。
通过热力学第一定律U Q W中热、功和热力学能改变联系了起来。
焓是由系统的热力学能、体积和压力组合得到的一个状态函数,在一定条件下,系统的焓变与过程的热相联系,焓及其有关公式可以看成是热力学第一定律的扩展。
通过Gay-Lussac-Joule实验,说明理想气体的热力学能和焓只是温度的函数;通过Joule-Thomson实验讨论了热力学第一定律对实际气体的应用。
热力学第一定律的具体应用就是围绕不同过程(理想气体简单状态变化、相变和化学变化)中热、功、热力学能变和焓变的计算展开。
准静态过程和可逆过程是热力学的重要概念;卡诺循环是热力学的特殊循环。
热化学是热力学第一定律对于化学反应系统的应用,据此可以计算反应的热效应,通常利用热化学数据(生成焓和燃烧焓)及Hess定律可直接求得298 K下反应的热效应,应用Kirchhoff定律可计算不同温度下反应的热效应。
本章还介绍了热力学第零定律,以热平衡现象为基础给出了温度的概念。
本章的主要内容及其逻辑关系如框图所示。
二、基本概念1.热力学第零定律如果两个系统分别和处于确定状态的第三个系统达到热平衡,则这两个系统彼此也将处于热平衡。
这个热平衡规律称为热力学第零定律。
此定律给出了温度的概念和比较温度的方法。
2.状态函数状态是系统的一切宏观性质(质量、温度、压力、密度和热力学能等)的综合表现。
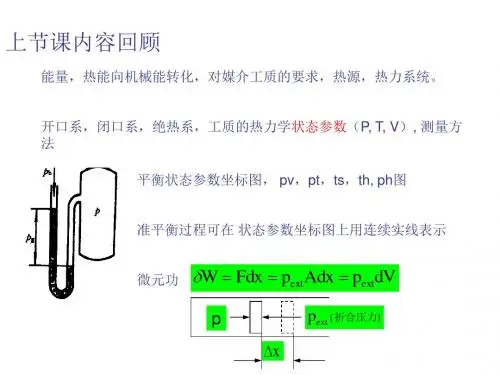
第二章热力学第一定律基本公式功: δW = -P外dV热力学第一定律: dU =δQ + δW ΔU = Q + W焓的定义: H ≡ U + PV热容的定义: C=limΔT→0δQ/ ΔT等压热容的定义: C P =δQ P /dT =(∂H/∂T)P等容热容的定义: C V =δQ V /dT =(∂U/∂T)V任意体系的等压热容与等容热容之差: C P - C V = [P + (∂U/∂V)T] (∂V/∂T)P 理想气体的等压热容与等容热容之差: C P - C V = nR理想气体绝热可逆过程方程: γ = C P / C VPVγ-1 =常数T Vγ-1 =常数P1-γTγ=常数理想气体绝热功: W =C V(T1 – T2 ) W = P1V1 – P2V2 /γ-1热机效率: η = W/Q2可逆热机效率: η = T2 – T1 / T2冷冻系数: β= Q1′/W可逆制冷机冷冻系数: β = T1 / T2 – T1焦汤系数: μ = ( ∂T/ ∂P)H = - (∂H/∂P)/C P反应进度: ξ= n B – n B0 / νB化学反应的等压热效应与等容热效应的关系: Q P = Q V + ΔnRT当反应进度ξ= 1 mol 时Δr H m= Δr U m +ΣBνB RT化学反应等压热效应的几种计算方法:Δr H m⊖=ΣBνBΔf H m⊖(B)Δr H m⊖=ΣB (єB )反应物 - ΣB(єB )产物Δr H m⊖= -ΣBνBΔC H m⊖(B)反应热与温度的关系: Δr H m(T2) =Δr H m(T1) + ∫21T TΔr C P dT表 1-1 一些基本过程的W 、Q、△U 、△H 的运算过程W Q △U △H 理想气体自由膨胀0 0 0 0 理想气体等温可逆 -nRTLnV2/V1 -nRTLnV2/V10 0任意物质等容可逆理想气体0∫C V dT∫C V dTQ v∫C V dT△U + V△P∫C P dT任意物质等压可逆理想气体-P外△V-P外△V∫C P dT∫C p dTQ P - P△V∫C V dTQ P∫C P dT理想气体绝热过程C V(T2 – T1)1/γ-1(P2V2-P1V1) 0 ∫C V dT ∫C P dT理想气体多方可逆过程PVδ=常数n R/1-δ(T2-T1) △U + W ∫C V dT ∫C P dT 可逆相变(等温等压) -P外△V Q P Q P -W Q P化学反应(等温等压) -P外△VQ PQ P – WΔr H m=Δr U m+ΣBνB RTQ PΔr H m⊖=ΣBνBΔf H m⊖(B) 例题例1 0.02Kg 乙醇在其沸点时蒸发为气体。
第2章 热力学第一定律一 基本要求:1. 深入理解热力学第一定律的实质,掌握热力学第一定律的表达式——能量方程,并熟练应用热力学第一定律解决工程实际中的有关问题。
2. 掌握储存能、热力学能和焓的概念。
3. 掌握体积变化功、流动功、轴功和技术功的概念,计算他们之间的关系。
二 重点、难点:1. 热力学第一定律的实质。
2. 焓的物理意义。
3. 热力学能及系统总储存能的区分。
4. 开口及闭口系统的能量方程。
5. 技术功、轴功、推动功和膨胀功的联系及区别。
6. 稳定流动能量方程式的应用。
三 典型题精解:例1:气缸内储有完全不可压缩的流体,气缸的一端被封闭,另一端是活塞。
气缸是绝热静止的。
试问:(1) 活塞能否对流体做功? (2) 流体的压力会改变吗?(3) 若使用某种方法把流体从0.2Mpa 提高到4Mpa ,热力学能有无变化?焓有无变化? 解:(1)汽缸活塞系统是闭口系统。
由于流体不可压缩,流体的体积不会变化,因此流体的体积变化功为零,活塞不能对流体做功。
(2)根据牛顿第三定律,流体的压力应与外力时时相等,因而当活塞上的作用力改变时,流体的压力也随之改变。
(3)根据已知条件,汽缸活塞系统与外界无热交换,Q=0,又W=0,由能量方程 Q=∆U+W 知∆U=0,故流体热力学能无变化。
焓H=U+pV ,当U ,V 不变,p 提高时,H 应增大。
讨论:(1) 从本题分析可以看到,闭口系统与外界有无功量交换,不在于压力大小或系统压力有无变化,而在于系统有无体积的变化。
(2) 本题由于系统与外界无热量交换,无功量交换,因而系统的热力学能变化为零,但焓的变化不为零。
应将热力学能和焓的概念加以正确区分。
例2.门窗紧闭的房间内有一台电冰箱正在运行,若敞开冰箱的大门就有一股凉气扑面,感到凉爽。
于是有人就想通过敞开冰箱大门达到降低室内温度的目的,你认为这种想法可行吗? 解:按题意,以门窗禁闭的房间为分析对象,可看成绝热的闭口系统,与外界无热量交换,Q=0,如图2.1(a)所示,当安置在系统内部的电冰箱运转时,将有电功输入系统,根据热力学规定:0<W ,由热力学第一定律W U Q +∆=可知,0>∆U ,即系统的内能增加,也就是房间内空气的内能增加。
由于空气可视为理想气体,其内能是温度的单值函数。
内能增加温度也增加,可见此种想法不但不能达到降温目的,反而使室内温度有所升高。
若以电冰箱为系统进行分析,其工作原理如图2.1(b)所示。
耗功W 后连同从冰室内取出的冷量0Q 一同通过散热片排放到室内,使室内温度升高。
图2.1 例3. 既然敞开冰箱大门不能降温,为什么在门窗紧闭的房间内安装空调器后却能使温度降低呢? 解:参看图2.2(a), 仍以门窗紧闭的房间为对象。
由于空调器安置在窗上,通过边界向环境大气散热,这时闭口系统并不绝热,而且向外界放热,由于Q<0,虽然空调器工作时依旧有电功W输入系统,仍然W<0,但按闭口系统能量方程:W Q U −=∆,此时虽然Q与W都是负的,但W Q >,所以∆U<0。
可见室内空气内能将减少,相应地空气温度将降低。
若以空调器为系统,其工作原理如图2.2(b)所示,耗功W连同从室内抽取的热量'Q 一同排放给环境,因而室内温度将降低。
图2.2 例4:如图2.3所示的气缸,其内充以空气。
气缸截面积A=100cm2,活塞距底面高度H=10cm。
活塞及其上重物的总重量Gi=195kg。
当地的大气压力p0=771mmHg,环境温度t0=27℃。
若当气缸内气体与外界处于热力平衡时,把活塞重物取去100kg,活塞将突然上升,最后重新达到热力平衡。
假定活塞和气缸壁之间无摩擦,气体可以通过气缸壁和外界充分换热,试求活塞上升的距离和气体的换热量。
解:(1)确定空气的初始状态参数 p1=1b p +1g p =A G 1=771×13.6×10-4×+100195=3kgf/cm2 或 p1=3×0.98665=2.942bar=294200Pa V1=AH=100×10=1000cm3 T1=273+27=300K (2)确定取去重物后,空气的终止状态参数由于活塞无摩擦,又能充分与外界进行热交换,故当重新达到热力平衡时,气缸内的压力和温度应与外界的压力和温度相等。
则有 p2=2b p +2g p =A G 1=771×13.6×10-4×+100100195−=2kgf/cm2 或 p2=2×0.98665=1.961bar=196100Pa T2=273+27=300K 由理想气体状态方程pV=mRT及T1=T2可得 150019610029420010002112===p p V V cm3 活塞上升距离 ΔH=(V2-V1)/A=(1500-1000)/100=5cm 对外作功量 W12=p2ΔV= p2AΔH=196100(100×5)×10-6=98.06kJ 由热力学第一定律 Q=ΔU+W 由于T1=T2,故U1=U2,即ΔU=0则, Q12=W12=98.06kJ(系统由外界吸入热量) 例5:如图2.4所示,已知气缸内气体p1=2×105Pa,弹簧刚度k=40kN/m,活塞直径D=0.4m,解k L 11=τ=L (1=∆τ=求出W1与H图2.3kJ 58.29]314.0)942.0314.0[(4021)(2122212122211=−+××=−===∫∫L L L L k kLdL dL W τ kJ 84.11118401942.04.041012502==×××=∆=πL A p W W =W1+W2=29.58+11.84=41.42kJ 四 思考与练习:1、气体吸热后体积一定膨胀,热力学能一定增加,是否正确。
2、物质的温度愈高,所具有的热量也愈多,对否? 3、准平衡过程与可逆过程有何区别? 4、对工质加热,其温度反而降低,有否可能5、热力设备没有体积变化,就不能对外输出功,对吗?6、热力学第一定律表达式w du q δδ+=和υδpa du q +=分别适用于什么条件? 7、对空气边压缩边进行冷却,如空气的放热量为1kJ,对空气的压缩功为6kJ,则此过程中空气的温度是升高,还是降低。
8、理想气体的 (c p -c v )以及c p /c v 是否在任何温度下都是常数? 9、利用平均比热容计算所得热量与真实比热容是否一致? 10、讨论下列问题: (1) 气体吸热的过程是否一定是升温的过程。
(2) 气体放热的过程是否一定是降温的过程。
(3) 能否以气体温度的变化量来判断过程中气体是吸热还是放热。
11、试分析下列过程中气体是吸热还是放热(按理想气体可逆过程考虑) (1) 压力递降的定温过程。
(2) 容积递减的定压过程。
(3) 压力和容积均增大两倍的过程。
12、判断下述各过程中热量和功的传递方向(取 选为系统) (1)用打气筒向轮胎充入空气。
轮胎、气筒壁、活塞和联结管都是绝热的,且摩擦损失忽略不计。
(2) 绝热容器中的液体由初始的扰动状态进入静止状态。
(3) 将盛有NH3的刚性容器,通过控制阀门与抽真空的刚性容器相联结,容器、阀门和联结管路都是绝热的。
打开控制阀门后,两个容器中的NH3处于均匀状态。
(4) 将盛有水和水蒸汽的封闭的金属容器加热时,容器内的压力和温度都上升。
(5) 按(4)所述,若加热量超过极限值,致使容器爆破,水和蒸汽爆散到大气中去。
(6) 处于绝热气缸中的液体,当活塞慢慢地向外移动时发生膨胀。
(7) 1kg空气迅速地从大气中流入抽真空的瓶子里,可忽略空气流动中的热传递。
13、绝热容器内盛有一定量空气,外界通过叶桨轮旋转,向空气加入功1kJ,若将空气视为理想气体,试分析 (1) 此过程中空气的温度如何变化。
(2) 此过程中空气的熵有无变化。
如何变化。
(3) 此为绝热过程,根据熵的定义式dS=dQ /T 由于dQ=0,则dS似乎也应为零,即过程中空气的熵不变,你认为此结论对吗。
为什么。
14、开口系统中,流动功究竟属于下面哪一种形式的能量; (1)进、出系统中,流体本身所具有的能量; (2)后面的流体对进、出系统的流体为克服界面阻碍而传递的能量; (3)系统中工质进行状态变化由热能转化来的能量。
15、单位质量气体的系统从初态P1=0.1Mpa,V1=0.2m3压缩至终态P2=0.3Mpa压缩过程满足pv1.2常数。
试求该过程的压缩功。
16、闭口系统经历一热力过程,从外界吸取热量60Kj,同时热力学能增加了100kJ,问此过程是膨胀过程还是压缩过程?17、某闭口系统完成由两个热力过程组成的循环。
在其中的一个热力过程中吸热200kJ,对外作功40Kj,经历另一个热力过程返回原态时,放热80kJ,问该过程功的变化为多少? 18、如图2.5所示,闭口系统中工质沿acb由a状态变化到b状态时,吸热80kJ,对外作功30 kJ。
则(1)工质沿adb由a到达b时对外作功20 kJ,求该过程的换热量;(2)工质沿曲线由b返回a时,外界对系统作功25 kJ,求该过程工质与外界交换的热量;(3)如果Ua=0 kJ,Ud=40 kJ,分别求a-d,d-b过程与外界的换热量。
图2.5 习题2-18题图图2.6 习题2-21图19、采暖用锅炉的水蒸发量为0.5kg/s,明水进入锅炉时的焓h1=60kJ/kg,水蒸气的焓h2=2700kJ/kg,若煤的发热量为2500 kJ/kg,锅炉的热效率η=60%,求锅炉每小时的耗煤量。
20、已知稳定流动的系统进口处的气体参数为h1=3000kJ,c1=150m/h,出口参数为h2=1800kJ,c2=60m/s。
气体的质量流量为4kg/s,流过系统时对外放热量为150kJ/kg,忽略进、出口重力位能的变化。
求气体流过系统时对外输出的轴功率。
21、有一单级蒸汽压缩式制冷循环如图2.6所示进行。
各个设备进行的热力过程如下,1一2为绝热压缩过程,2一3为定压冷却冷凝向外界放热过程,3一4为等焰节流过程,4一1为定压汽化从低温空间吸热过程。
已知:h1=345 kJ/kg,h2=372 kJ/kg,h3=338 kJ/kg,求:(1)压缩过程消耗的轴功w s;(2)向外界的放热量q1;(3)从低温空间的吸热量q2。
22、空气流经电加热器加热。
温度由t1=0℃上升至t2=30℃,假如电加热器的功率为3kW,求空气的流量是多少?(1)以平均比热容计算。
(2)以定值比热容计算。
23、标准状态下1000m3的CO2由t1=20℃加热至t2=300℃。