二氧化锆陶瓷的制备及性能分析
- 格式:doc
- 大小:842.00 KB
- 文档页数:20
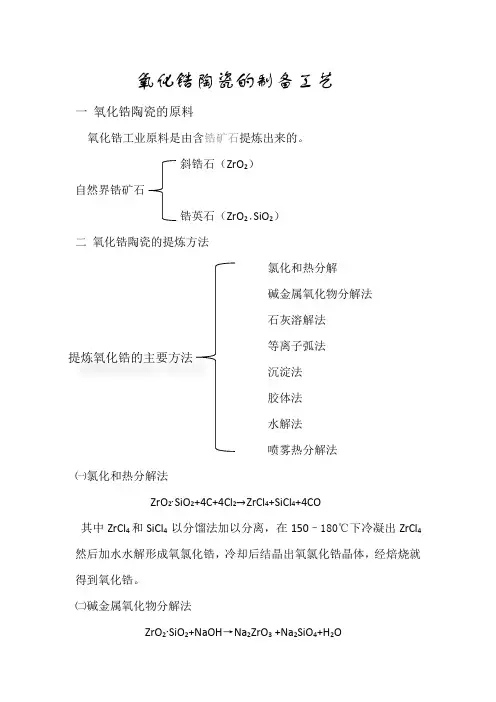
氧化锆陶瓷的制备工艺一氧化锆陶瓷的原料氧化锆工业原料是由含锆矿石提炼出来的。
斜锆石(ZrO2)自然界锆矿石锆英石(ZrO2·SiO2)二氧化锆陶瓷的提炼方法氯化和热分解碱金属氧化物分解法石灰溶解法等离子弧法提炼氧化锆的主要方法沉淀法胶体法水解法喷雾热分解法㈠氯化和热分解法ZrO2∙SiO2+4C+4Cl2→ZrCl4+SiCl4+4CO其中ZrCl4和SiCl4 以分馏法加以分离,在150–180℃下冷凝出ZrCl4然后加水水解形成氧氯化锆,冷却后结晶出氧氯化锆晶体,经焙烧就得到氧化锆。
㈡碱金属氧化物分解法ZrO2∙SiO2+NaOH→Na2ZrO3 +Na2SiO4+H2OZrO 2∙SiO 2+Na 2CO 3→Na 2ZrSiO 3+CO 2 ZrO 2∙SiO 2+Na 2C03→Na 2ZrO 3+Na 2Si03+CO 2①反应后用水溶解,滤去Na 2Si03;②Na 2Zr03→ 水合氢氧化物 → 用硫酸进行钝化 →Zr 5O 8(SO 4)2·x H 20 → 氧化锆粉 ㈢石灰熔融法CaO+ZrO 2·SiO 2→ZrO 2+CaSiO 3 焙烧后用盐酸浸出除去CaSiO3 ㈣等离子弧法锆英石砂(ZrO 2∙SiO 2)㈤沉淀法沉淀法是在羧基氯化锆等水溶性锆盐与稳定剂盐的混合水溶液中加入氨水等碱性类物质,以获得氢氧化物共沉淀的方法。
将共沉淀物干焙烧氨 水 调 整 PH 值用水水解ZrO2SiO2注入高温等离子弧中熔化并离解凝固后SiO 2粘在ZrO 2结晶表面 用液体NaOH 煮沸可除SiO 2ZrO 2 和 硅酸铀 氧化锆洗 涤燥后一般得到的是胶态非晶体,经500—700℃左右焙烧而制成ZrO 2粉末。
㈥胶体法胶体法是合成粉体中各种前驱体在溶胶状态下混合均匀,而后固体从溶胶中析出的方法。
溶胶法① 溶胶—凝胶技术 ② 溶胶—沉淀法金属氧化物或氢氧化物的溶胶 胶体沉淀剂(在锆盐溶液中加有机化合物)凝 胶氧化物㈦水解法①醇盐水解法:将有机溶液中混合着锆和稳定剂的醇盐,进行加水分解的方法。


《放电等离子烧结氧化锆陶瓷的制备及性能研究》篇一一、引言随着科技的不断进步,陶瓷材料在许多领域中的应用日益广泛。
其中,氧化锆陶瓷因其独特的物理和化学性质,在电子、医疗、机械等领域中具有广泛的应用前景。
放电等离子烧结技术作为一种新型的陶瓷制备技术,具有烧结温度低、烧结时间短、产品性能优异等优点,因此被广泛应用于氧化锆陶瓷的制备。
本文将重点研究放电等离子烧结氧化锆陶瓷的制备过程及其性能表现。
二、制备方法放电等离子烧结氧化锆陶瓷的制备过程主要包括原料准备、混合、成型、放电等离子烧结等步骤。
1. 原料准备:选用高纯度的氧化锆粉末作为原料,经过筛选、研磨等处理,以获得粒度均匀的粉末。
2. 混合:将氧化锆粉末与适量的添加剂进行混合,以提高其烧结性能。
3. 成型:将混合后的粉末进行压制成型,获得所需形状的坯体。
4. 放电等离子烧结:将成型后的坯体放入烧结炉中,在放电等离子环境下进行烧结。
烧结过程中,通过控制温度、压力、气氛等参数,使氧化锆粉末在较低的温度下完成致密化过程。
三、性能研究放电等离子烧结氧化锆陶瓷的性能表现主要从以下几个方面进行研究:1. 密度与孔隙率:通过测量氧化锆陶瓷的密度和孔隙率,可以了解其致密程度和内部结构。
放电等离子烧结技术可以在较低的温度下实现致密化,从而获得高密度的氧化锆陶瓷。
2. 力学性能:包括硬度、抗弯强度、抗压强度等。
放电等离子烧结技术制备的氧化锆陶瓷具有优异的力学性能,可满足不同领域的应用需求。
3. 光学性能:氧化锆陶瓷具有优异的光学透过性,其在光学领域的应用日益广泛。
通过研究放电等离子烧结技术对氧化锆陶瓷光学性能的影响,可以为其在光学领域的应用提供理论依据。
4. 热稳定性:通过测量氧化锆陶瓷在不同温度下的性能变化,可以评估其热稳定性。
放电等离子烧结技术制备的氧化锆陶瓷具有良好的热稳定性,可在高温环境下保持优异的性能。
5. 微观结构与相组成:通过扫描电镜、X射线衍射等手段,观察放电等离子烧结氧化锆陶瓷的微观结构和相组成。

二氧化锆工作原理随着科技的发展,二氧化锆作为一种重要的高科技材料得到了广泛应用。
本文将从材料基础、制备方法和工作原理三个方面来探讨二氧化锆的工作原理。
一、材料基础二氧化锆(ZrO2)是一种具有高硬度、高熔点和高热稳定性的陶瓷材料。
它的分子结构是立方晶系的,在结构中每个Zr原子周围有8个氧原子,每个O原子周围有4个Zr原子。
这种晶体结构使得二氧化锆具有优良的机械、热学和电学性能。
二、制备方法二氧化锆的制备方法主要有两种,一种是化学法,另一种是物理法。
化学法制备二氧化锆的过程是先将锆矿石进行粉碎和浸出,得到锆盐溶液,再通过化学还原、水解、沉淀和焙烧等步骤,最终得到纯度较高的二氧化锆粉末。
物理法制备二氧化锆的方法有烧结法、凝胶注模法和等离子喷雾法等。
其中,等离子喷雾法是一种新兴的制备方法,可以制备出高纯度、微米级粒径的二氧化锆粉末。
三、工作原理二氧化锆作为材料被广泛应用,最主要的两个应用领域是热障涂层和气体传感器。
在热障涂层领域,二氧化锆的主要作用是提高涂层的热稳定性和力学性能。
通过在金属表面喷涂一层细小的二氧化锆颗粒制成的涂层,可以有效地防止高温气体或液体的侵蚀,从而保护金属表面不受损坏。
在气体传感器领域,二氧化锆的主要作用是测量氧气浓度。
二氧化锆传感器利用二氧化锆与氧气接触时的电学性质变化来测量氧气浓度。
当氧气存在时,二氧化锆表面会出现负电荷,表面电位会下降,导致电子流动,从而产生电信号。
通过测量这个电信号的变化来计算氧气浓度。
综上所述,二氧化锆作为一种高性能陶瓷材料,具有优良的机械、热学和电学性能,广泛应用于热障涂层和气体传感器等领域。
在制备二氧化锆时,常用的方法有化学法和物理法。
而二氧化锆的工作原理则是通过其在不同领域的应用实现的。

共沉淀法制备稳定⼆氧化锆粉体⼯艺简介⼆氧化锆具有多晶型的相结构,随温度变化产⽣不同的晶相,低温为单斜相(m-ZrO2),⾼温为四⽅相(t-ZrO2),更
⾼温度为⽴⽅相(c-ZrO2)。
由于晶相转变引起体积效应变化很⼤,容易造成耐磨陶瓷衬板、耐磨陶瓷管道龟裂,所以ZrO2必须经稳定化处理,改变相的性质,稳定相结构,才能在特种陶瓷⾏业应⽤。
为稳定ZrO2的晶型结构,需要在ZrO2体系中加⼊离⼦半径与Zr相近、性质相似的物质作稳定剂,常见的有Y2O3、
CeO2、CaO等。
部分稳定氧化锆具有增韧的特性,是结构陶瓷的重要材料。
⽬前制备稳定⼆氧化锆粉体最常见的⼯艺是共沉淀法。
共沉淀法是在氧氯化锆(ZrOCl2•8H2O)和稳定剂(⼀般为YCl3)的⽔溶液混合物中加⼊氨⽔(NH3•H2O)等碱性物,以获得两者氢氧化物的共沉淀产物。
沉淀物经洗涤、⼲燥得到胶态⾮晶体,于⼀定温度下煅烧成粉末。
在共沉淀制备稳定ZrO2的过程中,物料浓度、沉淀pH值、沉淀物洗涤、⼲燥⼯艺和煅烧温度等是影响粉末性能的主要因素。
共沉淀法⼯艺简单、制备的粉末纯度⾼、粉末性能优异,能满⾜绝⼤多数结构陶瓷的⽣产,故此法应⽤⼴泛。
但该法最⼤的缺点是反应过程中易产⽣团聚,制备的粉末分散性较差。
为避免粉末团聚,制备过程中需要加⼊相应的表⾯活性剂来改善和控制粉末的分散性和粒径。

二氧化锆陶瓷的制备及性能分析二氧化锆陶瓷(ZrO2)是一种重要的结构材料,具有高温稳定性、优异的机械性能和优良的化学稳定性,因此在许多应用领域具有广泛的应用前景,如热障涂层、高温结构材料、生物医学材料等。
本文将介绍二氧化锆陶瓷的制备方法以及其性能分析。
二氧化锆陶瓷的制备方法主要包括固相反应法、水热法和溶胶-凝胶法等。
固相反应法是最常用的方法之一,其步骤主要包括将适当比例的锆粉和稳定剂混合、研磨混合均匀之后,在高温(约1300-1600℃)下烧结获得锆粉颗粒之间的结合,形成致密的二氧化锆陶瓷。
水热法则是通过在高温高压的水环境下,将锆盐溶解于水中,经过一系列的化学反应形成二氧化锆的纳米粒子,并在特定的条件下,通过后续的热处理制备得到二氧化锆陶瓷。
溶胶-凝胶法是一种常用的制备纳米颗粒的方法,通过将锆酸醋酸盐等无机盐溶解于溶剂中,得到溶胶,然后通过控制其凝胶过程形成凝胶,最后经过热处理获得二氧化锆陶瓷。
二氧化锆陶瓷的性能分析主要包括物理性能、力学性能和化学性能等。
物理性能主要包括晶体结构和晶型、晶粒大小和分布、密度等。
力学性能主要包括抗压强度、弹性模量和硬度等。
化学性能主要包括化学稳定性和生物相容性等。
在物理性能方面,二氧化锆陶瓷具有良好的热稳定性和机械稳定性,其晶体结构为立方相或四方相,晶粒通常在纳米级别,有利于提高材料的力学性能和化学稳定性。
在力学性能方面,二氧化锆陶瓷具有高抗压强度和硬度,其抗压强度通常在1000-2000MPa之间,硬度在8-12GPa之间。
这使得它适用于各种高强度和高温环境下的应用。
在化学性能方面,二氧化锆陶瓷具有较好的化学稳定性和生物相容性,能够在酸碱环境和生物体内保持稳定。
这使得它在生物医学领域有着广泛的应用,如人工关节、骨修复材料等。
综上所述,二氧化锆陶瓷具有优异的物理性能、力学性能和化学性能,制备方法多样,可以通过调控工艺参数和添加适宜的添加剂来改善其性能。
随着科学技术的进步,二氧化锆陶瓷在材料科学和工程领域的应用前景将更加广阔。

氧化锆陶瓷的制备及性能测试实验方案1.实验原理氧化锆陶瓷是先进陶瓷的一种,具有硬度大、强度高、耐磨性好的优越特点,已广泛运用于国民经济的多个领域,是陶瓷研究中的热点。
在常压下纯ZrO2共有三种晶态:单斜氧化锆(m-ZrO2)、四方氧化锆(t-ZrO2)和立方氧化锆(c-ZrO2),三种晶型存在于不同的温度范围,并可以相互转化。
为了使氧化锆陶瓷具有更加优良的性能,使晶型在一定温度保持稳定,常常需要添加不同类型的稳定剂。
本次实验添加的稳定剂为氧化钇(Y2O3),含量为3 mol %(5.3 wt %),增加氧化锆陶瓷的韧性。
由于氧化锆陶瓷的烧结温度较高,我们可以添加一定的氧化剂,与ZrO2形成固溶体或添加剂参与颗粒的重排,来降低氧化锆陶瓷的烧结温度,同时在烧结过程有利于颗粒生长的细化,改变陶瓷微观结构,使氧化锆陶瓷具有更好的综合性能。
2.实验药品:氧化锆、氧化钇、氧化锌、氧化钙、氧化镁、氧化铝、聚乙烯醇等。
3.主要实验设备:电子天平、球磨机、干燥箱、干压成型机、高温烧结炉、XRD分析仪、分析天平、洛氏硬度计、材料试验机等。
4.实验内容(1)配料:用电子天平称取粉末氧化锆451.0克(90.2 wt %)、氧化钇26.5克(5.3 wt %)、氧化锌5.0克(1.0 wt %)、氧化钙5.0克(1.0 wt %)、氧化镁5.0克(1.0 wt %)、氧化铝2.5克(0.5 wt %)、聚乙烯醇5.0克(1.0 wt %)。
(2)混合:把原料加入球磨罐,按料:球:水=1:2:0.8的比例往球磨罐中加入磨球1000克、水400克,盖好球磨罐塞子。
(3)球磨:把球磨罐放在球磨机上球磨12h。
(4)干燥:把球磨好的原料放在100°C干燥箱中干燥6h。
(5)过筛造粒:将干燥好的原料过筛并进行造粒。
(6)干压成型:在成型机中于一定压力下压制成坯体,得到多个同种形状的陶瓷坯体。
(7)烧结:把陶瓷坯体放在高温炉中进行常压烧结,在1350°C温度下保温2h,升温速率10°C/min。

摘要本文简要介绍目前二氧化锆的制备方法(共沉淀法、溶胶—凝胶法、喷雾热解法、金属有机物水解法、水热法、反向胶团法等),主要以水热法为例,详细介绍其制备过程及步骤,并检测制得二氧化锆的各项性能(红外、XRD)。
本文采用水热法制备氧化钇稳定氧化锆(YSZ )纳米粉术,以Zr 4+和Y 3+的氢氧化物为热前驱体,氢氧化钾和碳酸钾作矿化剂,研究水热处理温度、PH 值和矿化剂浓度对水热合成纳米氧化锆晶型结构的影响。
实验的各项性能结果表明:高的反应温度有利于立方氧化锆的生成,矿化剂的加入对合成产物晶化度和晶粒大小有显著的影响,体系pH 值会影响水热前驱体的结构,进而影响水热合成纳米氧化锆的晶型.在Y 2O 3 掺杂量比较大的时候,PH 值的变化对氧化锆晶型的影响不明显,晶型由掺杂量决定。
在本文中还附有二氧化锆制备步骤及其性能检测的各种实验数据,用到的实验仪器,可操作性强,从而为制备粒度和晶型可控的纳米二氧化锆粉末提供实验依据.关键词: 二氧化锆 制备方法 水热法 性能检测Title Preparation and properties of zirconium dioxide detectionAbstractThis paper introduces the preparation methods of the present zirconia(Coprecipitation、Sol - gel method、Spray pyrolysis、Hydrolysis of metal organic、Hydrothermal、Reverse micelles and so on). Case Study of the main hydrothermal. Details of their preparation process and steps,and detection system was the performance of zirconia (XRD). In this paper, hydrothermal yttria stabilized zirconia nano—powder technique to Zr4+ and Y3+in the hydroxide precursor for the heat,potassium hydroxide and potassium carbonate as a mineralizer of hydrothermal treatment temperature,PH value and mineralizer concentration on the hydrothermal synthesis of nano-zirconia crystal structure。

二氧化锆的性质_用途及其发展方向二氧化锆是化学式为ZrO2的无机化合物,是一种白色晶体固体,具有高熔点、高热导率、低热膨胀系数、高硬度和良好的化学稳定性等特点,因此具有广泛的应用前景和较高的经济价值。
下面将分别从性质、用途以及发展方向三个方面进行详细介绍。
一、性质:1.物理性质:二氧化锆的结构为立方晶系,具有高密度(5.68 g/cm³),高熔点(约2700℃),高热导率和低热膨胀系数等特点。
它的热膨胀系数相对较小,使得该材料在高温环境下具有较好的稳定性,可以作为结构材料使用。
此外,二氧化锆具有优良的热导电性能,使其在高温环境下能够有效地传递热量,因此被广泛应用于高温热导障碍材料、导热介质等领域。
2.化学性质:二氧化锆具有良好的化学稳定性,不溶于常见的无机酸和强碱,能够在高温和腐蚀性环境下保持较好的稳定性。
这使得它成为一种重要的耐腐蚀材料,并被广泛用于化工、医药、电子器件等领域。
此外,二氧化锆还具有良好的热电性能和较低的电阻率,因此也用于制备高温自恢复保险丝等电子器件。
二、用途:1.陶瓷材料:由于二氧化锆具有高硬度、耐磨性和优异的耐热性能,因此广泛应用于陶瓷领域。
它可以用于制作高硬度陶瓷刀具、齿科材料、陶瓷轴承、陶瓷喷嘴等。
此外,二氧化锆还可以作为陶瓷颜料,制备出色彩鲜艳、稳定性好的陶瓷产品。
2.光学材料:由于二氧化锆具有优良的透光性和高折射率,因此可用于制备光学材料。
二氧化锆的高折射率使其在制备光学棱镜、光学透镜、光学窗口和光学反射镜等方面具有广泛的应用。
此外,由于其在紫外、可见光和红外波段均有较好的透光性能,因此也用于制备红外窗口、激光器等领域。
3.电子材料:由于二氧化锆具有良好的热电性能和较低的电阻率,因此被广泛用于制备电子材料。
它可以作为高温自恢复保险丝的基板材料、高温电容器的介电材料和高温传感器的传感材料等。
4.化工材料:由于二氧化锆具有优良的耐腐蚀性能,因此被广泛应用于化工领域作为耐酸碱介质的工业装备。

二氧化锆陶瓷的加工技术二氧化锆材料的加工技术姓名:罗乔学号:510011593摘要陶瓷材料种类很多,它具有熔点高、硬度高,化学稳定性高、耐高温、耐磨损、耐氧化、耐腐蚀,以及弹性模量大、强度高等优良性质。
也正是由于陶瓷材料的这些性质能决定了它的加工也是和普通的材料有着截然不同的加工方式。
随着现代工业的发展,对于新型材料的需求也越来越多,陶瓷材料在近十几年来得到飞速的发展。
随着它的应用领域越来越广,人们对它的研究也越来越深入。
本文将介绍二氧化锆这种比较典型的特种陶瓷材料(人工合成材料)并对其加工技术进行叙述和探讨在国内陶瓷材料的加工技术水平和发展程度。
关键词:陶瓷材料二氧化锆激光加工磨料水射流铣削加工金刚石套料钻ABSTRACTThere is so many kinds of Ceramic material.They have the excellent properties.Such as the High melting point,High hardness,High Chemical stability, Heat-resistant,Resistant to wear,Resistance to oxidation,Corrosion resisting,High Elastic modulus,High strength and so on.Because of these properties , its processing is also with ordinary materials a totally different processing methods.With the development of modern industry,The demand for new materials will be more and more.Ceramic materials get rapid development in recent decade.Along with its application field more and more widely, people have studied it also more and more deeply.This paper will introduce alumina and zro2 which is Synthetic material and its processing technology description and explore the domestic ceramic materials processing techniques and development degree.KEY WORD : Ceramic materials zirconium dioxide Laser processingAbrasive Water technology milling Diamond set of material drill1 材料介绍陶瓷材料种类很多,它具有熔点高、硬度高,化学稳定性高、耐高温、耐磨损、耐氧化、耐腐蚀,以及弹性模量大、强度高等优良性质。
二氧化锆陶瓷的制备及性能分析特种陶瓷综合论文院(部、中心)材料科学与工程学院姓名 x x x 学号 xxx 专业材料科学与工程班级 xx课程名称特种陶瓷材料综合论文设计题目名称氧化锆陶瓷的制备及性能分析起止时间成绩指导教师xxx大学教务处制目录一、氧化锆的基本性质及应用 (3)1.1氧化锆的基本性质 (3)1.2氧化锆的应用 (3)二、氧化锆粉料的制备 (4)2.1常用微粉 (4)2.2 超细粉制备 (4)三、氧化锆陶瓷的成型 (6)3.1 热压铸成型 (6)3.2 干压成型 (6)3.3 等静压成型 (8)3.4注浆成型 (8)3.5流延成型 (8)3.6凝胶注模成型 (9)四、氧化锆陶瓷的烧结 (9)4.1 真空烧结炉 (10)4.2实验室烧结炉............................ 错误!未定义书签。
五、氧化锆陶瓷的性能测试 (1)5.1体积密度、吸水率和气孔率的测定 (1)5.2 抗压强度的测定 (2)5.3 三点抗弯强度 (2)5.4 SEM 测试分析 (2)一、氧化锆的基本性质及应用1.1氧化锆的基本性质 氧化锆是自然界中以斜锆石存在的一种矿物,是一种耐高温、耐磨损、耐腐蚀的无机非金属材料。
它的熔点高达2700摄氏度。
白色重质无定形粉末,无臭、无味。
溶于2份硫酸和1份水的混合液中,微溶于盐酸和硝酸,慢溶于氢氟酸,几乎不溶于水。
有刺激性。
相对密度5.85。
熔点 2680℃。
沸点4300℃。
硬度次于金刚石[1]。
能带间隙大约为5-7eV 。
一般常含有少量的氧化铪。
化学性质不活泼,且高熔点、高电阻率、高折射率和低热膨胀系数的性质,使它成为重要的耐高温材料、陶瓷绝缘材料和陶瓷遮光剂。
纯的ZrO 2在常压下共有三种晶型:从低温到高温一次为单斜相、四方相、和立方相。
氧化锆晶型转变如下:[2] 221170℃2370℃t 2950℃m ZrO ZrO c ZrO --- 1.2氧化锆的应用主要用于压电陶瓷制品、日用陶瓷、耐火材料及贵重金属熔炼用的锆砖、锆管、坩埚等。
化学法二氧化锆生产二氧化锆是一种广泛应用于科学研究和工业生产领域的重要材料。
它具有优良的物理性质和化学性质,因此在诸多领域中发挥着重要的作用。
本文将介绍一种常用的化学法生产二氧化锆的方法,以期为相关研究人员和生产工作者提供参考。
二、主要生产步骤化学法二氧化锆生产的主要步骤包括锆矿选矿、矿石粉碎、矿石焙烧、酸溶解、溶液处理等过程。
2.1 锆矿选矿锆矿是二氧化锆的原始矿石,常见的锆矿有石英脉状锆石、花岗锆石等。
在选矿过程中,通过不同的物理方法,如磁选、重选等,将锆矿中的杂质分离,得到高纯度的锆矿。
2.2 矿石粉碎将选矿得到的锆矿进行粉碎,通常采用球磨机等设备进行机械破碎,直至得到细小的锆矿粉末。
2.3 矿石焙烧将锆矿粉末进行高温焙烧处理,使其产生化学变化,改变其物理性质和结构。
焙烧过程中,锆矿中的杂质会被氧化、挥发等方式去除,得到纯度更高的锆矿。
2.4 酸溶解将焙烧后的锆矿与酸溶液进行反应,溶解出锆离子。
常用的溶液有硫酸、盐酸等。
溶解过程中控制温度、浓度等参数,以获得高效的溶解率。
2.5 溶液处理将溶液进行过滤、沉淀、结晶等处理过程,使得锆离子得以纯化、浓缩。
最终获得纯度较高的二氧化锆产品。
三、工艺优化与控制化学法二氧化锆生产过程中,工艺优化与控制是确保产品质量和生产效率的关键。
通过对各个步骤条件的优化及监测,可以实现二氧化锆的高质量、大规模生产。
3.1 温度控制在矿石焙烧和酸溶解过程中,控制温度的升降速度、维持适宜的温度范围,对于获得理想的产物品质具有重要作用。
3.2 酸浓度控制酸浓度是影响溶解率的重要参数之一。
通过控制酸浓度,可以实现锆矿的高效溶解,并最大程度地去除杂质。
3.3 搅拌速度控制溶解和溶液处理过程中,搅拌速度的控制对于杂质分散、溶解均匀、颗粒沉淀等具有重要作用。
四、产品应用领域二氧化锆广泛应用于陶瓷、涂料、催化剂、功能材料等领域。
其中,以陶瓷领域最为重要,二氧化锆陶瓷具有高硬度、高熔点、优良的耐磨性等特点,广泛应用于航空航天、化工、电子等领域。
二氧化锆和三氧化二铝【文章标题】:从二氧化锆到三氧化二铝:材料科学中两种重要氧化物的探索与应用【文章导语】:二氧化锆和三氧化二铝是两种在材料科学领域中具有重要地位的氧化物。
它们具有晶体结构稳定、机械性能优异和热稳定性高等特点,广泛应用于多个领域。
本文将全面评估二氧化锆和三氧化二铝的性质、制备方法和应用,并深入探讨其在材料科学中的重要作用。
【正文】:一、二氧化锆的性质和制备方法1. 二氧化锆的基本性质二氧化锆(ZrO2)是一种常见的氧化物,具有高熔点、高硬度和低热导率等特点。
它通常以白色结晶形式存在,是一种具有立方晶体结构的材料。
二氧化锆的结构稳定性使得它在高温、高压和腐蚀性环境下具有良好的耐久性。
2. 二氧化锆的制备方法目前,常用的制备二氧化锆的方法有热分解法、水热法和溶胶-凝胶法等。
其中,热分解法是最常见的方法之一,通过在高温下分解氯化锆等化合物来获得纯净的二氧化锆。
水热法和溶胶-凝胶法则是通过在水热或溶液中反应形成纳米颗粒的方式来制备二氧化锆。
二、二氧化锆的应用1. 陶瓷材料领域二氧化锆因其高硬度、高强度和耐腐蚀性,在陶瓷材料领域有广泛应用。
它被用作高温绝缘材料、涂料和耐火材料等。
2. 医疗领域由于二氧化锆具有良好的生物相容性,它在医疗领域中应用广泛。
二氧化锆可以用于制作牙科修复材料、人工关节和植入物等。
三、三氧化二铝的性质和制备方法1. 三氧化二铝的基本性质三氧化二铝(Al2O3)是一种常见的高温稳定氧化物,具有良好的电气绝缘性能、热稳定性和机械强度。
它常以白色或透明的结晶形式存在,具有等轴和片状两种晶体结构。
2. 三氧化二铝的制备方法常见的制备三氧化二铝的方法有热分解法、溶胶-凝胶法和水热法等。
其中,热分解法是最常用的方法之一,通过在高温下蒸发液体铝化合物,从而得到纯净的三氧化二铝。
溶胶-凝胶法则是通过溶解铝盐并形成凝胶,在高温下焙烧来制备三氧化二铝。
四、三氧化二铝的应用1. 电子材料领域三氧化二铝因其良好的电气绝缘性能,被广泛应用于电子材料领域。
二氧化锆光谱纯二氧化锆,化学式为ZrO2,也称作氧化锆,是一种重要的无机化合物。
它具有高熔点、高硬度、高抗磨性、耐腐蚀性和优良的光学性能等特点,在陶瓷、光学镀膜、电子材料等领域有广泛的应用。
本文将从二氧化锆的物理性质、制备方法、应用领域和研究进展等方面介绍二氧化锆的相关知识。
一、物理性质1.组成结构:二氧化锆的化学式为ZrO2,它是一种白色无定形粉末。
在固态中,二氧化锆以立方晶系结晶,晶格常数约为5.15 Å。
2.密度和熔点:二氧化锆的密度为 5.7 g/cm³,熔点高达2700℃,属于高熔点材料之一。
3.硬度:二氧化锆具有优良的硬度,其摩氏硬度大约为8-8.5,接近于金刚石的硬度。
4.光学性能:二氧化锆具有良好的光学性能,其透明波长范围为0.4-3.5 μm,可以用于制备高质量的光学镀膜材料。
5.导电性:二氧化锆是一种非导电材料,其电阻率较高。
二、制备方法二氧化锆可以通过多种方法制备,包括热分解、溶胶-凝胶法、水热合成等。
1.热分解法:将氯化锆或硝酸锆等锆化合物在高温下热分解,得到二氧化锆粉末。
2.溶胶-凝胶法:通过溶胶-凝胶法可以制备得到粒径较小、分散性好的二氧化锆颗粒。
3.水热合成法:将锆盐和氢氧化钠在高温高压下反应,得到二氧化锆的水热合成。
三、应用领域由于二氧化锆具有优良的物理和化学性质,因此在多个领域有着广泛的应用。
1.陶瓷材料:二氧化锆被广泛应用于陶瓷领域,主要用于制备高温结构陶瓷,如高温窑具、炉具、电子陶瓷等。
2.光学材料:由于二氧化锆具有良好的光学性能,可以用于制备镀膜、透镜、玻璃纤维等光学材料。
3.生物医学材料:二氧化锆在生物医学领域有较好的应用前景,可以用于人工关节、人工牙科材料等。
4.电子材料:二氧化锆作为一种绝缘体被广泛应用于电子材料领域,如电容器、集成电路基片等。
5.电解质材料:二氧化锆还可以作为固态氧化物燃料电池的电解质材料,用于提高燃料电池的性能。
特种陶瓷综合论文院(部、中心)材料科学与工程学院姓名x x x 学号xxx专业材料科学与工程班级xx 课程名称特种陶瓷材料综合论文设计题目名称氧化锆陶瓷的制备及性能分析起止时间成绩指导教师xxx大学教务处制目录一、氧化锆的基本性质及应用 (3)1.1氧化锆的基本性质 (3)1.2氧化锆的应用 (3)二、氧化锆粉料的制备 (4)2.1常用微粉 (4)2.2 超细粉制备 (4)三、氧化锆陶瓷的成型 (6)3.1 热压铸成型 (7)3.2 干压成型 (7)3.3 等静压成型 (9)3.4注浆成型 (10)3.5流延成型 (10)3.6凝胶注模成型 (10)四、氧化锆陶瓷的烧结 (11)4.1 真空烧结炉 (12)4.2实验室烧结炉 (14)五、氧化锆陶瓷的性能测试 (16)5.1体积密度、吸水率和气孔率的测定 (16)5.2 抗压强度的测定 (17)5.3 三点抗弯强度 (17)5.4 SEM 测试分析 (18)一、氧化锆的基本性质及应用1.1氧化锆的基本性质氧化锆是自然界中以斜锆石存在的一种矿物,是一种耐高温、耐磨损、耐腐蚀的无机非金属材料。
它的熔点高达2700摄氏度。
白色重质无定形粉末,无臭、无味。
溶于2份硫酸和1份水的混合液中,微溶于盐酸和硝酸,慢溶于氢氟酸,几乎不溶于水。
有刺激性。
相对密度5.85。
熔点 2680℃。
沸点4300℃。
硬度次于金刚石[1]。
能带间隙大约为5-7eV 。
一般常含有少量的氧化铪。
化学性质不活泼,且高熔点、高电阻率、高折射率和低热膨胀系数的性质,使它成为重要的耐高温材料、陶瓷绝缘材料和陶瓷遮光剂。
纯的ZrO 2在常压下共有三种晶型:从低温到高温一次为单斜相、四方相、和立方相。
氧化锆晶型转变如下:[2] 221170℃2370℃t 2950℃m ZrO ZrO c ZrO ---1.2氧化锆的应用主要用于压电陶瓷制品、日用陶瓷、耐火材料及贵重金属熔炼用的锆砖、锆管、坩埚等。
也用于生产钢及有色金属、光学玻璃和氧化锆纤维。
还用于陶瓷颜料、静电涂料及烤漆[3]。
氧化锆还是一种很优秀的高科技生物材料。
生物相容性好,优于各种金属合金,包括黄金。
氧化锆全瓷牙具有极高的密合性,且对牙龈无刺激、无过敏反应,很适合应用于口腔。
导热性能极低,仅为黄金的十七分之一,更有利于牙髓的保护。
质量轻,密度仅为黄金的四分之一,患者佩戴更舒适。
二、氧化锆粉料的制备氧化锆陶瓷的生产要求制备高纯、分散性能好、粒子超细、粒度分布窄的粉体,氧化锆超细粉末的制备方法很多。
氧化锆的提纯主要有氯化和热分解法、碱金属氧化分解法、石灰熔融法、等离子弧法、沉淀法、胶体法、水解法、喷雾热解法等。
2.1常用微粉目前使用的ZrO 微粉,颗粒尺寸一般在1-88um之间。
工业上生产微粉常用机械研磨法,原理如下:块状原料→粉碎(一般使用流化床气流磨)→磁选→清洗→干燥→筛分→包装。
需要注意的是,在细磨阶段要防止介质对原料的污染,一般研磨介质用ZrO2和ZTA。
2.2 超细粉制备超细粉末的粒径一般为10—100nm之间,由于具有一系列优异的性质(如表面效应、小尺寸效应、量子效应、隧道效应等),目前已经成为高科技的前沿和重点。
ZrO2超细粉末的制备方法很多,包括物理方法和湿化学方法,如化学共沉淀法、水热法、气相沉积法和气相热分解法等。
2.2.1化学共沉淀法a.中和沉淀法利用碱液从氯氧化锆(ZrOC1)盐溶液中沉淀出含水氧化锆:ZrOC12+2NH40H+(n+1)H20=Zr(OH)4·nH20+2NH4C1工艺流程为:ZrOC12·8H20用H2O溶解→用NH4OH溶液中和滴定→过滤→洗涤→100一120ºC干燥→800℃下煅烧lh→ZrO2一般ZrOC12.8H2O浓度可控制在0.25-0.4mol/L;浓度大时,产量大,但固液分离困难。
沉淀容易包裹并吸附杂质。
沉淀PH值在8—9之间为宜,温度可控制在60—80ºC之间,太低时,胶体沉淀体积大,杂质吸附严重,造成过滤、洗涤困难;偏高时。
将使沉淀和溶解这一动态平衡加速,可能使凝胶晶化。
b.水解沉淀法采用长时间的沸腾氯氧化锆溶液使水解生成的氯化氢不断蒸发出去,从而使如下水解反应平衡不断向右移动。
ZrOCl2+(n+3)H2O=Zr(OH)4·nH20+2HC1工艺流程为:Zrocl2•8H2O→沉淀50h→过滤→洗涤→100℃下水解沉淀50h→过滤→洗涤→110-110ºC干燥→粉碎→850℃下煅烧0.5h→ZrO2操作上与中和沉淀法大体相同,只是ZrOCl2浓度应控制小些,一般在0.2~0.3mol/L,此法操作简便,但耗能较大。
c.醇盐水解沉淀法工艺流程为:(液态)(苯作催化剂)→错醇盐合成→过滤除去NHC1→结晶纯化→加水进行水解沉淀→过滤→100~110ºC干燥—→粉碎→85O℃下煅烧0.5h→ZrO2锆醇盐的合成反应和水解反应方程如下:ZrC14+4C3H7OH+4NH3=Zr(OC3H7)4+2NH4C1(苯作催化剂)Zr(OC3H7)4+2H20=ZrO2+4C3H7OH(苯作催化剂)2.2.2水热法在密封的压力容器中(如高压釜),以水或有机溶剂作为反应介质,锆盐作为反应原料,再加入其它前驱反应物。
在这种特殊的物理、化学环境下,粉体的形成经历了一个溶解—结晶过程,制得的ZrO2超细粉末颗粒呈球状或短柱状,粒径为15rim,而且产品纯度高,烧结性能好。
最近将微波技术、超临界干燥技术、反应电极埋弧技术等引入水热制备系统,使水热法超细粉末制备技术有了新的改进和发展。
2.2.3气相沉积法和气相热分解法通过气相反应ZrC14+02=ZrO2+Cl2可制得ZrO2粉。
用此法制得的ZrO2粉纯度高、颗粒细。
用醇盐加热、分解Zr(OR)4(g)=ZrO2+2ROH+烯烃(式中R 表示烷基)。
除以上的ZrO2制备方法之外,还有水热结晶、溶胶一凝胶法、等离子体法和电弧炉法、喷雾干燥等方法。
2.2.4其他方法随着研究的不断深入,一些研究者探索了新的制备超细粉的思路。
如高温喷雾热解法、喷雾感应耦合等离子体法等[12],这些方法利用先进的仪器设备,生产工艺与传统化学制粉工艺截然不同,是将分解、合成、干燥甚至煅烧过程合并在一起的高效方法。
但是这些方法在如何进一步提高传热效率,并在保证细度的前提下,如何扩大产量、降低成本尚需进一步研究探索。
三、氧化锆陶瓷的成型氧化锆陶瓷以其优异的高温物理和力学性能而得到广泛应用,尤其被用于苛刻条件下使用的关键部件。
由于ZrO2的导热性能低、热膨胀系数大,因此ZrO2制品的热稳定性较差。
但采用部分稳定ZrO2原料制得的制品晶型组成的ZrO2原料制得的陶瓷制品的热稳定性最好。
因此制造ZrO2结构陶瓷往往采用部分稳定ZrO2原料而不是全稳定ZrO2原料。
生产ZrO2 结构陶瓷一般用3mo1%Y203稳定的ZrO2超细粉。
ZrO2结构陶瓷的成型方法有:热压铸成型、干压成型和等静压成型、注浆成型、流延成型等。
3.1 热压铸成型对于ZrO2结构陶瓷小型产品或形状复杂的产品。
一般采用热压铸成型方法。
该成型方法比较简单,特别适宜于生产批量大或形状复杂的中小型产品。
但ZrO2热压铸产品排蜡时易出现开裂、变形等缺陷,这是因为ZrO2陶瓷料浆颗粒粒径较小,粉料比表面积大,调制热压铸浆料时,石蜡及油酸的加人量要明显高于其它陶瓷制品,从而造成坯体收缩大,排蜡时易出现开裂、变形等缺陷。
因此调试浆料时,要掌握好石蜡及油酸的加入量和加人方式,设计合理的排蜡烧成曲线及其它相关工艺参数,可以避免上述缺陷的出现。
3.2 干压成型对形状简单、适于干压成型的中小型ZrO2陶瓷产品常采用干压方法成型。
ZrO2 陶瓷干压时出现的常见问题是产品分层,这是因为ZrO2超细粉造粒料的颗粒很细,因而颗粒轻、流动性差,干压成型时容易出现分层现象。
从生产实践中得知,产品分层与成型模具的光洁度和配合情况、成型压力、加压方式、加压速度和保压时间、脱模方式、脱模速度均有关系,下面就上述几方面因素对干压成型的影响分述如下:a.模具的光洁度和配合情况干压成型对模具质量要求较高,首先要求模具硬度达到一定的要求。
由于ZrO2 稳定料的颗粒很细,流动性差,因而对模具的光洁度要求很高,若光洁度达不到要求,则干压时影响料的流动,从而导致分层的出现。
同时,若模具配合不好,间隙大,则由于ZrO2 粉料颗粒细,压制时粉料会从模具间隙中流出,从而造成模具四周的粉料少,这样压制时四周就不能压实,从而会因压力传递不一致而出现分层,故对模具的配合要求较高。
b.成型压力成型压力在ZrO2干压成型过程中是较关键的,压力太小和太大都不能压制出理想的坯体。
压力太小,则烧后产品的密度小,产品收缩大,坯体压实程度不够容易出现分层;而压力太大,坯体也容易出现裂纹、分层和脱模困难等现象。
合适的成型压力需要通过生产实践来摸索。
C.加压方式般干压成型时加压方式有两种,一种是单面加压,另一种是双面加压。
当单面加压时,则直接受压的一端压力大,出现明显的压力梯度,粉料的流动性越差,则坯体内出现的压力差也就越大,越容易出现分层。
双面加压时,坯体两端直接受压,因此两端密度大,中间密度小,其压力梯度的有效传递距离为单面加压的一半,故坯体的密度比单面加压要均匀得多。
因此ZrO2陶瓷干压成型时宜采用双面加压的方式。
d.加压速度和保压时间加压速度和保压时间控制不好也会造成ZrO2坯体出现分层等缺陷。
压模下落的速度应缓慢一些,如加压速度过快,则坯体中气体不易排出,从而导致坯体出现分层,表面致密而中间松散,以及存在气泡等现象。
如保压时间过短,则压力还未传到应有的深度时,外力就已卸掉,这样坯体中气体不易排出,就难以得到较为理想的坯体,会导致坯体出现分层以及存在气泡等现象。
同时保压时间应均匀一致,否则会引起产品厚薄不均,造成废品。
e.脱模方式和脱模速度干压脱模时一般采用工具将坯体从模腔中顶出,脱模速度要均匀缓慢,如不注意会引起坯体开裂。
实践表明脱模时脱模工具要平整,否则会引起坯体受力不均而造成开裂。
总之,干压成型和上述几方面因素都有关系,要成型出理想的坯体,以上各方面都要控制好。
3.3 等静压成型对形状特殊和尺寸大的ZrO2结构陶瓷,需采用等静压成型。
等静压成型的坯体由于各方向所受压力均匀相等,且压力大,因此成型后的坯体密度高,均匀性好,烧成收缩小,不易变形、开裂、分层。
该成型方法可避免干压时易出现的分层,特别是成型较厚的ZrO2制品,干压时极易出现分层,而等静压成型则可避免,因此该成型方法是生产ZrO2制品常用的方法。
但等静压成型后的坯体需要加工,因此会浪费一部分原料,同时由于坯体很硬,加工比较麻烦,且加工速度要求缓慢,否则坯体易发生断裂,生产效率不高。