物质的量浓度计算及溶液配制
- 格式:doc
- 大小:308.00 KB
- 文档页数:10


溶液配制浓度计算公式在化学的奇妙世界里,溶液配制浓度的计算公式就像是一把神奇的钥匙,能帮我们打开一扇又一扇未知的大门。
先来说说什么是溶液配制浓度吧。
比如说,咱在家里冲糖水,糖是溶质,水是溶剂,糖水就是溶液。
而浓度呢,就是溶质在溶液中所占的比例。
溶液配制浓度的计算公式主要有两个:质量浓度 = 溶质质量 / 溶液质量 × 100%;物质的量浓度 = 溶质的物质的量 / 溶液体积(单位:L)。
咱就拿个例子来说吧,有一次我在实验室里配制氯化钠溶液。
我需要配制 500 克质量分数为 10%的氯化钠溶液。
这时候就得用上质量浓度的公式啦。
首先算出溶质氯化钠的质量,500 克 × 10% = 50 克。
然后称出 50 克氯化钠,加到 450 克水中,搅拌均匀,这溶液就配好啦。
在实际应用中,这公式可太有用了。
比如在医疗领域,医生给病人输液时,就得精确配制药物溶液的浓度,要是弄错了,那可不得了。
再比如在工业生产中,像制造化肥、农药啥的,也得严格按照浓度要求来配制溶液,不然生产出来的东西质量就没法保证。
还有啊,我曾经见过一个学生,在做溶液配制浓度的实验时,因为粗心大意,把溶质的质量算错了,结果配制出来的溶液浓度完全不对,实验失败了。
看着他那懊恼的样子,我就告诉他,别着急,慢慢来,仔细点,重新算重新做。
说回这计算公式,咱们在学习和运用的时候,一定要注意单位的统一。
像物质的量浓度里,溶液体积得用升(L)作单位,如果不小心用成毫升(mL),那可就全错啦。
而且,这公式也不是孤立的,它和其他的化学知识都有着千丝万缕的联系。
比如说,通过浓度可以计算出化学反应中各种物质的用量,也能判断化学反应是否进行完全。
总之,溶液配制浓度的计算公式虽然看起来简单,但要真正掌握好、运用好,还得下一番功夫。
咱们得多做练习,多思考,多总结,才能在化学的海洋里畅游无阻。
希望大家都能把这个公式玩得溜溜的,为今后的化学学习打下坚实的基础!。

物质的量浓度计算公式1.溶质的物质的量=溶质的物质的量浓度x溶液的体积n=c·v2.物质的量=微粒数/阿伏伽德罗常数(n=N/Na)3.物质的量=物质的质量/物质的摩尔质量(n=m/M)4.物质的量=气体的体积/气体的摩尔体积(n=V/Vm)5.c=1000ρ(密度) w% / M注:n(mol):物质的量;V(L):物质的体积;M(g/mol):摩尔质量;w%:溶液中溶质的质量分数密度单位:g/cm^36.c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液) 用浓溶液配制稀溶液时使用在稀释溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量不变,即在溶液稀释前后,溶液的物质的量相等。
7.c混·V混=c1·V1+c2·V2+……+cn·Vn(有多少种溶液混合n就为几)8.同温同压时 V1/V2=N1/N2=N1/N2 正比同温同体积 P1/P2=N1/N2=n1/n2 正比同压同物质的量 V1/V2=T1/T2 正比同温同物质的量 V1/V2=P2/P1 反比同体积同物质的量 P1/P2=T1/T2 正比同温同压同体积 m1/m2=Mr1/Mr2=M1/M2 正比同温同压同质量 V1/V2=p1/p2=M2/M1 反比同温同体积同质量 p1/p2=Mr1/Mr2=M2/M1 反比同温同压密度1/密度2=Mr1/Mr2=M1/M2 正比9.n、V、Vm、N、NA、m、M、c的关系n=m/M=N/NA=V/Vm=cVPS:V----体积 p------压强T-----温度 n ------物质的量N ----分子数 Mr----相对分子质量M------摩尔质量 m-----质量c------物质的量浓度9.关于物质的量浓度与质量分数的转化(推导和演化)C=ρ·ω·1000/M其中,C:物质的量浓度(单位mol/L)ω:溶液的密度,(形式为质量分数,<1)ρ:密度,(单位g/mL)M:物质的摩尔质量,(单位g/mol)c=n/Vn(溶质的物质的量)=ω*m(溶液质量)/Mm(溶液质量)=ρ· V溶液的溶质质量=ω(质量分数)·ρ(密度)·V 故,n(溶质的物质的量)=ω·ρ·V / Mc= n/V=(ω·ρ· V /M) / V=ω·ρ· V /M V=ω·ρ/M若密度ρ单位为1000kg/m^3(国际单位)=1 g/cm^3.。

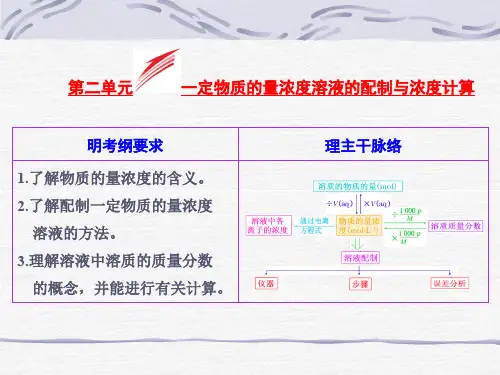
一定物质的量浓度的溶液及其配制目标要求 1.学会溶液配制的基本技能。
2.能运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
1.物质的量浓度(1)定义:单位体积溶液里所含溶质B 的物质的量,叫溶质B 的物质的量浓度。
(2)表达式:c B =n BV 。
(3)单位:mol·L-1或mol/L 。
2.溶质的质量分数(1)定义:用溶质质量与溶液质量之比来表示溶液组成的物理量。
(2)计算公式:w =m 溶质m 溶液×100%。
3.对物质的量浓度表达式的理解 (1)正确判断溶液的溶质并计算其物质的量①与水发生反应生成新的物质,如Na 、Na 2O 、Na 2O 2――→水NaOH ,SO 3――→水H 2SO 4,NO 2――→水HNO 3。
②特殊物质:如NH 3溶于水后溶质为NH 3·H 2O ,但计算浓度时仍以NH 3作为溶质。
③含结晶水的物质:CuSO 4·5H 2O →CuSO 4,Na 2CO 3·10H 2O →Na 2CO 3。
(2)准确计算溶液的体积c =nV 中的V 是溶液的体积,不是溶剂的体积,也不是溶质和溶剂的体积之和,不能用水的体积代替溶液的体积,应根据V =mρ计算。
(1)1 mol·L -1 NaCl 溶液是指此溶液中含有1 mol NaCl( )(2)用100 mL 水吸收0.1 mol HCl 气体所得溶液的物质的量浓度恰好是1 mol·L -1( ) (3)1 L 水中溶解5.85 g NaCl 所形成的溶液的物质的量浓度是0.1 mol·L -1( ) (4)将25 g CuSO 4·5H 2O 晶体溶于75 g 水中所得溶质的质量分数为25%( ) (5)将40 g SO 3溶于60 g 水中所得溶质的质量分数为49%( )(6)31 g Na2O溶于水,配成1 L溶液,c(Na2O)=0.5 mol·L-1()(7)同浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3∶2∶1,则SO2-4浓度之比为3∶2∶3()(8)0.5 mol·L-1的稀H2SO4溶液中[H+]为1.0 mol·L-1()答案(1)×(2)×(3)×(4)×(5)√(6)×(7)×(8)√1.(1)1.204×1024个氯化氢分子溶于水配成 1 L溶液,则溶液中溶质的物质的量浓度为__________。






物质的量浓度及其计算1. 公式法:当已知溶质的摩尔质量(Molar mass,M)和溶质的质量(m)时,可以使用公式C = m/MV来计算物质的量浓度C。
其中,V是溶液的体积。
这个公式可以用于溶液泄漏或加入了溶质的溶液中。
举个例子,假设我们有一个溶液的体积为500毫升,其中含有5克的NaCl(摩尔质量为58.44 g/mol)。
首先,将溶质质量转换为摩尔数:n = m/M = 5 g / 58.44 g/mol ≈ 0.086 mol然后,将摩尔数除以溶液体积:C = n/V = 0.086 mol / 0.5 L ≈ 0.172 mol/L = 0.172 M所以,此溶液的物质的量浓度C为0.172M。
2.滴定法:滴定法是一种常用的确定物质的量浓度的方法,主要用于分析化学中。
滴定法的基本原理是通过一种化学反应来确定溶液中特定物质的浓度。
例如,假设我们需要确定一溶液中硫酸(H2SO4)的物质的量浓度。
我们可以用一种浓度已知的碱溶液(如氢氧化钠溶液)来与硫酸反应并达到化学计量反应,从而确定硫酸的物质的量浓度。
具体做法如下:首先,取一定体积的浓硫酸溶液(V1)放入滴定瓶中,加入适量的指示剂(如酚酞或溴酚蓝)进行标记。
然后,使用滴定管以滴定液的方式加入标有浓度的碱溶液(V2)直到出现颜色变化。
此时,根据滴定液的体积(V2)和已知的浓度,可以计算出硫酸溶液的物质的量浓度。
以上是物质的量浓度的计算方法。
需要注意的是,在实际测量过程中,应根据实际需求选择不同的计算方法,并注意所有参数的单位一致性。
此外,物质的量浓度在化学实验、工业生产和医学等领域具有重要应用。
通过确定物质的量浓度,我们可以了解溶液的浓度程度,从而控制反应的速率、优化工艺参数或计算药物的剂量等。
因此,准确计算物质的量浓度对于实验结果和工程过程的正确性非常重要。
溶液的化学浓度的计算和稀释实验的设计溶液的化学浓度的计算和稀释实验的设计是化学实验中的重要内容,掌握这一部分知识对于理解化学反应的机理和结果具有重要意义。
一、溶液的化学浓度的计算1.物质的量浓度:表示溶液中溶质的物质的量与溶液体积的比值,单位为mol/L。
计算公式为:c = n/V,其中c为物质的量浓度,n为溶质的物质的量,V为溶液的体积。
2.质量浓度:表示溶液中溶质的质量与溶液体积的比值,单位为g/L。
计算公式为:ρ = m/V,其中ρ为质量浓度,m为溶质的质量,V为溶液的体积。
3.摩尔质量:表示物质的摩尔质量,单位为g/mol。
对于有机物,摩尔质量可通过分子量计算得出;对于无机物,可通过元素周期表查找。
4.溶液的稀释:溶液的稀释是指在保持溶质物质的量不变的情况下,增加溶剂的体积,从而降低溶液的物质的量浓度。
稀释公式为:c1V1 = c2V2,其中c1为原溶液的物质的量浓度,V1为原溶液的体积,c2为稀释后溶液的物质的量浓度,V2为稀释后溶液的体积。
二、稀释实验的设计1.确定实验目的:明确实验目的,如测定一定体积的溶液的物质的量浓度,或制备一定浓度的溶液。
2.选择合适的实验仪器:根据实验需求,选择合适的容量瓶、烧杯、玻璃棒、胶头滴管等实验仪器。
3.计算所需溶质的物质的量:根据实验目的,计算所需溶质的物质的量。
4.称量溶质:使用天平准确称量所需溶质的质量。
5.配制溶液:将溶质加入烧杯中,加入少量溶剂,用玻璃棒搅拌至溶解,然后转移到容量瓶中,定容至刻度线。
6.标记溶液:在容量瓶上贴上标签,注明溶液的名称、浓度、配制日期等。
7.验证溶液浓度:通过滴定实验、光谱分析等方法验证所配制溶液的浓度是否符合预期。
通过以上知识点的学习和实验操作,学生可以掌握溶液的化学浓度的计算方法,以及如何设计稀释实验,为后续的化学学习打下坚实基础。
习题及方法:1.习题:已知某溶液的物质的量浓度为0.1 mol/L,体积为100 mL,求该溶液中溶质的物质的量。
课时作业(二)物质的量浓度计算及溶液配制1.(2019山东泰安期中)室温时,甲、乙两同学在实验室配制氯化钠溶液。
甲同学配制5%的NaCl 溶液100 g ,乙同学配制0.5 mol·L -1的NaCl 溶液100 mL(20 ℃时,氯化钠在水中的溶解度为36 g/100 g 水)。
下列说法正确的是( )A .两同学所需溶质的质量相同B .两同学所需实验仪器种类相同C .两同学所配溶液均为不饱和溶液D .两同学所配溶液的质量相同答案:C 解析:甲同学所配溶液中溶质的质量为100 g ×5%=5 g ,乙同学所配溶液中溶质的质量为0.5 mol·L -1×0.1 L ×58.5 g·mol -1=2.925 g ,A 项错误;乙同学配制溶液过程中需要用到容量瓶,而甲同学不需要,B 项错误;由A 项中的计算结果及题目所给氯化钠溶液的溶解度可知,两同学配制的溶液均为不饱和溶液,C 项正确;100 mL 氯化钠溶液的质量大于100 g ,D 项错误。
2.(2019陕西西安一中二模)把200 mL NH 4HCO 3和Na 2CO 3的混合溶液分成两等份,取一份加入含a mol NaOH 的溶液,恰好反应完全;取另一份加入含b mol HCl 的盐酸,也恰好反应完全。
该混合溶液中c (Na +)为 ( )A .(10b -5a )mol·L -1B .(2b -a )mol·L -1 C.⎝ ⎛⎭⎪⎫b 10-a 20mol·L -1 D .⎝ ⎛⎭⎪⎫5b -5a 2mol·L -1 答案:A 解析:200 mL 的混合溶液分成两等份,每份溶液的体积为100 mL ,其中一份溶液中的NH 4HCO 3和a mol NaOH 恰好完全反应,则溶液中NH 4HCO 3的物质的量为0.5a mol ,取另一份溶液加入含b mol HCl 的盐酸,也恰好反应完全,其中NH 4HCO 3反应掉的HCl 的物质的量为0.5a mol ,则由Na 2CO 3反应掉的HCl 的物质的量为(b -0.5a )mol ,可得Na 2CO 3的物质的量为12×(b -0.5a )mol ,则200 mL溶液中Na2CO3的物质的量为(b-0.5a)mol,则c(Na+)=(b-0.5a)×2 mol0.2 L=(10b-5a)mol·L-1。
3.(2019安徽蒙城一中等五校联考)20 ℃时,饱和NaCl溶液的密度为1.1 g·cm -3,物质的量浓度为5.0 mol·L-1,下列说法不正确的是() A.25 ℃时,饱和NaCl溶液的物质的量浓度大于5.0 mol·L-1B.20 ℃时,饱和NaCl溶液中溶质的质量分数约为26.6%C.20 ℃时,密度小于1.1 g·cm-3的NaCl溶液是不饱和溶液D.将此饱和NaCl溶液蒸发掉部分水,再恢复到20 ℃时,溶液密度一定大于1.1 g·cm-3答案:D解析:NaCl的溶解度随温度的升高而增大,所以其饱和溶液的物质的量浓度也会增大,则25 ℃时,饱和NaCl溶液的物质的量浓度大于5.0 mol·L -1,A正确;设溶液的体积为1 L,则溶液的质量为1.1 g·mL-1×1 000 mL=1 100 g,溶质的物质的量为1 L×5.0 mol·L-1=5 mol,溶质的质量为5 mol×58.5 g·mol-1=292.5 g,所以溶质的质量分数为292.51 100×100%≈26.6%,B正确;NaCl溶液的浓度越大,密度越大,20 ℃时,密度为1.1 g·cm-3的溶液是饱和溶液,则20 ℃时,密度小于1.1 g·cm-3的NaCl溶液是不饱和溶液,C正确;若将饱和NaCl 溶液蒸发,则有NaCl晶体析出,再恢复到20 ℃时,其溶解度不变,溶液仍为饱和溶液,密度仍为1.1 g·cm-3,D错误。
4.(2019重庆十一中月考)实验室欲配制100 mL 1.0 mol·L-1 Na2CO3溶液,下列操作正确的是()A.用托盘天平称量10.6 g Na2CO3·10H2O,倒入烧杯中加适量的水溶解B.当烧杯中固体全部溶解后,立即用玻璃棒引流转移至容量瓶中C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分D.若配制时,俯视刻度线定容,则所配溶液的浓度偏高,需再补加少量蒸馏水至刻度线答案:D 解析:实验室欲配制100 mL 1.0 mol·L -1 Na 2CO 3溶液,需称量Na 2CO 3·10H 2O 的质量为0.1 L ×1.0 mol·L -1×286 g·mol -1=28.6 g ,A 项错误;固体溶解后需先冷却至室温,然后进行移液操作,B 项错误;定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分会导致溶质的物质的量减小,从而使所配溶液的浓度偏低,C 项错误;若配制时,俯视刻度线定容,则会使溶液体积偏小,从而导致所配溶液的浓度偏高,定容时需平视刻度线,故应再加水至凹液面与刻度线水平相切,D 项正确。
5.(2019华中师范大学附中期中)水合物的化学式为R·n H 2O ,其式量为M 。
25 ℃时,将a g 该晶体溶于b g 水中可形成V mL 饱和溶液,下列关系中正确的是( )A .饱和溶液的物质的量浓度为c =1 000a (M -18n )M ×V mol·L -1 B .25 ℃时R 的溶解度为S =a (M -18n )M ×bg C .饱和溶液中溶质的质量分数为w =100a (M -18n )M (a +b )% D .饱和溶液的密度为ρ=a (M -18n )a +bg·L -1 答案:C 解析:n (R)=n (R·n H 2O)=a M mol ,该饱和溶液的物质的量浓度=a M gV ×10-3 L=1 000a MV mol/L ,故A 错误;R 的质量为M -18n M ×a g ,结晶水的质量为18n M ×a g ,则100 g ∶S =⎝ ⎛⎭⎪⎫18n M ×a g +b g ∶⎝ ⎛⎭⎪⎫M -18n M ×a g ,解得S =100a (M -18n )18na +bM g ,故B 错误;根据w (溶质)=m (溶质)m (溶液)×100%,可知该饱和溶液质量分数为M -18n M ×a g a g +b g×100%,故C 正确;溶液总质量为(a +b )g ,根据ρ=m V 可知,溶液密度为(a +b ) g V mL =a +b V g/mL ,利用c =1 000ρωM 可知,密度ρ=cM 1 000w=1 000a MV ×M ÷[1 000×100a (M -18n )M (a +b )%] g/mL =M (a +b )V (M -18n )g/mL ,故D 错误,故选C 。
6.(2019福建三校联考)关于水中溶解了22.4 L HCl 气体(标准状况下测得)后形成的溶液200 mL ,下列说法中正确的是( )A .该溶液物质的量浓度为10 mol/LB .所用水的体积为177.6 LC .根据题干数据,该溶液物质的量浓度无法求得D .该溶液中溶质的质量分数因溶液的密度未知而无法求得答案:D 解析:标准状况下22.4 L HCl 的物质的量为22.4 L 22.4 L/mol =1 mol ,溶于水配成200 mL 溶液,溶液的浓度为c (HCl)=1 mol 0.2 L =5 mol/L ,故A 错误;溶液体积≠溶质体积+溶剂体积,不能用总溶液体积-溶质体积计算溶剂体积,故B 错误;标准状况下22.4 L HCl 的物质的量为1 mol ,溶液体积为0.2 L ,可以计算出溶液的物质的量浓度,故C 错误;溶液密度不知,无法计算溶液质量,则无法计算溶液的质量分数,故D 正确。
7.(2019潍坊一中段考)将50 g 质量分数为w 1,物质的量浓度为c 1的浓硫酸沿玻璃棒加入到V mL 水中,稀释后得到质量分数为w 2,物质的量浓度为c 2的稀溶液,下列说法中正确的是( )A .若c 1=2c 2,则w 1<2w 2,V <50 mLB .若c 1=2c 2,则w 1<2w 2,V >50 mLC .若w 1=2w 2,则c 1<2c 2,V =50 mLD .若w 1=2w 2,则c 1>2c 2,V <50 mL答案:A 解析:若c 1=2c 2,设物质的量浓度为c 1 mol·L -1浓硫酸的密度为ρ1,物质的量浓度为c 2 mol·L -1硫酸溶液的密度为ρ2,则w 1=98c 11 000ρ1,w 2=98c 21 000ρ2,所以w 1w 2=c 1ρ2c 2ρ1=2ρ2ρ1,浓硫酸的浓度越大密度越大,则ρ1>ρ2,故w 1<2w 2,稀释前后溶质的质量不变,所以稀释后溶液的质量小于100 g ,故水的质量小于50 g ,水的密度为1 g/mL ,所以水的体积V <50 mL ,故A 正确;由A 分析可知,水的体积V <50 mL ,w 1<2w 2,故B 错误;稀释前后溶质的质量不变,若w 1=2w 2,则稀释后溶液的质量为100 g ,所以水的质量为50 g ,水的密度为1 g/mL ,所以水的体积V =50 mL ;设物质的量浓度为c 1 mol·L -1浓硫酸的密度为ρ1,物质的量浓度为c 2 mol·L -1硫酸溶液的密度为ρ2,则:c 1=1 000ρ1w 198,c 2=1 000ρ2w 298,所以c 1c 2=ρ1w 1ρ2w 2=2ρ1ρ2,浓硫酸的浓度越大密度越大,则ρ1>ρ2,故c 1>2c 2,故C 错误;由C 中分析可知,水的体积V =50 mL ,c 1>2c 2,故D 错误。
8.(2019济南摸底)如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此下列说法正确的是( ) 硫酸 化学纯(CP )(500 mL )品名:硫酸化学式:H 2SO 4相对分子质量:98密度:1.84 g/cm 3质量分数:98%A .该试剂的物质的量浓度为9.2 mol·L -1B .该50 mL 硫酸与足量的铜反应可得到标准状况下SO 2 10.3 LC .配制50 mL 4.6 mol·L -1的稀硫酸需取该硫酸12.5 mLD .该硫酸与等体积的水混合所得溶液的质量分数小于49%答案:C 解析:该硫酸的物质的量浓度为1 000×1.84×98%98mol/L =18.4 mol/L ,故A 错误;金属铜和浓硫酸的反应,随着反应的进行,该硫酸变稀,金属铜和稀硫酸之间不反应,所以50 mL 硫酸与足量的铜反应可得到标准状况下SO 2的体积小于10.3 L ,故B 错误;设配制50 mL 4.6 mol·L -1的稀硫酸需取该硫酸的体积为x L ,根据溶液稀释前后溶质的物质的量不变可知,0.05 L ×4.6 mol/L =x ×18.4 mol/L ,解得x =0.012 5 L =12.5 mL ,故C 正确;等体积混合,设体积分别为V mL,98%的H 2SO 4溶液密度为ρ1,水密度为ρ2,则混合后溶液的质量分数为w (H 2SO 4)=Vρ1×98%Vρ1+Vρ2=ρ1×98%ρ1+ρ2,因硫酸的密度大于水的密度,则ρ1>ρ2,所以w =ρ1×98%ρ1+ρ2>49%,故D 错误;故选C 。