物质的量浓度及配制
- 格式:ppt
- 大小:3.40 MB
- 文档页数:34




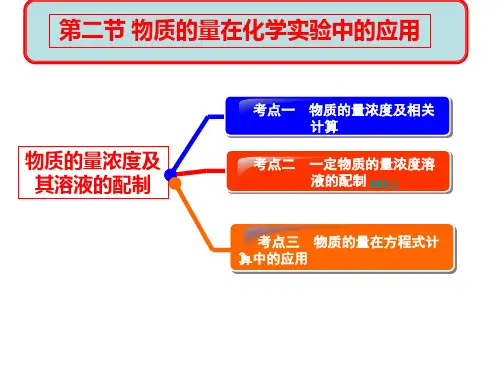

液中Cl-、SO42+、Al3+的物质的量浓度(设溶液体积变化忽略不计)2、C(B)和ω的比较与换算物质的量浓度溶质的质量分数概念以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量溶质B的质量与溶液质量之比表达式单位无单位特点溶液体积相同,CB相同的任何溶液中,所含n(溶质)_____但m(溶质)————————溶液的质量相同,溶质的质量分数也相同的任何溶液,所含溶质的质量,但物质的量——————物质的量浓度C(B)与质量分数ω的换算已知:某溶液中溶质的质量分数ω为溶液的密度为ρ(g/mL),溶质的摩尔质量为M(g/mol)则该溶液的物质的量浓度c=练习:1、计算HCl的质量分数为37%,密度为1.19 g/cm3的盐酸中HCl的物质的量浓度?2、市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3.计算市售浓硫酸中H2SO4的物质的量浓度3、常温下,在28.9g水中溶解12.1gCu(N03)2.3H2O,恰好达到饱和设该溶液密度为1.20g\cm3,求:(1)该溶液中Cu(N03)2.3H2O的物质的量(2)溶液的体积(3)该溶液中Cu(N03)2的物质的量浓度(4)取出20.0ml该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少?二、一定物质的量浓度溶液的配制1 配制溶液的实验仪器2、配制溶液的步骤计算---称量---溶解---转移(移液)----洗涤---振荡---定容---摇匀欲配制1 mol/L的氢氧化钠溶液250mL,步骤:①用天平称取氢氧化钠固体克。
②将称好的氢氧化钠固体放入中9.定容时俯视刻度线10.定容时仰视刻度线例1、误差分析:根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请将C 的结果填入表中)引起误差的操作m c V称取时间过长或用滤纸称放向容量瓶注液时少量流出未洗净烧杯或玻璃棒未冷却至室温而注入定容定容时加水过量用吸管吸出定容时仰视标线定容时俯视标线定容摇匀后液面下降又加水定容摇匀后,液面下降例2、欲配制250mL 1mol/L 稀硫酸,用量筒量取mL98%密度为1.84g/cm3的浓硫酸,再用取蒸馏水. 将缓慢注入到中,并用不断搅拌,待溶液后,将溶液沿玻璃棒移入中,用少量蒸馏水洗涤和2-3次,将洗涤液移入中。

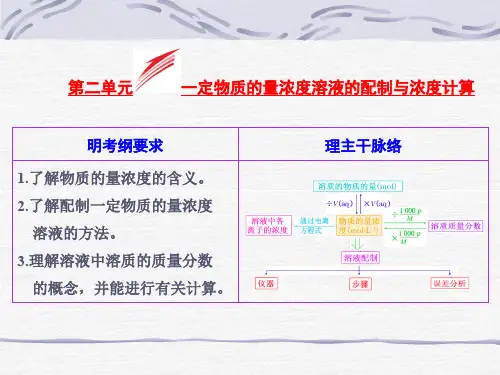

《物质的量浓度及溶液的配制》教学设计教学设计:物质的量浓度及溶液的配制一、教学目标1.理解物质的量浓度的概念,学会计算物质的量浓度。
2.理解溶液的配制的原理,学会根据要求配制溶液。
二、教学内容1.物质的量浓度的概念和计算方法。
2.溶液的配制原理和方法。
三、教学步骤第一步:导入(10分钟)1.引导学生回顾溶液的定义和性质。
2.提问:你以前听说过物质的量浓度吗?你们知道物质的量浓度是什么吗?第二步:讲解物质的量浓度(30分钟)1.引导学生通过实例思考物质的量浓度的定义。
2. 讲解物质的量浓度(C)的定义:C = n/V,单位为mol/L。
3.指导学生通过示例计算物质的量浓度,并强调计算中需要注意的问题。
第三步:物质的量浓度练习(30分钟)1.给学生分发练习题目,并要求学生完成计算物质的量浓度的练习。
2.指导学生在计算中注意保留有效数字,并帮助学生纠正常见错误。
3.解答学生的疑问,并对错误的计算过程进行指正。
第四步:讲解溶液的配制(30分钟)1.引导学生回顾溶液的定义和性质。
2.讲解溶液的配制的原理和步骤。
3.引导学生通过实例理解溶液的配制,并要求学生根据要求计算溶质的质量并配制溶液。
第五步:溶液的配制实验(20分钟)1.引导学生进行溶液的配制实验。
2.提醒学生注意实验操作的安全和仪器的正确使用。
3.帮助学生解答实验中遇到的问题。
四、教学评价1.观察学生对物质的量浓度和溶液的配制的理解程度。
2.批改学生在练习和实验中的答案,并指出错误和改进的地方。
3.给予学生针对性的评价和建议。
五、教学延伸1.带领学生探索其他与物质的量浓度和溶液的配制相关的知识,如摩尔质量的计算、溶质的溶解度等。
2.给学生推荐相关的练习题目和参考书,培养学生的自主学习能力。

