2017届米脂中学高一化学竞赛
- 格式:docx
- 大小:351.88 KB
- 文档页数:6

附:第22届全国高中学生化学竞赛获奖名单一、陕西赛区获奖学生(94名)陕西赛区二等奖(36名)李楚杰(宝鸡中学)余博(宝鸡中学)周博超(宝鸡中学)张家文(渭滨中学)贺敏琪(眉县中学)王凯(扶风高中)杨敏(扶风高中)彭磊(眉县槐芽高中)权浩亮(宝鸡中学)王星茹(凤翔中学)李哲(石油中学)胡榛(宝鸡中学)刘金龙(扶风高中)吴少博(宝鸡中学)巨春武(宝鸡中学)何黎松(凤翔中学)赵晓强(扶风高中)张立桐(宝鸡中学)李默(岐山高中)李倩(宝鸡中学)祁小乐(凤翔中学)李恒超(宝鸡中学)杨晓东(宝鸡中学)见雷雷(眉县槐芽高中)李晓阳(石油中学)张荣(扶风高中)黄政峰(石油中学)王新瑞(扶风高中)李珂欣(宝鸡中学)吴航(宝鸡中学)蒋炜(渭滨中学)张永超(扶风高中)李博(眉县槐芽高中)蔡耀辉(蔡家坡高中)李永鹏(凤翔中学)任亚强(扶风高中)陕西赛区三等奖(58名)田泽群(宝鸡中学)胥伟(石油中学)方强(宝鸡中学)田博(烽火中学)史来祥(长岭中学)李兵(石油中学)刘安迪(宝鸡中学)杨诏(宝鸡中学)高颂凯(石油中学)李雪雯(宝鸡中学)张茹(烽火中学)刘阳(凤翔中学)王亚龙(凤翔中学)李航(法门高中)黄超(扶风高中)令丹(石油中学)侯春锋(凤翔中学)蔡晓乐(蔡家坡高中)宋云鹏(宝鸡中学)李倩(法门高中)段容仪(宝鸡中学)张寒亮(眉县槐芽高中)曹纪龙(凤翔中学)张宏哲(凤翔中学)陈滢(凤翔中学)张红刚(宝鸡中学)吴卫龙(石油中学)李鹏(陇县中学)邓康(宝鸡中学)冯永奇(宝鸡中学)蔡锦超(蔡家坡高中)董若曦(宝鸡中学)蔡少多(蔡家坡高中)张永杰(眉县槐芽高中)陈阳阳(凤翔中学)马少杰(眉县槐芽高中)李龙(蔡家坡高中) 马国力(宝鸡中学)王晓欢(蔡家坡高中)王博远(宝鸡中学)王瑞恒(千阳中学)段家强(宝鸡中学)权冬(眉县中学)马腾(石油中学)翟安成(扶风高中)魏卓贤(石油中学)魏亚刚(虢镇中学)魏峰(宝鸡中学)宋亚明(眉县槐芽高中)王丹(宝鸡中学)雪洋(宝鸡中学)王栋(石油中学)高晖(凤县中学)李贝贝(宝鸡中学)姚利峰(扶风高中)郭晓博(凤翔中学)孟凡哲(宝鸡中学)王晓杰(凤翔中学)二、陕西赛区优秀组织单位宝鸡市教研室三、陕西赛区团体优秀奖宝鸡中学四、陕西赛区优秀指导教师(11名)卢灵(宝鸡中学)颉晓峰(岐山高级中学)何娟平(蔡家坡高中)高晓峰(眉县中学)李君强(扶风高中)冯秋红(石油中学)张建勋(眉县槐芽高中)王永兰(凤翔中学)王兴昌(渭滨中学)王鵾(渭滨中学)李巧丽(渭滨中学)五、陕西赛区优秀组织学校(13所)宝鸡中学眉县中学凤翔中学岐山高级中学陇县中学扶风高中扶风职教中心凤县中学扶风法门高中石油中学渭滨中学金台高级中学凤翔柳林职业中学六、陕西赛区先进工作者(22名)卢灵(宝鸡中学)彭群(宝鸡中学)孔令波(宝鸡中学)陆平(扶风法门高中)高晓峰(眉县中学)冯秋红(石油中学)王永兰(凤翔中学)米宏利(陇县中学)韩忠芳(金台高级中学)颉晓峰(岐山高中)李君强(扶风高中)张欣(金台高级中学)王莉(凤县中学)李丽华(扶风职教中心)赵志杰(凤翔柳林职业中学)王兴昌(渭滨中学)王宣忠(宝鸡市教研室)杨少明(眉县教研室)王勇智(扶风县教研室)王保义(凤翔县教研室)江萍(金台区教研室)史荣刚(岐山县教研室)七、宝鸡地区学生优胜奖(100名)任欢(宝鸡中学)王伟(眉县槐芽高中)王永涛(凤翔中学)张塬(凤翔中学)刘丹琦(宝鸡中学)麻向平(凤翔中学)李天(扶风高中)张蒙(宝鸡中学)罗永辉(凤翔中学)谭真(宝鸡中学)高万强(宝鸡中学)林博(宝鸡中学)陶希(宝鸡中学)刘星飞(虢镇中学)王少飞(凤翔中学)冯世龙(姜城中学)何永(虢镇中学)张浩(宝鸡中学)李超(眉县槐芽高中)刘美彤(宝鸡中学)罗希(宝鸡中学)屈磊磊(扶风美阳高中)寸莎莎(凤翔中学)陈亮(凤翔中学)郭鑫(岐山中学)赵攀(扶风高中)王涛(岐山中学)李宇宁(宝鸡中学)李鹏飞(金台高级中学)张瑜(石油中学)张江涛(虢镇中学)石伟杰(石油中学)李文心(宝鸡中学)张楠(宝鸡中学)姚沛(宝鸡中学)张宝龙(法门高中)陈冬菊(石油中学)黄晨曦(宝鸡中学)赵鹏飞(凤翔中学)王乐(岐山中学)宋洋洋(石油中学)张国亮(渭滨中学)亢鹏(宝鸡中学)李威仪(眉县中学)王奕松(石油中学)任佳(蔡家坡高中)屈佳(渭滨中学)罗晨光(凤翔中学)张飞飞(凤翔中学)孙蕾华(宝鸡中学)李霄(宝鸡中学)孙偑(岐山中学)刘刚(麟游中学)鱼一哲(石油中学)王帅(石油中学)李浩伟(石油中学)景飞(眉县中学)王卫刚(岐山中学)吕文礼(凤翔中学)徐温温(凤翔中学)白龙刚(眉县中学)马海涛(凤翔中学)倪彦春(千阳中学)郗永刚(千阳中学)张卓(眉县槐芽高中)刘畅(石油中学)高永峰(法门高中)张欢(凤翔彪角中学)强朝辉(眉县槐芽高中)梁力(凤翔中学)李晗(扶风高中)张新磊(虢镇中学)王宏强(法门高中)李昕(眉县中学)赵丽丹(宝鸡中学)段禹刚(宝鸡中学)申康路(凤翔中学)刘超(扶风高中)刘鹏博(眉县槐芽高中)任海斌(扶风职教中心)陈景荣(蔡家坡高中)王海超(扶风美阳高中)徐琦(石油中学)崔鑫(宝成中学)潘明(卧龙寺中学)张昆(陇县中学)王波(陇县中学)张幼婷(东关高中)赵佳(麟游中学)刘方(岐山益店高中)郭晓东(长岭中学)李东升(麟游中学)王亮(斗鸡中学)李雷博(扶风美阳高中)麻海洋(眉县城关中学)张佩佩(扶风绛帐高中)张亚超(凤翔职教中心)李鑫(眉县城关中学)仲银鹏(渭阳中学)赵玥(凤翔西街中学)。

2003年“扬子石化”杯第17届全国高中学生化学竞赛(江苏赛区)夏令营暨选拔赛试题(2003年7月18日 8:20-11:20 共计3小时)题号 1 2 3 4 5 6 7 8 9 10 11 12 13 总分满分 6 8 6 6 7 8 7 14 8 6 5 9 10 100 得分评卷人●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
●所有解答必须写在指定位置,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其它纸张。
●姓名、准考证号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
第1题(共6分)实验室制备少量硅一般采用镁粉还原SiO2的方法,然后用稀盐酸洗涤产品以除去杂质。
某同学在进行上述操作时,在制得的产品中加HCl洗涤时突然起火。
(1)请用化学方程式解释:①稀盐酸洗涤产品可除去哪些主要杂质?②为什么加HCl洗涤时突然起火?(2)请设计一个实验来验证你的解释。
(不必画出装置图,也不必指出具体化学药品,不要写方程式,只要简明指出方法。
)第2题(共8分) (1) 根据杂化轨道理论,下列离子或分子:NH3、NF3、NO2+中氮分别采用、、杂化轨道同相应的键合原子成键。
其中NH3的键角 (填“大于”或“小于”)NF3的键角的原因是。
(2) 最近,德国科学家在医学杂志《柳叶刀》上发表文章,他们研究发现一种名为甘草甜素的物质可以有效抑制非典病毒的增殖,有望用其研制出治疗非典的特效药。
此前医学家已用甘草甜素作为有效成分开发出药物,治疗丙肝与艾滋病等,并取得了一定效果。
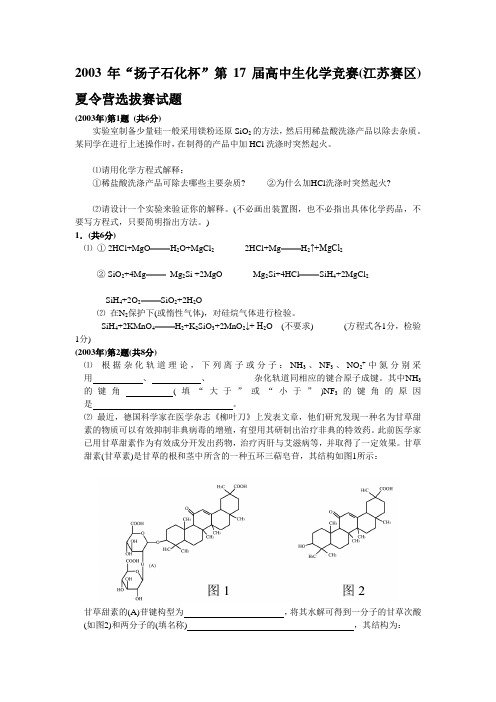
甘草甜素(甘草素)是甘草的根和茎中所含的一种五环三萜皂苷,其结构如图1所示:甘草甜素的(A)苷键构型为 ,将其水解可得到一分子的甘草次酸(如图2)和两分子的(填名称) ,其结构为:第3题(共6分) 提出查理定律的查理很幸运,碰巧开始时没有以N 2O 4来研究气体行为,否则他或许会得出一种相当特殊的温度效应。
2003年“扬子石化杯”第17届高中生化学竞赛(江苏赛区)夏令营选拔赛试题(2003年)第1题(共6分)实验室制备少量硅一般采用镁粉还原SiO2的方法,然后用稀盐酸洗涤产品以除去杂质。
某同学在进行上述操作时,在制得的产品中加HCl洗涤时突然起火。
⑴请用化学方程式解释:①稀盐酸洗涤产品可除去哪些主要杂质? ②为什么加HCl洗涤时突然起火?⑵请设计一个实验来验证你的解释。
(不必画出装置图,也不必指出具体化学药品,不要写方程式,只要简明指出方法。
)1.(共6分)⑴① 2HCl+MgO H2O+MgCl22HCl+Mg H2↑+MgCl2② SiO2+4Mg Mg2Si +2MgO Mg2Si+4HCl SiH4+2MgCl2SiH4+2O2SiO2+2H2O⑵在N2保护下(或惰性气体),对硅烷气体进行检验。
SiH4+2KMnO4H2+K2SiO3+2MnO2↓+ H2O (不要求) (方程式各1分,检验1分)(2003年)第2题(共8分)⑴根据杂化轨道理论,下列离子或分子:NH3、NF3、NO2+中氮分别采用、、__________杂化轨道同相应的键合原子成键。
其中NH3的键角(填“大于”或“小于”)NF3的键角的原因是。
⑵最近,德国科学家在医学杂志《柳叶刀》上发表文章,他们研究发现一种名为甘草甜素的物质可以有效抑制非典病毒的增殖,有望用其研制出治疗非典的特效药。
此前医学家已用甘草甜素作为有效成分开发出药物,治疗丙肝与艾滋病等,并取得了一定效果。
甘草甜素(甘草素)是甘草的根和茎中所含的一种五环三萜皂苷,其结构如图1所示:甘草甜素的(A)苷键构型为,将其水解可得到一分子的甘草次酸(如图2)和两分子的(填名称) ,其结构为:。
2.(共8分)⑴ sp 3 sp 3 sp 大于 氟的电负性大于氢,因此用于N -F 成键的电子对更偏向氟 (或离氮原子核较远),氮周围电子密度减小(或N -F 成键电子对间的“距离”较远),斥力较小,因而键角较小。


2017年重庆市高中学生化学竞赛试题(高一组) 2017年5月21日 共8页 12017年重庆市高中学生化学竞赛试题(高一组)(2017年5月 21日 9:00-11:00)● 竞赛时间2小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
考试时间结束时,把试卷(背面朝上)放在桌子上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
● 不准使用任何改正液或改正纸,不得使用红笔或铅笔作答。
第1题答案填写在第1题号下面的表格内,其它所有解答必须写在制定的方框内。
● 姓名、所属学校必须写在首页左侧规定位置,写在其它地方者按废卷论处。
● 允许使用无贮存信息功能的非编程计算器以及直尺等文具。
● 考生不得携带任何通讯工具进入考场。
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Si-28 Cl-35.5 Fe-56 Cu-64 第1题(20分)选择题(单选)1-1 2017年1月26日,《科学》杂志报道哈佛大学实验室成功制造出金属氢。
金属氢是一种高密度、高储能材料,预测显示,金属氢是一种室温超导体。
下列有关金属氢和H 2的叙述中错误的是( )A .金属氢是H2的同素异形体 B .金属氢燃烧能释放出巨大能量 C .金属氢与H 2具有相同的化学键 D .一定条件下H 2能转化为金属氢 1-2下列说法中正确的是( )A .在一定条件下,Fe 可与浓盐酸、浓硝酸发生剧烈反应B .铜粉加入稀硫酸中不溶解,若再加入KNO 3,铜粉仍不溶解C .在常温下,SO 2和NO 2均能与NaOH 溶液发生非氧化还原反应D .在常温下,Br 2和I 2均能与H 2发生化合反应1-3 N A 为阿伏加德罗常数的值。
下列说法正确的是( )A .5.6 g Fe 在氧气中完全燃烧,转移电子数为0.3N AB .8.4 g NaHCO 3晶体中所含C -H 键个数为0.1N AC .标准状况下,1.12 L O 2与2.24 L NO 混合,所得气体的分子数为0.2N AD .常温下,0.8 mol NH 3和0.3 mol Cl 2混合恰好完全反应后,气体分子数为0.1N A1-4 X 、Y 、Z 、W 均为短周期元素,且Y 、Z 、W 在周期表的位置关系如下。

2017年重庆市高中学生化学竞赛试题(高二组)2017年5月21日共8页12017年重庆市高中学生化学竞赛试题(高二组)(2017年5月21日9:00-11:00)题号123456789总分满分2010101091291010100得分评卷人●考生须知:●竞赛时间2小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
考试时间结束时,把试卷(背面朝上)放在桌子上,立即起立撤离考场。
●试卷装订成册,不得拆散。
●不准使用任何改正液或改正纸,不得使用红笔或铅笔作答。
第1题答案填写在第1题号下面的表格内,其它所有解答必须写在制定的方框内。
●姓名、所属学校必须写在首页左侧规定位置,写在其它地方者按废卷论处。
●允许使用无贮存信息功能的非编程计算器以及直尺等文具。
●考生不得携带任何通讯工具进入考场。
相对原子质量:H-1C-12O-16Na-23S-32Cl-35.5K-39Mn-55Co-59Cs-132.9第1题(20分)选择题(单选)题号1-11-21-31-41-51-61-71-81-91-10答案1-1化学与生活密切相关,下列说法错误的是()A .古人曾利用明矾溶液的酸性来清洗青铜器上的铜绿B .酸性重铬酸钾用于检查酒驾是利用其强氧化性C .葡萄中含有的花青素在碱性环境下显蓝色,可用苏打粉检验假葡萄酒D .手机外壳上贴的碳纤维外膜是一种新型的有机高分子材料1-2NM 3是处于临床试验阶段的小分子抗癌药物,分子结构如图。
下列说法正确的是()A .该有机物的化学式为C 12H 13O 4B .1mol 该有机物最多可以和5mol NaOH 反应C .该有机物容易发生加成、取代、消去等反应D .分子中所有的氧原子可能在同一个平面上1-3N A为阿伏加德罗常数的值,下列说法正确的是()A .标准状况下,0.1mol Cl 2溶于水,转移的电子数目为0.1N AB.1L0.1mol/L的H2SO4溶液中氧原子的总数大于0.4N AC.58.5g氯化钠晶体中含有N A个氯化钠分子D.120g NaHSO4晶体中阳离子和阴离子的总数为3N A1-4用如题1-4图所示装置电解一段时间后,下列各组叙述错误的是()A.Ⅰ、Ⅱ为Fe,A为NaCl,两极间可能会出现白色沉淀B.Ⅰ、Ⅱ为石墨,A为FeCl2,Ⅱ极附近溶液变成黄色C.Ⅰ、Ⅱ为Pt,A为饱和Na2SO4,底部析出晶体D.Ⅰ、Ⅱ为Al,A为AlCl3,Ⅰ极质量增加1-5下列实验中,对实验现象的预测正确的是()A.AgI悬浊液中加入稀KCl溶液,有白色沉淀产生B.KI溶液与稀硫酸、淀粉溶液混合,放置在空气中,溶液变成蓝色C.稀硝酸中加入Fe粉至不再溶解,滴入KSCN溶液,溶液变红D.新制氯水中加入少量石蕊试液并充分振荡,溶液最终变红色1-6下列说法正确的是()A.Na2HPO4溶液(呈碱性)中含有如下的平衡:HPO42-H++PO43-,加水稀释,溶液中的HPO42-、H+、PO43-的浓度均减小B.常温时,0.1mol/L草酸钠溶液pH=a,则草酸的第二级电离平衡常数K a2约为1013-2aC.常温下,0.01mol/L的HA和BOH两种溶液,pH分别为3和12,将两溶液等体积混和后,所得溶液的pH≤7D.在NH4HSO3溶液中,c(NH4+)=c(SO32-)+c(HSO3-)+c(H2SO3)1-7短周期元素a、b、c、d的原子序数依次增大,c、a、b最外层电子数为等差数列,公差为2,c的第一电离能大于其相邻的前后两种元素,d的核外电子数比b的大8。
2017年宁夏生物竞赛获奖名单
2017年,宁夏省举办了第八届生物竞赛活动,并公布了获奖名单。
赛事包括选拔赛、晋级赛以及总决赛三个阶段,全省高中生参与积极高涨,最终达到了预定的目标。
今年,全省共有18所学校参赛,其中来自银川市的十五所学校、中卫市的两所学校以及固原市的一所学校,经过两个多月的激烈角逐,终于迎来了比赛的最后一天,也是最重要的决赛和颁奖典礼。
经过有关部门的严格评审,最终产生了十位优胜者,分别来自银川市一中、银川市二中、固原市一中、中卫市一中、中卫市二中以及枣泉一中、团风一中、门子一中、北山一中以及黄陵一中。
他们取得了总决赛的优异成绩,荣获一等奖、二等奖以及三等奖,并获得奖励。
被评为一等奖的有银川市一中的陈永欣,他发现了一种新物种,也是当年最大的亮点;二等奖是固原市一中的李明,他用最简单的语
言描述了植物的生长原理,让老师们拍手叫绝;三等奖是中卫市一中
的张艳芳,她挖掘出生物进化的太多知识,让评委们赞不绝口。
参赛队伍拥有来自各学校的优秀代表,他们让宁夏省绿色生态概念得到更好的推广。
青少年在比赛中激发了更多的科学家的潜能,让独特的宁夏生物在全国乃至世界的地球生态系统中得到更好的保护
和繁衍。
宁夏省政府国土资源厅绿色发展处处长张中厚表示:“我们对宁
夏省的学生进行生物竞赛,旨在培养学生的科学素养,让他们对生物有更深刻的认识,为宁夏生态保护尽一份力量。
”
今年的宁夏生物竞赛让各位参赛者获得了宝贵的经验,也让大家得到更广泛的认识。
获奖者们获得了奖励,同时也获得了成就感,这些成就感将会激发他们更好地研究生物,为宁夏一方做出更多的贡献,构筑宁夏绿色发展的美丽景色!。
第31届中国化学奥林匹克(决赛)试题第1题(11分)1-1 1.000 g铝黄铜合金(设只含有铜、锌、铝)与0.100 moldm-3硫酸反应,在25 °C和101.325 kPa下测得放出的气体的体积为149.3 cm3,将相同质量的该合金溶于足量热浓硫酸,在相同温度和压强下测得放出的气体的提交为411.1 cm3,计算此铝黄铜合金中各组分的质量分数。
主要考察基本的计算和硫酸的酸性和氧化性。
铜不能和常温下的硫酸反应,所以第一步只有Zn和Al被H+ 氧化成Zn2+和Al3+;当硫酸温度提高浓度加大时,SO42-具有氧化性,可将Cu,Al和Zn全部氧化到最高价态,自身被还原成SO2。
计算的具体步骤很简单,如下:由已知三种组分的总质量为1.000 g,即M(Cu)n(Cu)+ M(Al)n(Al)+ M(Zn)n(Zn)= m(总)(1)合金与0.100 mol/L 的硫酸在低温下反应的方程式如下:Zn + 2 H+→ Zn2+ + H2 (g)2 Al + 6 H+→ 2 Al3+ +3 H2 (g)放出气体H2 149.3 cm3,由pV = nRTn(H2)= pV(H2) /RT(2)由上述方程式知n(Zn)+ 3/2 n(Al)= n(H2)(3)合金与0.100 mol/L 的浓硫酸在高温下反应的方程式如下:Zn + 2 H2SO4 (浓) → ZnSO4 + SO2 (g) + 2 H2O2 Al + 6 H2SO4 (浓) → Al2(SO4)3 + 3 SO2 (g) + 6 H2OCu + 2 H2SO4 (浓) → CuSO4 + SO2 (g) + 2 H2O放出气体SO2 411.1 cm3,由pV=nRTn(SO2)= pV(SO2)/RT(4)由上述方程式知:n(Zn)+ 3/2 n(Al)+ n (Cu) = n(SO2)(5)由已知M(Cu)= 63.55 g/mol,M(Al)= 26.98 g/mol,M(Zn)= 65.38 g/molR = 8.31441 J/K mol,T = 25 + 273.15 = 298.15 K,p = 101.325 kPaV(H2) = 149.3 cm3,V(SO2) = 411.1 cm3,m(总)= 1.000 g联立(1)、(2)、(3)、(4)、(5)可得n(Cu)= 1.070 ×10-2n(Al)= 1.112 ×10-3n(Zn)= 4.434 ×10-3w%(Cu)= m(Cu)n(Cu)/m(总)= 68.0%w%(Al)= m(Al)n(Al)/m(总)= 3.0%w%(Zn)= m(Zn)n(Zn)/m(总)= 29.0%1-2 向[Cu(NH3)4]SO4水溶液中通入SO2气体至溶液呈微酸性,析出白色沉淀CuNH4SO3。
2017届米脂中学高一化学竞赛考生序号:一、选择题(共15题,每小题3分,共45分。
每小题给出的4个选项只有一个符合题意。
)1.N A为阿伏伽德罗常数。
下列说法正确的是()A.0.1mol的NaCl中含有6.02×1022个NaCl分子B.标准状况下,18g H2O中含有质子数为10N AC.常温常压下,0.1mol Na2O2与足量的CO2反应,转移电子数为0.2 N AD.由CO2和O2组成的混合物中共有N A个分子,其中的氧原子数为2 N A2.下列离子方程式正确的是()A.Fe粉与过量的稀硝酸反应:3Fe + 8H+ + 2NO3-=== 3Fe2+ +2NO↑+4H2OB.用铜为电极电解饱和食盐水:2Cl-+2H2O === Cl2↑+H2↑+2OH-C.用白醋除铁锈:Fe2O3+6H+=== 3H2O + 2Fe3+D.向FeBr2溶液中通入过量的氯气:2Fe2++ Cl2=== 2Cl-+ 2Fe3+3.下列有关元素的性质及其递变规律正确的是( )A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物B.第二周期元素从左到右,最高正价从+1递增到+7C.同一元素不可能既表现金属性,又表现非金属性D.同周期金属元素的化合价越高,其原子失电子能力越强4. X、Y、Z、M、N、W六种短周期的相对位置如图所示,下列说法错误的是( ) A.X的单质分子中有三队共用电子对,所以其性质较稳定C.M元素位于元素周期表中第四周期、第ⅥA族D.由Z与Y组成的物质在熔融时不能导电5.元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。
X元素为( )A.Al B.P C.Ar D.K6. 短周期元素A、B、C、D的原子序数依次增大,它们的核电荷数之和为32,原子最外层电子数之和为10;A与C同主族,B与D同主族,A、C原子最外层电子数之和等于B原子次外层电子数,则下列叙述正确的是( )A.D元素处于元素周期表第3周期ⅥA族B.四种元素原子半径大小顺序是A<B<C<DC.B、D的最高价氧化物具有相似的物理性质和化学性质D.一定条件下,B单质能置换出D单质,C单质能置换出A单质7. 下列实验操作中,错误的是()A.配制5%食盐溶液时,将称量的食盐放入烧杯中加计量的水搅拌溶解B.铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅C.用CCl4萃取碘水中的碘单质时,CCl4层从分液漏斗下口放出D.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释8. 下列说法或表示方法中正确的是()A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多B.由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定C.由2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol知,H2的燃烧热为-571.6 kJ·mol-1D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ9. 在体积为1L的密闭容器中,四位同学同时进行反应:A+3B===2C+2D的速率测定实验,2min后,分别测得反应速率如下:①A的浓度每秒变化0.15 mol/L;②v(B)=0.6 mol/(L·s);③C的浓度变化为6 mol/L④D 的物质的量变化为1.2 mol。
其中反应最快的是( )A.① B.② C.③ D.④10. 已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H12 H2(g)+O2(g)=2H2O(g) △H2C(s)+O2(g)=CO2(g) △H3则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为()A.12△H3+5△H2-2△H1B.2△H1-5△H2-12△H3C.12△H3-5△H2-2△H1D.△H1-5△H2-12△H311. 下列说法不正确的是( )12. 为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。
反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l)电解池:2Al+3H2O===Al2O3+3H2↑电解过程中,以下判断正确的是( )13同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积v(L)与时间t(min)的关系,其中正确的是( )14.在25ºC时,将两根铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有a mol 电子转移时,溶液中析出mg Na2SO4 ·10 H2 O晶体。
若温度不变,在剩余溶液中溶质的质量分数为( )A.×100% B.×100%C.×100% D.×100%15.如图判断,下列说法正确的是()A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大二、非选择题(共55分)8. (15分)短周期元素A 、B 、C 、D 、E 原子序数依次增大,A 与C 可形成A 2C 2和A 2C 两种化合物;B 的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙;D 与A 位于同一主族;在同周期元素形成的简单离子中,E 的离子半径最小。
(1)实验室中可用A 2C 2制取C 单质,其化学方程式是 (2)由A 、C 、D 三种元素组成的化合物的电子式是 ,其中C 、D 也可以组成D 2C 2和D 2C 两种化合物,写出其中用作潜水、航空供氧的主要化学反应方程式为: ,D 2C 2和D 2C 两种化合物中阳离子与阴离子个数之比分为 、 。
(3)A 、B 、C 三种元素中,由其中两种组成的10e -的粒子有 种,写出其中可以发生的离子反应的方程式 (4)反应乙+C 2→B 2+A 2C (未配平)可设计为燃料电池,则通入乙的电极是 (填 “正”或“负”)极,在碱性条件下其电极反应是 9. (13分)某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g 、锥形瓶和水的质量为190.720g )利用左图装置测定混合物中Na 2O 2的质量分数,每隔相同时间读得电子天平的数据如表:(1)写出Na 2O 2和H 2O 反应的化学方程式 (2)计算过氧化钠质量分数时,必需的数据是 不必作第6次读数的原因是 (3)测定上述样品(1.560g )中Na 2O 2质量分数的另一种方案,其操作流程如下:①操作Ⅱ的名称是②需直接测定的物理量是③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要、(固定、夹持仪器除外)④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果(填偏大、偏小或不变)。
10. (12分)2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。
水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42-② Na+、Fe2+、Cl-、NO3- ③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是(填序号)。
(3)在下列反应中,水仅做氧化剂的是(填字母,下同),水既不做氧化剂又不做还原剂的是。
A.2F2+2H2O=4HF+O2 B.2Na2O2+2H2O=4NaOH+O2↑C.CaH2+2H2O=Ca(OH)2+2H2↑D.3Fe+4H2O Fe3O4+4H2(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为。
11. (15分)氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:①用焦炭跟水反应:C(s) + H2O(g) CO(g) + H2(g);②用天然气跟水蒸气反应:CH4(g) + H2O(g) CO(g)+ 3H2(g)已知有关反应的能量变化如下图,且方法②的反应只能在高温下发生,则方法②中反应的ΔH =___________ kJ/moL。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:容器甲乙丙(1) 下列能说明该反应已达到平衡状态的是a.容器内N2、H2、NH3的浓度之比为1︰3︰2 b.v(N2)正=3v(H2)逆c.容器内压强保持不变d.混合气体的密度保持不变(2) 甲容器中达到平衡所需要的时间t 5min (填>、< 或=)(3) 乙中从反应开始到平衡时N2的平均反应速率。
(4) 分析上表数据,下列关系正确的是________.a.2c1 = 3mol/L b.ω1 = ω2c.2ρ1 = ρ2。