酸碱平衡和沉淀平衡
- 格式:ppt
- 大小:1.28 MB
- 文档页数:76

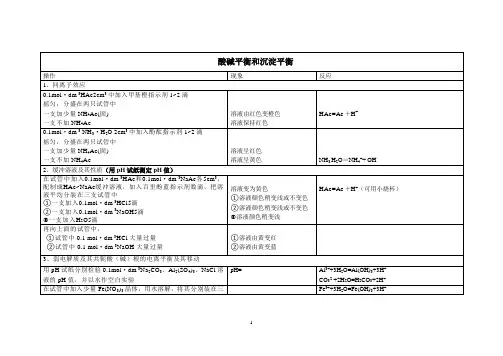
酸碱平衡和沉淀平衡操作现象反应1、同离子效应0.1mol·dm-3HAc2cm3中加入甲基橙指示剂1~2滴摇匀,分盛在两只试管中一支加少量NH4Ac(固) 一支不加NH4Ac 溶液由红色变橙色溶液保持红色HAc=Ac-+H+0.1mol·dm-3 NH3·H2O 2cm3中加入酚酞指示剂1~2滴摇匀,分盛在两只试管中一支加少量NH4Ac(固) 一支不加NH4Ac 溶液呈红色溶液呈黄色NH3 H2O=NH4++ OH-2、缓冲溶液及其性质(用pH试纸测定pH值)在试管中加入0.1mol·dm-3HAc和0.1mol·dm-3NaAc各5cm3,配制成HAc~NaAc缓冲溶液,加入百里酚蓝指示剂数滴,把溶液平均分装在三支试管中①一支加入0.1mol·dm-3HCl5滴②一支加入0.1mol·dm-3NaOH5滴③一支加入H2O5滴溶液变为黄色①溶液颜色稍变浅或不变色②溶液颜色稍变浅或不变色③溶液颜色稍变浅HAc=Ac-+H+(可用小烧杯)再向上面的试管中,①试管中0.1 mol·dm-3HCl大量过量②试管中0.1 mol·dm-3NaOH大量过量①溶液由黄变红②溶液由黄变蓝3、弱电解质及其共轭酸(碱)根的电离平衡及其移动用pH试纸分别检验0.1mol·dm-3Na2CO3、Al2(SO4)3、NaCl溶液的pH值,并以水作空白实验pH= Al3++3H2O=Al(OH)3+3H+CO32-+2H2O=H2CO3+2H+在试管中加入少量Fe(NO3)3晶体,用水溶解,将其分别装在三Fe3++3H2O=Fe(OH)3+3H+1支试管中第一支留作比较第二支中滴加数滴2mol·dm-3HNO3并摇匀第三支用小火加热溶液呈现黄色黄色褪去黄色加深(可水浴加热)在试管中加入0.1mol·dm-3BiCl31滴,用滴管加水稀释,再逐滴加入2mol·dm-3HCl至沉淀刚刚消失为止,再加水稀释出现白色沉淀BiCl3+3H2O=BiOCl(s)+3HCl在试管中加入10%Na2SiO35滴,再加入0.5mol·dm-3NH4Cl1cm3,摇匀白色沉淀NH4++H2O= NH3H2O+H+SiO32-+2H2O=2OH-+H2SiO3(s)透明在试管中加入0.1mol·dm-3A12(SO4)35滴,再加入0.5mol·dm-3 NaHCO32滴气泡白色沉淀HCO3-+ H2O=H2CO3+OH- H2CO3= H2O+CO2Al3++3H2O=Al(OH)3+3H+4、沉淀的生成、溶解和转化(1)在两支试管中各加入0.1mol·dm-3Pb(NO3)22滴一支加入1mol·dm-3KCl5滴一支加入0.01 mol·dm-3KCl5滴将生成沉淀的那一支试管小火加热白色沉淀(针状)澄清,无沉淀沉淀消失Pb2++2Cl-=PbCl2PbCl2在热水中溶解度大(2)在上面实验未产生沉淀的试管中加入0.01mol·dm-3KI 生成黄色沉淀Pb2++2I-=PbI2(黄色)(3)2mL1mol·dm-3MgCl2中加入2ml1 mol·dm-3NaOH(用氨水也可以)将沉淀过滤分盛在两个试管中,一支中加入1mol·dm-3HCl1ml一支中加入1mol·dm-3NH4Cl1ml 白色沉淀沉淀消失沉淀消失Mg2++2OH-⇌Mg(OH)2(如果是用氨水:Mg2++2NH3.H2O⇌Mg(OH)2+2NH4+)Mg(OH)2+2H+=Mg2++H2OMg(OH)2+2NH4Cl=MgCl2+2NH3+2H2O(4)沉淀转化2dK2CrO4溶液,滴加AgNO3溶液试管中滴加NaCl溶液砖红色沉淀转化为白色沉淀CrO42-+2Ag+=Ag2CrO4(砖红)Ag2CrO4+2Cl-=2AgCl(白)+CrO42-2试管中再滴加Na2S溶液转化为黑色沉淀2AgCl(白)+S2-=Ag2S(黑)+2Cl- 5、选做实验(1)分步沉淀:1dK2CrO4溶液(0.1mol/l)+2dNaCl溶液(0.1mol/l),滴加AgNO3溶液,(白色,红色沉淀)(2)缓冲溶液配制:pKa~pH,选Na2HPO4——NaH2PO4溶液混合,测定溶液的pH,用0.1mol/lHCl和0.1mol/l的NaOH试验其pH的变化3。









酸碱平衡和沉淀平衡、配位平衡实验目的1.了解缓冲溶液的缓冲作用原理及配制。
2.掌握难溶电解质的多相离子平衡及沉淀的生成和溶解的条件。
3.了解配位平衡和沉淀反应、氧化还原反应、溶液的酸度的关系及平衡的移动。
实验原理溶液中的离子平衡包括弱电解质的解离平衡和难溶电解质的沉淀溶解平衡及配合物的配位平衡等。
在弱电解质及其共轭酸(或共轭碱)的解离平衡或难溶电解质的沉淀溶解平衡体系中,加入具有相同离子的易溶强电解质,则平衡向左移动,产生使弱电解质的解离度或难溶电解质的溶解度降低的同离子效应。
由弱酸(或弱碱)及其盐等共轭酸碱对所组成的溶液(例如HAc —NaAc ,NH 3—NH 4C1,H 2PO 4-—HPO 42-等),其pH 值不会因加入少量酸、碱或少量水稀释而发生显著变化,具有这种性质的溶液称为缓冲溶液。
根据溶度积规则可以判断沉淀的生成或溶解。
当体系中离子浓度的幂的乘积大于溶度积常数,即Q>K sp 有沉淀生成;Q<K sp 时,无沉淀生成或沉淀溶解;Q =K sp 时,则为饱和溶液。
配合物的组成一般可分为内界和外界两个部分。
中心离子和配位体组成配合物的内界(一般为配离子或分子);配合物中除中心离子和配位体以外的部分为外界。
当简单离子(或化合物)形成配离子(或配合物)后,其某些性质会发生改变,如颜色,溶解度,氧化还原性质等。
例如Fe 3+能使I -氧化为I 2,但当形成配离子(如FeF 64-)后,却能把I 2还原为I -。
配离子在溶液中同时存在着配合过程和离解过程,即存在着配位平衡,如:Ag + + 2NH 3[Ag(NH 3)2]+2323]][[])([NH Ag NH Ag K ++=稳 K 稳称为稳定常数,不同的配离子具有不同的稳定常数,对于同种类型的配离子,K 稳值愈大,表示配离子愈稳定。
实验内容1. 同离子效应和缓冲溶液(1)同离子效应:在试管中加入0.1mol ·dm -3HAc2cm 3,再加入甲基橙指示剂1~2滴,摇匀,观察溶液的颜色,然后分盛两支试管,在其中一支试管中加入少量NH 4Ac(固),摇动试管以促进溶解,观察溶液颜色的变化。