晶形的转变及控制方法
- 格式:pdf
- 大小:359.56 KB
- 文档页数:15

晶形的转变及控制方法晶体是指具有规则外形和内部结构的固体物质,晶体的形态表现出多样性,有三角形、立方体、六方、正八面体等等。
晶体的形态受到多种因素的影响,包括成分、温度、溶液浓度、晶体生长速率等等。
控制晶体形态的方法有很多种,下面将介绍几种常见的晶体形态控制方法。
一、溶液方法溶液方法是通过变化溶液的成分、浓度、pH值等来控制晶体的形态。
在溶液中添加一定的添加剂可以改变溶液中晶体生长的速率和方向,从而影响晶体的形态。
例如,在金属晶体的生长过程中,通过调节金属盐的浓度、酸度和温度等条件,可以控制晶体的形貌。
二、模板方法模板方法是利用一个具有特定形状和大小的模板来引导晶体的生长,使晶体的形态与模板一致。
一种常见的模板方法是利用聚合物微球作为模板,通过在微球表面沉积晶体材料,再去除微球模板,得到具有相同形状的晶体。
三、温度和压力方法温度和压力方法是通过调节晶体生长的温度和压力来控制晶体的形态。
当温度和压力变化时,晶体的生长速率和方向也会发生变化,从而导致晶体形态的改变。
例如,在化学气相沉积中,通过调节反应区的温度梯度,可以控制金属氧化物晶体的生长方向,从而改变晶体的形状。
四、表面活性剂方法表面活性剂方法是利用表面活性剂分子在溶液中的吸附作用来控制晶体的形态。
表面活性剂分子吸附在晶体的特定面上,在该面的生长速率较低,导致晶体在该方向上长得较慢,从而形成具有特定形状的晶体。
五、电化学方法电化学方法是利用电场和电流来控制晶体的形态。
通过在晶体生长过程中施加外加电压或电流,可以改变晶体的生长速率和方向,从而控制晶体的形态。
一种常见的电化学方法是电沉积,通过控制电沉积过程中的电流密度和沉积时间等参数,可以得到具有特定形状和尺寸的晶体。
总之,控制晶体的形态有多种方法,可以通过改变溶液条件、利用模板、调节温度和压力、使用表面活性剂和应用电化学方法等来实现。
对于不同的晶体材料和应用需求,选择适合的晶体形态控制方法非常重要,可以实现对晶体形态的精确控制,从而获得具有特定形状和性能的晶体材料。




石英晶形转变存在的特点及其实际生产中应用石英晶形转变存在的特点及其实际生产中应用1.引言石英晶形转变是一个在矿物学与地球化学中非常重要的现象,它不仅影响着石英晶体的物理性质和化学性质,也对石英在实际生产中的应用产生深远影响。
本文将深入探讨石英晶形转变的特点及其在实际生产中的应用。
2.石英晶形转变的特点2.1 热力学性质石英在高温高压条件下会发生晶形转变,其原因主要是石英晶体结构中的硅原子和氧原子重新排列。
石英以α石英和β石英两种晶形存在,α石英具有六方晶系,而β石英则具有三方晶系。
这种晶形转变会导致石英晶体的物理性质和化学性质发生明显变化。
2.2 动力学特性除了受到温度和压力的影响外,石英晶形转变还受到外界应力的影响,这种应力可以促进或抑制石英的晶形转变。
因此在实际生产中,通过控制温度、压力和应力,可以实现对石英晶体晶形转变的精确控制,从而获得具有特定性质的石英晶体。
3.石英晶形转变在实际生产中的应用3.1 电子产品制造由于石英具有优异的压电性能和光学性能,因此被广泛应用于电子产品制造。
石英晶形转变可以改变石英晶体的物理特性,从而使其更加适用于不同的电子产品,如压电陶瓷、石英振荡器等。
3.2 导热材料制备通过控制石英晶形转变,可以获得具有良好导热性能的石英晶体,这对于制备高性能的导热材料非常重要。
在微电子、半导体等领域,这种高导热性能的石英晶体被广泛应用于散热器、散热片等导热材料的制备中。
3.3 岩石学研究石英晶形转变在岩石学研究中也具有重要意义,它可以帮助地质学家了解地球内部的温度、压力和构造变化,从而深入理解地球的演化历程和地质现象。
4.个人观点与理解通过对石英晶形转变的深入研究,我对石英晶体的应用和性质有了更深入的理解。
在实际生产中,通过精确控制石英晶形转变,可以获得具有特定性能的石英晶体,从而拓展了石英在电子产品制造、导热材料制备和岩石学研究中的应用领域。
5.总结与回顾本文深入探讨了石英晶形转变的特点及其在实际生产中的应用。
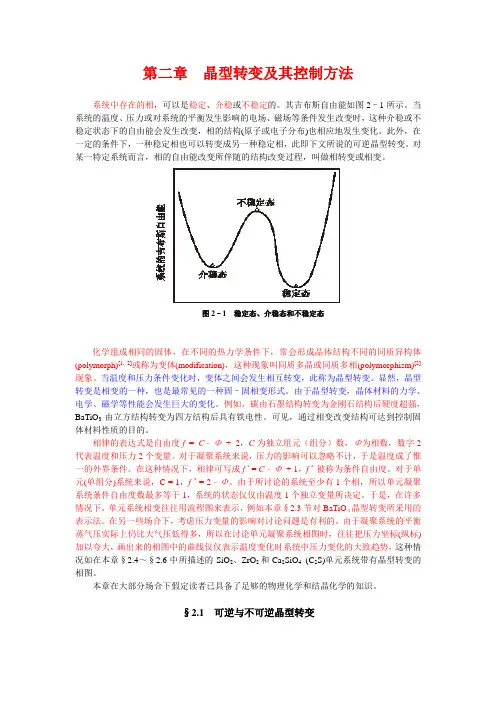
第二章晶型转变及其控制方法系统中存在的相,可以是稳定、介稳或不稳定的。
其吉布斯自由能如图2–1所示。
当系统的温度、压力或对系统的平衡发生影响的电场、磁场等条件发生改变时,这种介稳或不稳定状态下的自由能会发生改变,相的结构(原子或电子分布)也相应地发生变化。
此外,在一定的条件下,一种稳定相也可以转变成另一种稳定相,此即下文所说的可逆晶型转变。
对某一特定系统而言,相的自由能改变所伴随的结构改变过程,叫做相转变或相变。
图2–1 稳定态、介稳态和不稳定态化学组成相同的固体,在不同的热力学条件下,常会形成晶体结构不同的同质异构体(polymorph)[1, 2]或称为变体(modification),这种现象叫同质多晶或同质多相(polymorphism)[2]现象。
当温度和压力条件变化时,变体之间会发生相互转变,此称为晶型转变。
显然,晶型转变是相变的一种,也是最常见的一种固–固相变形式。
由于晶型转变,晶体材料的力学、电学、磁学等性能会发生巨大的变化。
例如,碳由石墨结构转变为金刚石结构后硬度超强,BaTiO3由立方结构转变为四方结构后具有铁电性。
可见,通过相变改变结构可达到控制固体材料性质的目的。
相律的表达式是自由度f= C–Φ+ 2,C为独立组元(组分)数,Φ为相数,数字2代表温度和压力2个变量。
对于凝聚系统来说,压力的影响可以忽略不计,于是温度成了惟一的外界条件。
在这种情况下,相律可写成f * = C–Φ+ 1,f * 被称为条件自由度。
对于单元(单组分)系统来说,C = 1,f * = 2–Φ。
由于所讨论的系统至少有1个相,所以单元凝聚系统条件自由度数最多等于1,系统的状态仅仅由温度1个独立变量所决定。
于是,在许多情况下,单元系统相变往往用流程图来表示,例如本章§2.3节对BaTiO3晶型转变所采用的表示法。
在另一些场合下,考虑压力变量的影响对讨论问题是有利的。
由于凝聚系统的平衡蒸气压实际上仍比大气压低得多,所以在讨论单元凝聚系统相图时,往往把压力坐标(纵标)加以夸大,画出来的相图中的曲线仅仅表示温度变化时系统中压力变化的大致趋势,这种情况如在本章§2.4~§2.6中所描述的SiO2、ZrO2和Ca2SiO4(C2S)单元系统带有晶型转变的相图。

固体制剂晶型变化的原因及常用分析方法1前言许多晶型药物因晶格不同而导致某些物理性质(如熔点、溶解度)的不同,稳定性也有可能发生改变(一般是不稳定型和亚稳定型向稳定型的转变)。
药物分子溶解度的改变可能会对制剂特性产生显著影响,最终可能会影响药物在体内的吸收。
因此,固体状态的稳定性是一个化合物能否被开发成药的关键因素之一。
对许多的溶剂化物、水合物和亚稳晶型来说,它们在储存和生产过程中很容易发生转晶现象。
因此,一般会首先考虑将室温条件下最稳定的固体形态开发为临床使用的剂型。
但是,有时稳定晶型可能会存在某些缺陷,如溶解度太差、生物利用度低等,不得不考虑将一些动力学上稳定存在的亚稳晶型作为药用晶型开发上市;而使用亚稳晶型会存在转晶的风险,所以对药物固体状态转晶现象的研究在药物发展过程中也是非常重要的。
2研磨研磨是一种相对比较常用的方法之一,它常被用来减小药物颗粒的尺寸。
在研磨过程中会有热量和振动能产生,再加上其本身带有的机械能,最终可能导致药物晶型的无定形化或发生固态—固态多晶型转变现象。
同一个药物的同种晶型在不同温度下研磨可能会发生不同的转晶过程。
苯基丁氮酮的不同晶型被分别置于4度和35度条件下球磨,在4度下研磨苯基丁氮酮α、β和δ晶型都转变为一种新晶型ζ晶型,接着研磨ζ晶型又转变为ε晶型。
在35度条件下球磨,α晶型先转变为ζ晶型,接着研磨最终转变为δ晶型;β晶型直接转变为δ晶型,而δ晶型则保持不变。
固体药物在研磨过程中除了温度变化会引起转晶外,引入晶种、添加物等有时也会引起晶型改变。
通过研磨的手段,有时会导致药物理化性质的改变,继而影响药物的稳定性和有效性。
3湿法制粒和干燥湿法制粒是固体制剂制备过程中常用的一种制粒方式。
对于晶型中含水的药物分子,在湿法制粒过程中容易产生不同的晶型。
盐酸厄洛替尼是一种新型的口服表皮生长因子受体酪氨酸激酶抑制剂,其存在多种晶型,如A、B、E、L和无定型等多种形式。
晶型B 在热力学上比晶型A更稳定,而晶型E被认为具有和晶型B类似的稳定性,但具更高的溶解度;但晶型E的实际可生产性不强、工业化应用上有一定的局限性,因此,常用的晶型为A和B。

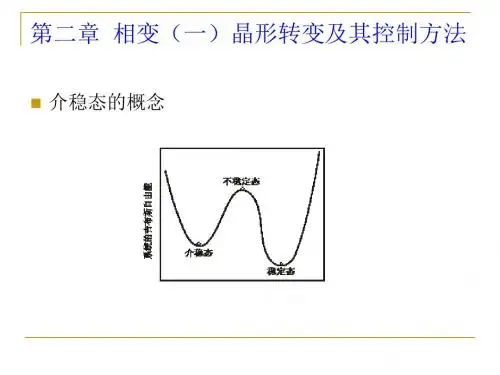
第二章晶型转变及其控制方法系统中存在的相,可以是稳定、介稳或不稳定的。
其吉布斯自由能如图2–1所示。
当系统的温度、压力或对系统的平衡发生影响的电场、磁场等条件发生改变时,这种介稳或不稳定状态下的自由能会发生改变,相的结构(原子或电子分布)也相应地发生变化。
此外,在一定的条件下,一种稳定相也可以转变成另一种稳定相,此即下文所说的可逆晶型转变。
对某一特定系统而言,相的自由能改变所伴随的结构改变过程,叫做相转变或相变。
图2–1 稳定态、介稳态和不稳定态化学组成相同的固体,在不同的热力学条件下,常会形成晶体结构不同的同质异构体(polymorph)[1, 2]或称为变体(modification),这种现象叫同质多晶或同质多相(polymorphism)[2]现象。
当温度和压力条件变化时,变体之间会发生相互转变,此称为晶型转变。
显然,晶型转变是相变的一种,也是最常见的一种固–固相变形式。
由于晶型转变,晶体材料的力学、电学、磁学等性能会发生巨大的变化。
例如,碳由石墨结构转变为金刚石结构后硬度超强,BaTiO3由立方结构转变为四方结构后具有铁电性。
可见,通过相变改变结构可达到控制固体材料性质的目的。
相律的表达式是自由度f= C–Φ+ 2,C为独立组元(组分)数,Φ为相数,数字2代表温度和压力2个变量。
对于凝聚系统来说,压力的影响可以忽略不计,于是温度成了惟一的外界条件。
在这种情况下,相律可写成f * = C–Φ+ 1,f * 被称为条件自由度。
对于单元(单组分)系统来说,C = 1,f * = 2–Φ。
由于所讨论的系统至少有1个相,所以单元凝聚系统条件自由度数最多等于1,系统的状态仅仅由温度1个独立变量所决定。
于是,在许多情况下,单元系统相变往往用流程图来表示,例如本章§2.3节对BaTiO3晶型转变所采用的表示法。
在另一些场合下,考虑压力变量的影响对讨论问题是有利的。
由于凝聚系统的平衡蒸气压实际上仍比大气压低得多,所以在讨论单元凝聚系统相图时,往往把压力坐标(纵标)加以夸大,画出来的相图中的曲线仅仅表示温度变化时系统中压力变化的大致趋势,这种情况如在本章§2.4~§2.6中所描述的SiO2、ZrO2和Ca2SiO4(C2S)单元系统带有晶型转变的相图。
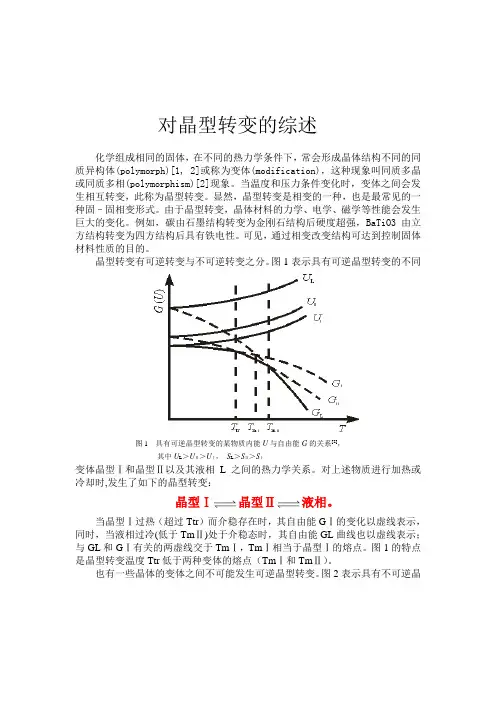
对晶型转变的综述化学组成相同的固体,在不同的热力学条件下,常会形成晶体结构不同的同质异构体(polymorph)[1, 2]或称为变体(modification),这种现象叫同质多晶或同质多相(polymorphism)[2]现象。
当温度和压力条件变化时,变体之间会发生相互转变,此称为晶型转变。
显然,晶型转变是相变的一种,也是最常见的一种固–固相变形式。
由于晶型转变,晶体材料的力学、电学、磁学等性能会发生巨大的变化。
例如,碳由石墨结构转变为金刚石结构后硬度超强,BaTiO3由立方结构转变为四方结构后具有铁电性。
可见,通过相变改变结构可达到控制固体材料性质的目的。
晶型转变有可逆转变与不可逆转变之分。
图1表示具有可逆晶型转变的不同图1 具有可逆晶型转变的某物质内能U与自由能G的关系[2],其中U L>UⅡ>UⅠ,S L>SⅡ>SⅠ变体晶型Ⅰ和晶型Ⅱ以及其液相L之间的热力学关系。
对上述物质进行加热或冷却时,发生了如下的晶型转变:晶型Ⅰ晶型Ⅱ液相。
当晶型Ⅰ过热(超过Ttr)而介稳存在时,其自由能GⅠ的变化以虚线表示,同时,当液相过冷(低于TmⅡ)处于介稳态时,其自由能GL曲线也以虚线表示;与GL和GⅠ有关的两虚线交于TmⅠ,TmⅠ相当于晶型Ⅰ的熔点。
图1的特点是晶型转变温度Ttr低于两种变体的熔点(TmⅠ和TmⅡ)。
也有一些晶体的变体之间不可能发生可逆晶型转变。
图2表示具有不可逆晶型转变的不同变体晶型Ⅰ、晶型Ⅱ及它们的液相L之间的热力学关系。
TmⅠ为晶型Ⅰ的熔点,TmⅡ相当于晶型Ⅱ的熔点。
虽然在温度轴上标出了晶型转变温度Ttr,但事实上是得不到的,因为晶体不可能在超过其熔点的温度下发生晶型转变。
此图的特点是,晶型转变温度Ttr高于两种变体的熔点(TmⅠ和TmⅡ)。
从图2可看出,三种晶型相互转变的过程可由下式表示.晶型Ⅰ熔体晶型Ⅱ先经过中间的另一个介稳相(如晶型Ⅱ),才能最终转变成该温度下的稳定态(晶型Ⅰ)的规律,称为阶段转变定律。

结晶大小控制原理及应用结晶大小控制原理及应用主要涉及材料科学领域中结晶过程的控制和调控。
结晶是指材料从溶液、熔体或气体中有序排列的原子或分子,形成有序的晶体。
结晶过程中,控制结晶的大小对于材料的性质和性能具有重要影响。
结晶大小的控制原理主要有以下几个方面:1. 核化速率控制:在溶液中,结晶的过程从溶质的核化开始,即从无序的个体转变为有序的晶体。
通过控制核化速率,可以调控晶体的形成速度和晶体的大小。
一种常用的方法是通过调节溶液的温度和过饱和度来控制核化速率,从而控制晶体的大小。
2. 晶体生长速率控制:晶体生长是指晶体的尺寸增大和有序性的提高过程。
通过调节材料的温度、溶液的浓度、扩散速率等因素,可以控制晶体的生长速率,从而影响晶体的大小。
例如,在溶液中加入表面活性剂或抑制剂可以改变晶体的生长速率,从而控制晶体的大小。
3. 晶体形核和生长过程的控制:结晶的过程包括晶体的形核和生长两个阶段。
晶体形核是指原子或分子聚集形成晶胞的过程,而晶体生长是指晶体的尺寸增大和有序性的提高过程。
通过调节溶液体系的条件、添加外界引入的晶核等,可以控制晶体形核和生长过程,从而影响晶体的大小。
结晶大小的控制在材料科学领域有广泛的应用:1. 半导体材料的制备:半导体材料的性能与晶体的尺寸和形态密切相关。
通过控制半导体材料的结晶大小,可以调控其光电性能、导电性能等。
例如,在太阳能电池的制备过程中,通过控制硅材料的结晶大小和形态,可以提高太阳能电池的转化效率。
2. 金属材料的优化:金属材料的性能与晶体的晶粒尺寸有关。
通过控制金属材料的结晶大小,可以调控其力学性能、塑性变形、热稳定性等。
例如,在汽车制造中,通过控制汽车零部件的金属结晶大小,可以提高材料的强度和硬度,增强零部件的耐磨性和耐腐蚀性。
3. 药物和化学品的制备:某些药物和化学品的晶体尺寸和形貌对其溶解度、稳定性和药效等有重要影响。
通过控制药物和化学品的结晶过程,可以控制其晶体的大小和形态,从而调控其溶解性、稳定性和药效。
§2.3 BaTiO 3的晶型转变和烧结温度的控制最早的压电陶瓷是BaTiO 3,后来以它为基础衍生出一系列重要的压电材料。
BaTiO 3在不同温度下的晶型转变如式(2–4)所示[7~9]三方单斜278K 四方393K 立方 1 733K六方。
(2–4) §2.4 SiO 2的晶型转变和应用晶态SiO 2有多种变体,它们可分为3个系列,即石英、鳞石英和方石英系列。
在同系列中从高温到低温的不同变体通常分别用α、β和γ表示。
它们之间的转化关系如图2–6所示。
习惯上,把该图中的横向转变,即石英、鳞石英与方石英间的转变,称为一级变体间的转变[5];把图中的纵向转变,即同系列的α、β和γ变体间的转变,称为二级变体间的转变[5],也叫做高低温型转变。
进一步分析可知,SiO 2一级变体间的转变属重构式转变,而它的二级变体间的转变是位移式转变中的一种。
图2–6 SiO2的晶型转变(本书作者对此图作了编辑)[2] SiO2系统相图如图2–7所示。
图2–7 SiO 2系统相图(Fenner, 1913;本书作者修订了此图)[5]从SiO 2相图可看出,当温度达到846 K 时,β–石英应转变为α–石英。
若将α–石英继续加热,到1 143 K 时应转变为α–鳞石英,但是,这一转变速度较慢。
当加热速度较快时,α–石英可能过热,直到1 873 K 时熔融。
如果加热速度较慢,使其在平衡条件下转变,α–石英就可能转变为α–鳞石英,后者可稳定到 1 743 K 。
同样,在平衡条件下,α–鳞石英在1 743 K 会转变为α–方石英,否则也将过热,在1 943 K 下熔融。
不论是α–鳞石英还是α–方石英,当冷却速度不够慢时,都会在不平衡条件下转化为它们自身的低温形态。
这些低温形态(β–鳞石英、γ–鳞石英和β–方石英)虽处于介稳状态,但由于它们转变为稳定状态的速度极慢,实际上可长期保持不变。
例如在耐火材料硅砖中,就存在着β–鳞石英和γ–鳞石英[2]。
凝固过程与控制
凝固是物质由液态转变为固态的过程。
在材料科学和冶金学中,控制凝固过程对于获得理想的结晶微观结构和性能非常重要。
以下是凝固过程的一些常见控制方法:
1. 温度控制:通过控制凝固过程中的温度变化,可以影响晶体生长速率和晶粒尺寸。
降低温度可以促使晶体生长缓慢而细小,有利于获得细小的晶粒。
2. 界面控制:凝固过程涉及到液-固界面的形成和迁移。
通过调整界面条件,如界面能量和界面活性剂浓度,可以控制晶体生长速率和形态。
3. 搅拌和搅拌控制:在凝固过程中施加搅拌力可以打破液态中的大团聚,增加传质速率,并控制晶体的成长方向和结构。
4. 成核控制:通过添加成核剂或控制成核条件,可以控制凝固过程中的初期晶核数量和分布,从而影响最终的晶体结构。
5. 基底控制:在某些凝固过程中,使用特定的基底材料可以影响晶体的取向和生长速率。
基底的选择和处理可以有针对性地控制晶体的取向和形态。
6. 包封和保护控制:在一些凝固过程中,通过包封或保护液相,可以控制氧气或其他外界物质对凝固过程的影响,以获得所需的结构和性能。
晶相调控方法晶相调控是指通过控制材料的晶体结构和相变行为,以调整材料的性能和功能。
这在材料科学和工程中是一个重要的研究领域,因为晶体结构的微观变化直接影响材料的宏观性能。
以下是一些晶相调控的常见方法:1.合金化:合金是由两种或更多不同元素组成的材料,其在晶体结构中形成固溶体。
通过调整合金中元素的组成和比例,可以改变材料的晶体结构、晶粒大小和相变行为,从而调控材料的性能。
2.温度控制:温度是影响晶体结构的重要因素。
通过控制材料的生长、热处理或退火温度,可以实现晶体结构的调控。
高温有助于晶体生长,而低温可能导致相变或晶格缺陷的形成。
3.应力控制:应力也是影响晶体结构的因素之一。
在材料的制备或加工过程中,通过施加外部力或采用特定的制备工艺,可以调控晶体结构,例如改变晶粒取向或减小晶体缺陷。
4.化学处理:通过改变材料的化学成分,可以实现晶相调控。
例如,引入不同的元素、改变化学配方或进行表面处理,都可以影响材料的晶体结构。
5.外场调控:外场,如电场、磁场和光场,也可以用来调控材料的晶相。
这包括电场诱导的相变、磁场调控的磁性相变以及光照引起的光致相变等。
6.掺杂:引入不同的杂质或掺杂物可以影响材料的晶相。
这种方法常用于半导体材料,通过引入掺杂物改变导电性、磁性等性质。
7.压力控制:高压条件下,晶体结构可能发生变化,产生新的相。
通过控制外部压力,可以实现材料的晶相调控。
8.纳米技术:通过纳米技术制备纳米材料,可以实现晶相调控。
纳米材料的小尺寸效应和表面效应可能导致其晶体结构与宏观晶体不同。
第二章晶型转变及其控制方法系统中存在的相,可以是稳定、介稳或不稳定的。
其吉布斯自由能如图2–1所示。
当系统的温度、压力或对系统的平衡发生影响的电场、磁场等条件发生改变时,这种介稳或不稳定状态下的自由能会发生改变,相的结构(原子或电子分布)也相应地发生变化。
此外,在一定的条件下,一种稳定相也可以转变成另一种稳定相,此即下文所说的可逆晶型转变。
对某一特定系统而言,相的自由能改变所伴随的结构改变过程,叫做相转变或相变。
图2–1 稳定态、介稳态和不稳定态化学组成相同的固体,在不同的热力学条件下,常会形成晶体结构不同的同质异构体(polymorph)[1, 2]或称为变体(modification),这种现象叫同质多晶或同质多相(polymorphism)[2]现象。
当温度和压力条件变化时,变体之间会发生相互转变,此称为晶型转变。
显然,晶型转变是相变的一种,也是最常见的一种固–固相变形式。
由于晶型转变,晶体材料的力学、电学、磁学等性能会发生巨大的变化。
例如,碳由石墨结构转变为金刚石结构后硬度超强,BaTiO3由立方结构转变为四方结构后具有铁电性。
可见,通过相变改变结构可达到控制固体材料性质的目的。
相律的表达式是自由度f= C–Φ+ 2,C为独立组元(组分)数,Φ为相数,数字2代表温度和压力2个变量。
对于凝聚系统来说,压力的影响可以忽略不计,于是温度成了惟一的外界条件。
在这种情况下,相律可写成f * = C–Φ+ 1,f * 被称为条件自由度。
对于单元(单组分)系统来说,C = 1,f * = 2–Φ。
由于所讨论的系统至少有1个相,所以单元凝聚系统条件自由度数最多等于1,系统的状态仅仅由温度1个独立变量所决定。
于是,在许多情况下,单元系统相变往往用流程图来表示,例如本章§2.3节对BaTiO3晶型转变所采用的表示法。
在另一些场合下,考虑压力变量的影响对讨论问题是有利的。
由于凝聚系统的平衡蒸气压实际上仍比大气压低得多,所以在讨论单元凝聚系统相图时,往往把压力坐标(纵标)加以夸大,画出来的相图中的曲线仅仅表示温度变化时系统中压力变化的大致趋势,这种情况如在本章§2.4~§2.6中所描述的SiO2、ZrO2和Ca2SiO4(C2S)单元系统带有晶型转变的相图。
结晶硫酸铝脱水过程中晶型与形貌的转变
晶状硫酸铝脱水过程中晶型与形貌的转变:
一、晶型的转变
1.当脱水处理的温度不断升高时,晶状硫酸铝晶体由心形转变为饱和三水晶体,其转变温度一般在180℃左右。
2.随着温度的提高,晶状硫酸铝从三水晶体转变为楔形晶体,其转变温度一般在210℃左右。
3.当温度持续不断升高时,晶状硫酸铝晶体从楔形晶体转变为尖晶体,其转变温度一般在220℃左右。
4.高温下,晶状硫酸铝晶体也可能进入六水晶体,其转变温度一般在250℃左右。
二、形貌的变化
1.晶状硫酸铝的晶体的形貌发生的变化比较复杂,其主要变化有:由斜方晶转变为针刺形、由针刺形转变为球形,由球形转变为长柱状。
2.多孔晶体转变为尖晶体时,晶体表面也会随之发生变化,从具有椭圆孔洞的多孔晶体变成尖晶体时,晶体表面发生裂纹,晶体表面出现很大的块状凹陷。
3.当温度持续升高时,晶状硫酸铝晶体的表面会发生不可逆的改变,形成一种类似棉花的凹状,形状像被细小破坏。
随着温度锁定,凹形变化继续持续发展,在相同温度下,凹形变化会持续放大。
4.晶状硫酸铝脱水过程中,晶体表面膨胀、缩减、块状变化以及表面裂纹出现等形貌变化,受水蒸汽的抑制,因此质量反应受到影响。