新人教版必修1气体摩尔体积
- 格式:pptx
- 大小:1.43 MB
- 文档页数:93



第16讲气体摩尔体积课前引入冰,水,水蒸气,都是H2O分子构成的物质。
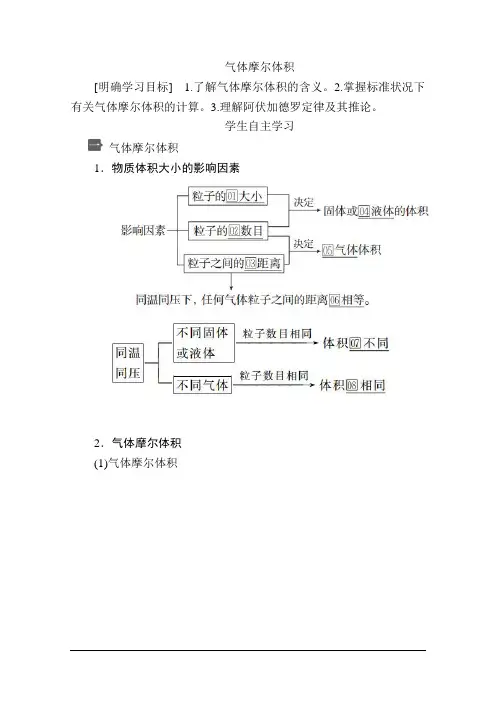
为什么冰有固定的形状,水和水蒸气却没有呢?一、不同聚集状态物质的微观结构1. 固体、液体、气体粒子的排列方式(以H2O为例)2.固体、液体、气体的微观结构与宏观性质二、影响物体体积的因素从微观来角度来看,物质体积的大小取决于构成这种物质的粒子的数目、粒子的大小和粒子之间的距离。
1. 固态、液态物质粒子之间的距离是非常小的,因此决定固体或液体体积的主要因素是构成物质的粒子的数目和粒子的大小。
2. 气态分子之间的距离远远大于分子本身的大小,因此决定气体体积的主要因素则是构成气体的分子的数目和分子之间的距离。
分子间的距离与温度、压强有关:温度越高,距离越大;压强越大,距离越小。
三、气体摩尔体积1.定义:单位物质的量的气体所占有的体积,叫做气体摩尔体积。
下载最新免费模拟卷,到公众号:一枚试卷君3.单位:L·mol-1(或L/mol)4.数值:在标准状况(温度为0℃,压强为101 kPa)下,气体摩尔体积为22.4L/mol5.计算公式:V=n·V m及时小练——填写下表【答案】1.5N A66g 33.6L2mol 2N A44.8L1mol 71g 22.4L题型一:决定物质体积大小的因素【例1】(2021·江苏苏州市·周市高级中学高一月考)在一定温度和压强下的气体,影响其所占气体大小的最主要因素是A.分子直径大小B.分子间距离的大小C.分子间作用力的大小D.分子数的大小【答案】D【详解】影响气体体积大小的因素有分子直径的大小、分子间距离的大小、分子数的大小,在一定温度和压强下,气体分子间的距离相等,因分子间距离远大于气体分子大小,则影响其所占体积大小的主要因素是分子数的大小,D选项符合题意;答案为D。
题型二:气体摩尔体积的适用范围【例2】(2021·全国高一课时练习)设N A表示阿伏加德罗常数的值,下列说法正确的是A.常温常压下,22.4 L SO2的物质的量是1 mol B.标准状况下,11.2 L H2O的物质的量是0.5 molC.标准状况下,44.8 LCO2含有的分子数为2N A D.1 mol任何气体的体积都约是22.4 L 【答案】C【详解】A.常温常压V m大于22.4L/mol,22.4L SO2的物质的量小于1mol,故A错误;B.标况下水是液体,不能使用气体摩尔体积,故B错误;C.标准状况下,44.8L CO2含有的分子数为2N A,故C正确;D.气体状况未知,应该是标况下1 mol任何气体的体积都约是22.4 L,故D错误;故答案为C。
气体摩尔体积[明确学习目标] 1.了解气体摩尔体积的含义。
2.掌握标准状况下有关气体摩尔体积的计算。
3.理解阿伏加德罗定律及其推论。
学生自主学习气体摩尔体积1.物质体积大小的影响因素2.气体摩尔体积(1)气体摩尔体积(2)影响因素 气体摩尔体积的数值取决于气体所处的□17温度和□18压强。
阿伏加德罗定律 在相同的□01温度和压强下,相同体积的□02任何气体都含有相同数目的粒子。
1.气体摩尔体积适用范围是气体,是否必须为纯净气体?提示:气体摩尔体积的适用范围是气体,可以是单一气体,也可为混合气体,如标准状况下0.2 mol H 2和0.8 mol O 2的混合气体约为22.4 L ,但要特别注意以混合气体中气体之间不发生化学反应为前提。
2.在同温、同压下1 L H 2和1 L O 2所含的分子数相同吗? 提示:相同,同温同压下,1 L H 2和1 L O 2的物质的量相同,则二者所含的分子数相同。
3.同温同压下,相同质量的H 2和O 2所占的体积相同吗?其体积比是多少?提示:不相同,设两者质量均为1 g ,同温同压下,气体的物质的量之比等于体积之比,则其体积比为12∶132=16∶1。
课堂互动探究1.气体摩尔体积的正确理解(1)气体体积与气体摩尔体积是两个不同的概念,使用时要避免混淆。
如标准状况下,1 mol O 2的体积是22.4 L ,O 2的气体摩尔体积是22.4 L·mol -1。
(2)使用22.4 L·mol -1时应该注意的问题:①条件必须是标准状况(0 ℃,101 kPa)。
②物质必须是气体,可以是单一气体也可以是混合气体。
(3)条件对气体摩尔体积的影响温度与压强都影响气体的体积,不同温度和压强下,气体摩尔体积的数值可能不同。
改变温度和压强,在非标准状况下气体摩尔体积也可能是22.4 L·mol -1。
2.有关计算(标准状况下)——“四公式”①气体的物质的量n =V 22.4 L/mol 。



第2课时气体摩尔体积核心微网络素养新要求1.了解影响气体、液体、固体体积的因素。
2.了解气体摩尔体积的含义。
3.学会有关气体摩尔体积的简单计算。
4.理解阿伏加德罗定律及相关推论。
学业基础——自学·思记·尝试一、影响物质体积大小的因素特别提醒相同物质的量的同种物质在不同状态下所占的体积一般是固体<液体<气体。
二、气体摩尔体积状元随笔利用气体摩尔体积进行化学计算时的注意事项(1)22 .4 L是1 mol任何气体在标准状况下的体积,因此在非标准状况时不能随意使用22 .4 L·mol-1。
但在非标准状况下(比如温度高于0 ℃,压强大于101 kPa)的V m也可能是22 .4 L·mol-1。
(2)只适用于气态物质,对于固态物质和液态物质是不适用的。
(3)此处所指的“气体”可以是纯净物,也可以是混合物。
三、阿伏加德罗定律及其推论1.阿伏加德罗定律(1)定律:同温同压下,________的任何气体都含有________的分子(即“四同”)。
(2)解释:同温同压下的气体,体积相同时,分子数必相同;反之,分子数相同时,体积也必相同。
特别提醒(1)阿伏加德罗定律仅适用于气体,可以是单一气体,也可以是混合气体。
(2)定律中的同温、同压不一定指标准状况。
2.阿伏加德罗定律的推论[即学即练]1.判断正误,正确的打“√”,错误的打“×”(1)一定温度、压强下,气体体积由其分子的大小和数目决定。
( )(2)固态物质和液态物质的体积决定于粒子大小和粒子数目。
( )(3)同温同压下,若两种气体所占体积不同,其主要原因是气体分子间平均距离不同。
( )(4)1mol一氧化碳和1mol氧气所含的分子数相同,体积也相同。
( )(5)同温同压下,相同体积的任何气体都含有相同数目的原子。
( )(6)同温同压下,1mol气体的体积均为22.4L。
( )(7)标准状况下,1mol任何物质的体积都约为22.4L。

![人教版高中化学必修1[知识点整理及重点题型梳理]-气体摩尔体积-基础](https://uimg.taocdn.com/d17d573be87101f69e319570.webp)
人教版高中化学必修一知识点梳理重点题型(常考知识点)巩固练习气体摩尔体积【学习目标】1、理解气体摩尔体积的含义。
2、掌握气体摩尔体积的有关计算。
【要点梳理】要点一、影响物质体积大小的因素1.影响物质体积大小的因素:从微观来看,影响物质体积大小的因素有三个:微粒个数、微粒大小、微粒间距离。
1 mol任何物质中的粒子数目都是相同的,即约为6.02×1023。
因此,1 mol物质的体积大小主要取决于构成物质的粒子的大小和粒子之间的距离。
2. 影响固体(或液体)物质体积大小的主要因素有两个:微粒个数和微粒自身大小要点诠释:固态或液态物质,粒子之间的距离是非常小的,故1 mol固态或液态物质的体积主要取决于粒子的大小,不同的固态或液态物质,粒子的大小是不相同的,因此,1 mol不同的固态或液态物质的体积是不相同的(见下图)。
固体液体气体3.影响气体物质体积大小的主要因素有两个:微粒个数和微粒间距离。
要点诠释:对于气体来说,粒子之间的距离远大于粒子本身的直径,气体体积与微粒间的距离有关,与粒子本身的直径大小关系不大。
当压强和温度一定时,气体微粒间距离一定,所以当气体分子数一定,则气体体积一定;反之,在压强和温度一定时,相同体积的任何气体分子数相等,这就是常说的阿伏加德罗定律。
如果气体的物质的量为1 mol,则其体积主要取决于气体粒子之间的距离。
而在同温同压下,任何气体粒子之间的平均距离可以看成是相等的,1 mol任何气体都具有相同的体积(见上图)。
要点二、气体摩尔体积1、气体摩尔体积的含义:在一定温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积,符号是V m ,它的常用单位是L·mol -1和m 3·mol -1。
关于物质的量(n )、气体的体积(V )和气体摩尔体积(V m )之间的计算公式为m V V n =。
可变形为V=n·V m 与mV n V =。
