有机化学课件 第二版 高占先主编 (第4章 结构的表征)
- 格式:ppt
- 大小:2.12 MB
- 文档页数:97




有机化学第二版(高占先)(全14章答案完整版)_第8-14章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!!Ps:亲!给好评,有送财富值哦! #^_^!!第8章卤代烃8-2 完成下列各反应式。
(CH3)3CBr C2H5OH(CH3)2C=CH2+CH3CH=CH2HBr+O OCH3CH2CH2CH3CH2CH2CNNaCN(1)(2)(CH3)2CHCH=CH2Br+500℃(CH3)2CCH=CH2Br H2O(CH3)2C=CHCH2Br +(CH3)2CCH=CH2OH(CH3)2C=CHCH2OH +(3)NaCNKOH25(4)(5)(6)ClCH=CHCH2Cl CH3+ClCH=CHCH2OCCH3OBrBrBrCNCH2CHCH3BrCH=CHCH3CH3 Br2NH3(l)CH3NH2CH32+ClCl NO2NaOH-H2OOHClNO2ZnCl2(HCHO + HCl)+CH2ClMgCH2MgCl CH2COOH ClCH2CHCH2CH2CH3PhCH2MgClCH3+PhCH2CH2CHCH2CH2CH3CH3(7)(8)(9)(10)3RC CLi(11)RC CR'RC CCOOHRC CCH2CH2OHCHBr3BrBr(12)8-3写出下列反应主要产物的构型式。
CC2H5CH 3NaI+CC2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrCH2CH2CH3CCH2CH32Lindar催化剂CHCCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么?(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点?(1)产物发生Walden转化;S N2(2)增加溶剂的含水量反应明显加快;S N1(3)有重排反应产物;S N1(4)反应速率明显地与试剂的亲核性有关;S N2(5)反应速率与离去基的性质有关;S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
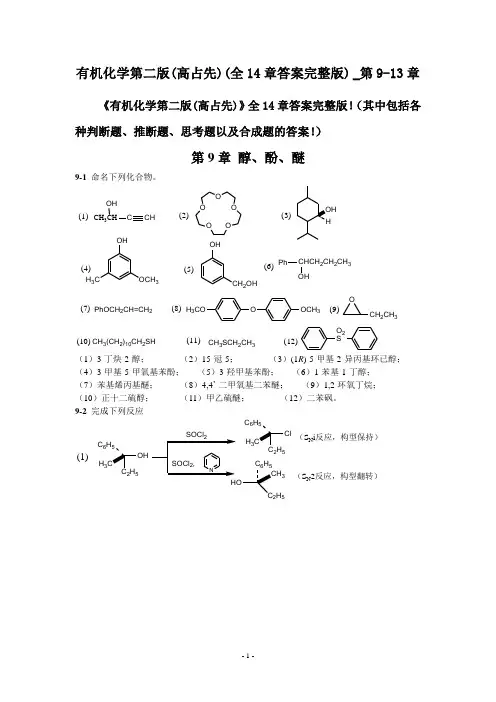
有机化学第二版(高占先)(全14章答案完整版) _第9-13章《有机化学第二版(高占先)》全14章答案完整版!(其中包括各种判断题、推断题、思考题以及合成题的答案!)第9章 醇、酚、醚9-1 命名下列化合物。
CH 3CHOHCCHO OO OO OHH 3COCH 3OHCH 2OHPhCHCH 2CH 2CH 3OHPhOCH 2CH=CH 2OOCH 3H 3COOCH 2CH 3CH 3(CH 2)10CH 2SHCH 3SCH 2CH 3O 2S(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(1)3-丁炔-2-醇; (2)15-冠-5; (3)(1R )-5-甲基-2-异丙基环已醇; (4)3-甲基-5-甲氧基苯酚; (5)3-羟甲基苯酚; (6)1-苯基-1-丁醇; (7)苯基烯丙基醚; (8)4,4’-二甲氧基二苯醚; (9)1,2-环氧丁烷; (10)正十二硫醇; (11)甲乙硫醚; (12)二苯砜。
9-2 完成下列反应(1)25H 3C 6H525H 3C 6H 52H 53(S N i 反应,构型保持)(S N 2反应,构型翻转)OH CH 3H PBr 3H CH 3Br(S N 2反应,构型翻转)(CH 3)3CCH 2OHH 2SO 4CrO 3,(CH 3)2C=CHCH 3(E1反应,碳架发生重排)HOOH CH 3NOOHCH 3(弱氧化剂不能氧化叔醇和双键)O3OH(S N 2反应,进攻位阻较小的碳原子)(2)(3)(4)(5)OHHCO 3H H 2O / H(6)OHH HOHOHH +(中间产物为环氧化物,亲核试剂进攻两碳原子的几率相等)CH 3AlCl 3(8)OH+CH 3OOHCO CH 3(Fries 重排,热力学控制产物)(7)OH OHOOO (频哪醇重排)(邻二醇氧化)222(10)O CH 2CH=CHCH 2CH 3OH(1) NaOH (9)OHOHOO (亲核取代反应)H 3CCH 3*OHH 3C3CH 2CH=CHCH 2CH 3*(发生两次Claisen 重排)OH OHC +(Reimer-Tiemann 反应)(11)C 2H 5SH(13)CH 3CH 2CHCH 2CH 3(15)CH 3Br +(12)OCH 3+CH 3CH 2CHCH 2CH 3OH+(S N 2反应)OHOBrHBr(S N 1反应)(CH 3)2CHCH 2CH 2CH 2Br+OH(CH 3)2CHCH 2CH 2CH 2SVH 2CH 3(S N 2反应)OH HClH H OH H OHOHHOHH (1) OH (2) H 2O(14)9-3 将下列各组组化合物按酸性由强至弱排列成序。


第四章 结构的表征4-1 如何用IR 光谱区别下列各组化合物。
(1)异戊烷分子中有异丙基,在1370—1380cm -1 的吸收峰分裂成两峰,强度接近;(2)在3000cm -1以上无吸收峰者为丁烷; (3)在3000—3100cm -1无吸收者为环已烷;(4)在3010cm -1附近有吸收峰者为甲叉基环已烷(亚甲基环已烷);(5)在3025cm -1附近和2720cm -1处有强吸收峰者为4-已烯醛;(6)在1060cm -1附近有强吸收峰者为正戊醇;(7)在1750—1860cm-1出现两个峰,其中高频峰强于低频峰者为乙酐。
4-2 如何用1H-NMR 谱区分下列各组化合物?(1)环丁烷只有一个单峰,而甲基环丙烷有四组吸收峰;(2)新戊烷只有一个单峰,而正戊烷有三组吸收峰;(3)前者(1-氯-2-溴乙烷)有两组峰,而后者(1,2-二溴乙烷)只有一个单峰。
4-3 比较下面两化合物中所标出的质子在1H-NMR 谱中化学位移大小,并从低场到高场的顺序排列。
(1)B →A →C →D ; (2)A →B →C 。
4-4 请将下列各化合物中画线的质子的化学位移按由低场至高场的顺序排列。
(2)→(1)→(3)。
4-5将下列化合物按C=O 健伸缩振动吸收波数由大到小排列成序。
(1)→(2)→(3)。
4-6 请将下列各组化合物按紫外吸收波长由大到小的顺序排列。
(1) B →D →A →C ; (2) D →C →B →A 。
4-7根据NMR 谱推测下列化合物可能的构造式。
CCH 3CH 3H 3C Br CH 2OH CH 3CH CH 3(1)(2)(3)(4)CH 2CH 2CHCH 34-8某化合物的分子式为C 4H 8O,它的红外光谱在1715cm -1有强吸收峰,它的核磁共振谱有一单峰,相当于三个H ,有一四重峰相当于二个H ,有一三重峰相当于三个H.。
试写出该化合物的构造式。
CH 3CCH 2CH 3O该化合物为丁酮,其构造式为4-9根据光谱分析,分别推断下列各芳香族化合物可能的构造式。


化学,应用化学,化工,制药类各专业有机化学及实验教学大纲(试用)讲课学时:80 学时;实验学时:64学时大连理工大学化工学院化学系有机化学教研室2 0 0 9 年7 月有机化学教学大纲本大纲参考教育部化学与化工学科教学指导委员会于2006年拟订的化学专业《化学教学基本要求》制订。
讲课学时80。
章次目录第1章结构与性能概论4学时第10章醛酮醌6学时第2章分类及命名5学时第11章羧酸及其衍生物5学时第3章同分异构现象5学时第12章有机含氮化合物6学时第4章结构的表征 4 学时第13章杂环化合物5学时第5章饱和烃4学时第14章糖3学时第6章不饱和烃7学时第15章氨基酸蛋白质核酸2学时第7章芳香烃5学时第16章生物碱类脂萜及甾族化合物0学时第7章卤代烃6学时第17章有机合成基础4学时第9章醇酚醚5学时第18章绿色有机合成2学时教材:高占先主编有机化学第二版(国家精品教材—2008年)高等教育出版社2007年第1章结构与性能概论(4节4学时)纲目注释1.1 有机化合物和有机化学1 有机化合物与有机化学讲述定义,一般特性2 有机化学发展史讲述定义,发展史,有机化学与其它学科、国民经济关系1.2 分子结构1 学习方法2构造及构造式路易斯式、短线式、缩简式、键线式3共价键的形成甲键理论(杂化轨道,单、双、三键),分子轨道理论4 共价键的基本属性键长、键角、键能、键的极性、键的极化性5共振论简介简介共振论概念、用途,共振结构式书写规则,6 键的极性在链上的传递------诱导效应给电子基、拉电子基及其相对强度1.3 反应、试剂与反应控制1 有机反应中共价键断裂方式与反应类型反应过程共价键电子得失,均裂、异裂,共价键形成2 有机反应中间体的概念碳正离子、碳负离子、碳自由基的活泼性、构型3 试剂的分类亲电试剂、亲核试剂及其相对强度,亲电与亲核的相对性1.4 酸碱的概念和反应溶剂1酸碱理论共轭酸碱对,强度,酸碱的相对强度包括lewis酸碱与亲电、亲核试剂的关系2 溶剂的分类与溶剂化作用以界电常数、是否能形成氢键分类溶剂化作用,对化学反应的影响第2章分类及命名(5节5学时)2.1 分类方法和命名方法重点以碳架、官能团分类1 分类方法2 命名用介词8个介词的用法,基的命名,正、异、新,伯、仲、叔、季用法3普通命名法重点是普通命名法4俗名和简称2.2系统命名法重点三个规则2.3 烃的命名重点脂肪饱和链烃命名1开链烃命名,2 环烃命名,2.4烃衍生物的命名官能团做取代基、在链端、中间、任意位置四类1 烃衍生物命名(卤烃、硝基烃、氨基烃),2烃衍生物命名(含氧化合物),2.5 混合官能团化合物的命名运用三个规则第3章同分异构现象(5节5学时)3.1 构造异构和构象异构现象1 构造异构碳链异构、官能团位置异构、官能团异构、互变异构2链烷烃的构象重点乙烷、丁烷的构象3小环烷烃的结构及不稳定性重点环己烷、取代环己烷的构象3.2 几何异构现象1含双键化合物的几何异构顺/反、E/Z标记方法2含碳环化合物的顺反异构顺/反标记方法3.3 含手性中心化合物的对映异构现象1分子的手性与旋光性,手性概念、旋广度、比旋光度2手性分子的判断与表示,三种方法,重点费歇尔式,R/S、D/L标记3含两个手性碳分子异构现象,4含多个手性碳分子异构现象,3.4 非手性中心化合物的对映异构现象和构象对映体异构现象1含手型轴和手型面分子异构现象,1,2-丙二烯类,螺苯类2环状手性化合物,3.5 化合物的旋光性与对映体的拆分及合成1外消旋体的拆分分子结构决定旋光性重点化学拆分2不对称合成的概念第4章结构的表征(4节4学时)4.1 研究结构的基本程序4.2 红外光谱鉴定官能团4.3 核磁共振谱鉴定相邻碳原子及其相连的氢原子数目4.4 紫外光谱和质谱鉴定共轭体系、确定分子结构及相当分子质量第5章饱和烃(3节4学时)5.1 结构及链烷烃的物理性质给出各种骨架烷烃包括特殊的立方烷1同系列概念,同系列概念;2烷烃的物理性质,正构烷烃的物理常数变化规律5.2 烷烃的化学性质1 烷烃卤代反应氯代反应机理,卤代反应规律,碳自由基稳定性规律2卤代反应机理3 氧化反应4 裂解及异构反应5.3 环烷烃的性质1小环烃加成反应,不对称取代小环烷烃加成反应规律2环烷烃的氧化反应,3稠环烷烃及饱和烃来源。
有机化学(第二版)课后习题参考答案第一章绪论1-1扼要解释下列术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB 拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4)极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9)亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。